青娥丸对绝经后骨质疏松症患者骨密度、骨代谢指标和骨硬化蛋白的影响
王欣燕 刘建红 黄显元
攀枝花市第二人民医院老年科,四川 攀枝花 617000
雌激素缺乏通过增加破骨细胞再吸收而不会相应增加成骨细胞活性而损害正常生理周期,导致绝经后妇女出现一种以骨质流失和骨微结构恶化为特征的内分泌疾病[1]。在全球范围内,患骨质疏松症的人数超过1亿。骨质疏松症的致命临床危险是骨质减少性骨折,包括脊柱骨折、股骨颈骨折和桡骨远端骨折,单独骨质减少的髋部骨折(约占所有骨质减少性骨折的20%)死亡的终身风险与死于乳腺癌的风险相同[2]。骨硬化蛋白是一种由骨细胞产生的糖蛋白,被评估为骨转换的潜在临床标志物[3-4]。最近的一份报告发现健康女性血清25羟维生素D与硬化蛋白水平之间存在正相关[5]。硬化蛋白被称为骨吸收抑制剂,并且一些横断面研究报道了血清硬化蛋白与骨转换的各种生化标志物的反向关联[6]。补充阿法骨化醇和钙可使其他骨转换标志物水平降低高达10%,并改变血清硬化蛋白水平[7]。青娥丸(QEW)是一种中草药配方,具有较好的强腰膝、壮筋骨的功效。初步研究表明,QEW不仅能抑制破骨细胞的骨吸收活动,还能促进成骨细胞的增殖,促进成骨[8],但是否改变血清硬化蛋白水平尚未阐明。为了解QEW调节骨细胞的机制,有必要阐明QEW对血清硬化蛋白水平的影响。为此,我们探讨了QEW治疗12个月,及与钙和安慰剂相比,PMOP中的血清硬化蛋白水平改变情况。
1 材料和方法
1.1 患者和分组
本研究纳入2017年5月到2018年1月在我院就诊的患者(>55岁)为研究组。排除标准:继发性疾病和病症包括涉及重要器官(如心、肺、肝、肾和脑)的慢性疾病,严重的代谢性疾病(如糖尿病、甲状旁腺功能亢进或甲状旁腺功能亢进)和其他骨骼疾病(如佩吉特)疾病和类风湿性关节炎),长期使用影响骨代谢的药物(如皮质类固醇治疗和抗惊厥药物),入组前2个月使用钙或维生素D补充剂,影响骨代谢、肾脏或肝脏疾病的因素或药物。在168名被招募的女性中,有48名不符合纳入标准。共有120名PMOP患者参加了本研究,平均年龄为(52±7)岁。将受试者(包括住院患者或门诊患者)随机分为3组(每组n=40):QEW组:每天给予600 mg钙片和青娥丸(国药准字Z11021105,北京同仁堂股份有限公司同仁堂制药厂,9 g/丸)口服治疗,一次1丸,一日2次的组合治疗;ALF组,每天给予600 mg钙片和每天1 μg阿法骨化醇胶囊联合治疗;对照组,每天给予600 mg钙片治疗,治疗持续1年。该方案经我院伦理委员会批准。在进入研究之前,每位参与者都签署了书面知情同意书。
1.2 疗效评价
治疗前后使用双能X射线吸收测定法(Lunar Prodigy Advance; GE Healthcare,USA)测量腰椎(L1-L4)和右侧股骨颈的BMD。根据制造商的说明将患者置于适当位置。然后捕获并分析图像,并参考世界卫生组织诊断标准(T值和g/cm2)报告结果。将患者的连续扫描区域的变化调整到5%的范围内,测量精度对于L1-L4为0.8%,对于股骨颈为1.1%。每人使用相同的设备进行所有BMD测量;患者在上午7点时通过肘静脉抽取血样。然后将收集的血液样品以3 000 r/min和20 ℃室温下离心15 min,然后在-80 ℃下储存。随后将所有血样送至中心生化实验室,分析硬化蛋白、25羟基维生素D和骨转换标志物的水平,如胶原特异序列(β-Crosslaps,β-CTX)、N末端骨钙素(N-MID)和Ⅰ型前胶原的总N-末端前肽(T-PINP)。人硬化蛋白ELISA试剂盒(Yanhui biotechnology Co.Ltd,中国上海),自动化Roche electrochemiluminescence系统(Roche Diagnostics GmbH,Germany),所有试剂盒均按照制造商的方案进行检测,测定内和测定间CV<4%。
1.3 统计学处理
2 结果
三组受试者的基线特征如表1所示,三组的年龄、体重、身高、BMI和雌二醇方面比较差异无统计学意义 (P均>0.05)。所有参与者完成了1年后的最终随访并完善相关检测指标。
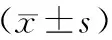

项目QEW组ALF组对照组年龄/岁58.3±3.558.5±3.658.4±3.6绝经年龄/岁53.8±2.753.9±2.753.4±2.4体重/kg59.64±5.6960.04±6.0158.98±5.67身高/m1.62±0.051.64±0.111.61±0.04BMI/(kg/m2)23.63±2.5224.06±2.2323.54±2.46雌二醇/(pmol/mL)37.15±12.5638.51±12.7738.18±13.06
治疗前三组间BMD差异无统计学意义 (P均>0.05)。治疗12个月后,与治疗前相比,QEW组和ALF组腰椎和股骨颈BMD明显增加(P<0.05),但两组之间腰椎和股骨颈BMD比较差异无统计学意义 (P均>0.05)。对照组的BMD在治疗后12个月显著下降(P<0.05);治疗前3组患者血清硬化蛋白和25羟维生素D水平差异无统计学意义 (P均>0.05)。治疗12个月后,QEW组和ALF组血清硬化蛋白和25羟维生素D水平均升高,但是两组间差异无统计学意义(P均>0.05)。但两组的水平显著高于对照组(P<0.05),见表2。
在治疗前,三组患者血液中β-CTX,N-MID和T-PINP水平差异无统计学意义 (P均>0.05)。治疗12个月,QEW组和ALF组血清β-CTX,N-MID和T-PINP水平均降低,但是两组间差异无统计学意义(P均>0.05);但两组血清β-CTX,N-MID和T-PINP水平显著低于对照组(P<0.05),见表3。

表2 三组中不同时间点的BMD,硬化蛋白和25-羟基维生素D的水平Table 2 Levels of BMD, sclerostin and 25-hydroxyvitamin D at different time points in three groups
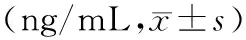
表3 三组中不同时间点的β-CTX,N-MID和T-PINP的水平Table 3 Levels of T-PINP, N-MID, and β-CTX at different time points in three groups (ng/mL,
3 讨论
本研究的结果表明,QEW可通过调节硬化蛋白的表达来减少骨吸收。本研究使用阿法骨化醇作为对照研究的参考药物,因为据报道它在文献中是稳定和有效的[9]。数据显示QEW和阿法骨化醇之间具有相似的功效,因为两者都能够增加体内硬化蛋白的表达,从而减少骨吸收并增强骨的质量和数量。结果表明,古代配方QEW在预防和治疗PMOP方面具有相当的疗效,作为阿法骨化醇的适当补充。
硬化蛋白是由骨细胞分泌的Wnt拮抗剂,它可以通过与低密度脂蛋白受体相关蛋白-5和-6结合来调节骨量,从而抑制经典的Wnt/β-联蛋白信号通路。硬化病和范布赫姆病两种相关的遗传性疾病出现骨量的明显增加,强调了骨硬化蛋白在调节人体骨量的生物学中重要性[10-11]。硬化症是由编码硬化蛋白SOST的基因突变引起的,导致SOST mRNA不正常剪接,而范布赫姆病是由SOST基因下游的增强子元件缺失引起的[10-11]。这些研究结果与硬骨素缺乏小鼠骨量增加的证据相结合,导致抗坏血酸中和抗体的发展成为骨质疏松症的新型合成代谢治疗[12]。根据硬化蛋白对骨代谢的作用,预计血清硬化蛋白与骨密度之间呈负相关。然而,之前有一项研究中发现了血清骨硬化蛋白和BMD之间的正相关[11],该研究报道了硬化蛋白水平与全身和腰椎的BMD水平呈正相关,可能原因是中年女性血清硬化蛋白水平,未经年龄调整导致的。Sheng等[13]报道,绝经后妇女血清硬化蛋白水平与全身、腰椎和全髋骨密度呈正相关。对于违反直觉的现象,已经提出了一种可能的解释,即硬化蛋白反映骨细胞的数量,且与BMD成正比[13]。这可能部分解释了为什么在QEW和阿法骨化醇治疗的PMOP患者中血清硬化蛋白水平升高,并且这些患者在该研究中具有更高的BMD。
我们研究证实,与单纯使用钙剂治疗的对照组相比,QEW联合钙剂治疗方案显著增加了PMOP患者血清25羟维生素D和骨硬化蛋白水平,其效果与阿法骨化醇和钙剂治疗相似。这些研究结果表明,QEW和钙补充剂,与阿法骨化醇和钙补充剂相似,增加了人体25羟维生素D水平。由于以下原因,阿法骨化醇和钙的补充可能影响循环硬化蛋白水平。补充这些营养素可降低血清PTH水平[14],PTH是硬化蛋白表达的负调节因子[9]。因此,PTH下降应该增加血清硬化蛋白水平。这些发现也支持QEW和钙补充剂,类似于阿法骨化醇和钙补充剂,增加了硬化蛋白水平。即使本研究使用QEW的1年治疗也与骨形成标志物的显著增加有关。
β-CTX,N-MID和T-PINP是国际骨质疏松症基金会推荐的三种骨转换标志物。β-CTX是骨基质的有机成分,其中90%是在骨骼中合成的Ⅰ型胶原,但也分解成释放到血液中的降解产物。β-CTX是Ⅰ型胶原蛋白胶原降解的典型产物。β-CTX的检查可用于监测骨质疏松症或其他骨疾病的抗再吸收治疗,并且功效可在数周内反映。N-MID由骨合成期间的成骨细胞产生。血液中都存在完整的骨钙蛋白和大的N-MID片段;然而,前者是不稳定的,可能分裂并降解为后者。N-MID被认为是骨合成的标志物,其可以与-CTX一起用于监测诸如骨质疏松症的疾病的治疗进展。血液中总PINP的水平是骨标志物的测试项目之一,其可用于临床监测绝经后妇女的骨质疏松症的治疗。
我们研究的一个主要局限是没有检测PTH值。此外,可能是我们检测到的参数的血清水平不能准确地反映它们在骨组织中的水平。此外,需要精心设计的研究来验证我们的结果并研究其重要性。总的来说,QEW可以有效改善绝经后骨质疏松症患者骨代谢和骨密度以及骨硬化蛋白的水平。

