牛至精油对甘肃高山细毛羊肉品质、脂肪酸组成及含量和抗氧化性能的影响
刘婷,吴建平,*,宫旭胤,雷赵民,梁婷玉,张瑞
1(甘肃农业大学 动物科学技术学院,甘肃 兰州,730030) 2(甘肃省农业科学院 畜草与绿色农业研究所,甘肃 兰州,730030)
抗生素和生长促进剂在畜牧业生产过程中带来的养殖安全、食品安全、环境安全等问题越来越受到公众的关注。2019年7月9日,中华人民共和国农业农村部第194号公告[1]:自2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料。此前已生产的商品饲料可流通使用至2020年12月31日。因此,利用植物和植物提取物作为抗生素替代物提高反刍动物饲喂效率、保证或改善反刍动物产品品质越来越受到重视。在众多替代物中,精油因长期被认为具有免疫刺激、抗炎、抗氧化和抗菌特性[2-4]而成为研究热点。精油是由植物(草药或香味料)产生的具有挥发性的芳香族次生代谢产物,含有多种不同化合物(每种精油含20~60种成分),其主要化合物为萜类(源于甲羟戊酸和脱氧葡萄糖途径)或苯丙类化合物(源于莽草酸途径),包括牛至(Origanumvulgare)、大蒜(Alliumsativum)、山葵(Armoraciarusticana)等[5]。植物也因精油而具有各自独特的气味、风味,这种特有的味道使得植物免受微生物、草食动物或紫外线辐射的伤害[5]。目前,对于精油在反刍动物生产中的研究主要集中在对动物生长性能[6]、繁殖性能[7]、甲烷排放量[8]、瘤胃微生物[9]等方面,而对采食含精油日粮的反刍动物产品(肉、奶)品质研究较少。
精油还具有较强的抗氧化性,能清除由单核细胞、中性粒细胞、嗜酸性粒细胞和巨噬细胞通过细菌吞噬作用产生的大量活性氧(reactive oxygen species, ROS),并减少与炎症减轻有关的组织氧化损伤[10]。大量研究表明,日粮中添加抗氧化剂可减轻牲畜的氧化应激、提高动物产品的质量[4]。牛至精油是一种由百里香酚、香芹酚等组成的淡黄色透明混合液体,除具有广谱抗菌活性外[2],同时具有较强的抗氧化作用,该作用被认为与减少肿瘤细胞增殖及细胞凋亡或坏死效应有关[10]。本课题组前期研究发现:牛至精油可作为一种保鲜剂提高冷鲜羊肉货架期抗氧化能力并延长冷鲜羊肉货架期[11]。此外,在日粮中添加牛至精油可提高甘肃高山细毛羊肌肉CLA含量[12]。然而,目前关于牛至精油对甘肃高山细毛羊肌肉抗氧化能力和肉品质的影响未见报道。因此,本研究以甘肃高山细毛羊为研究对象,在全舍饲条件下,通过在日粮中添加0、1、2 g/d牛至精油,研究其对羊肉品质、抗氧化性能和脂肪酸组成的影响,为牛至精油作为饲料添加剂在甘肃高山细毛羊生产中的应用提供科学依据。
1 材料和方法
1.1 试验地点与动物
试验地点位于甘肃省张掖市甘州区平山湖乡红沙窝养殖基地(海拔1 650 m),年平均温度5.7 ℃左右,年平均降水量129 mm。试验动物甘肃高山细毛羊来自甘肃省张掖市肃南县。
1.2 试验设计与样品采集
选择60日龄、体况相近、健康状况良好的断奶甘肃高山细毛羊母羔羊18只,初始体重为(20.40±1.75)kg,随机分为3组,每组各6只,单栏饲喂。对照组:仅饲喂基础饲粮(不添加牛至精油);试验组1:除基础饲粮外,每天每只羊添加1 g牛至精油至精料中;试验组2:除基础饲粮外,每天每只羊添加2 g牛至精油至精料中。牛至精油购自美国Ralco 动物营养公司,饲喂前均按各试验组预定剂量装入胶囊后饲喂。所有试验羊只自由采食、饮水,试验饲粮组成及营养水平见表1。
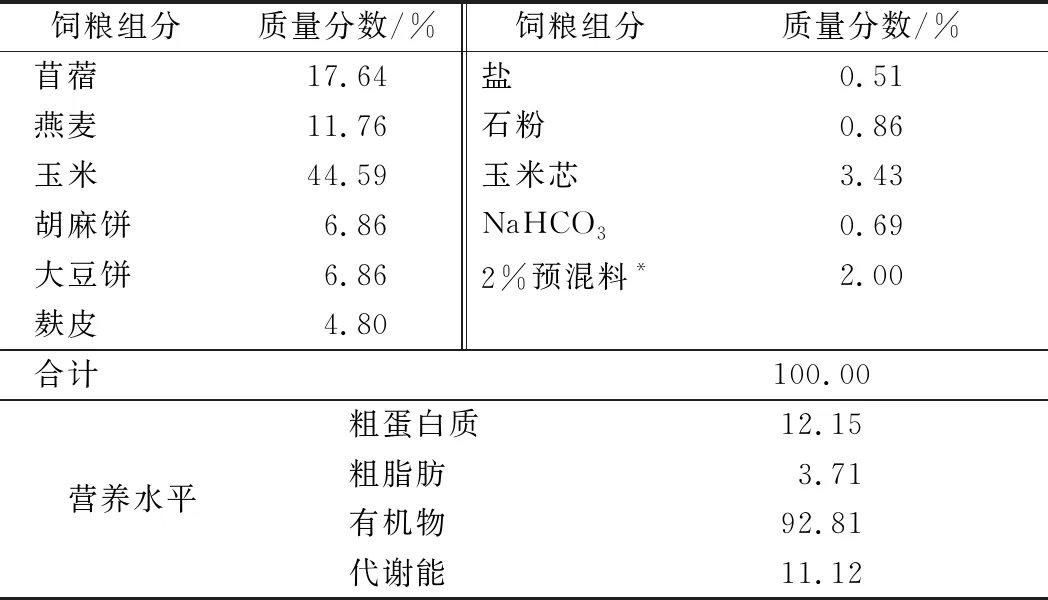
表1 基础饲粮组成及营养成分(风干基础)Table 1 Composition and nutrient levels of the basaldiet (air-dry basis)
注:*,预混料为每千克饲粮提供:VA4 400 IU,VE20 IU,VD31440 IU,VD0.8 mg,Fe 16.6 mg,Zn 40.1 mg,Mn 14.2 mg,Cu 13.6 mg,Co 0.2 mg,烟酰胺40 mg
试验期共104 d,预饲期14 d,试验期90 d。最后1 d所有试验动物禁食24 h后称重(各组平均体重为34~39 kg),所采样品均采自试验羊只左侧胴体背最长肌(50 g/只),真空包装,冰盒运输置于-80 ℃冰箱保存,待测样品中脂肪酸组成和含量。此外,在高山细毛羊颈静脉处采用肝素钠真空抗凝管采血10 mL,血样放于冰盒中避光静置,然后在3 000 r/min下离心10 min,取血清保存于-80 ℃冰箱,用于测定超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽(glutathione, GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、维生素A(VA)和维生素E(VE)。
1.3 试验方法
1.3.1 肉质测定
(1)pH值:直接在胴体倒数第3与第4胸椎处背最长肌上刺孔测定,不同位置重复测定3次,取平均值。
(2)肉色:取背最长肌中段肉样;先将色度仪用校正板标准化,然后将镜头垂直于肉面上,镜口紧扣肉面(不能漏光)按下摄像按钮,色度数据即自动存入机器。由于肉面颜色随位置而异,故每个肉面按每15 cm2重复4次的频率不断改变位置重复度量,最后取平均值。
(3)蒸煮损失:取2.5 cm厚的肉块,分别称重(m1);将肉块装入耐热的真空袋;将直径约0.5 cm的温度计插入肌肉中心部位,扎好口袋,使口袋朝上放入80 ℃恒温水浴锅中;加盖持续加热,直至肌肉中心温度达到70 ℃时为止;取出肉样,室温下使肌肉冷却至20 ℃,用吸水纸吸干表面水分,称重(m2)。按公式(1)计算:

(1)
(4)熟肉率:取约30 g左右大小形状基本一致的肉块,称重(m1);100 ℃蒸锅(1 500 W)中蒸30 min;取出肉样,冷却至室温,用吸水纸吸干表面水分;准确称重(m2)。按公式(2)计算:

(2)
(5)失水率:肉样平置在洁净的铁片上切取其中1 cm厚一片;用圆形取样器在中心部位取样直径2.52 cm,立即天平称重(m1);纱布包裹,然后放于上下各18层吸水性好的滤纸中,外面再夹以不吸水的铁板;置于压力仪上加压35 kg,保持5 min。撤除压力后,立即称量肉样质量(m2)。按公式(3)计算:

(3)
(6)剪切力:取中心温度为0~4 ℃肉样,放入80 ℃恒温水浴锅加热,待肉样中心温度达到70 ℃时,将肉样取出,冷却至中心温度为0~4 ℃。用直径为1.27 cm的圆形取样器沿与肌纤维平行的方向取样,孔样长度≥2.5 cm,取样位置应距离样品边缘≥5 mm,2个取样的边缘间距≥5 mm,剔除有明显缺陷的孔样,测定样品数≥3个,取样后应立即测定。
1.3.2 脂肪酸测定
羊肉的甲酯化处理参考LIU等[13]的方法。气相色谱条件:6890N型气相色谱仪;SP-2560型毛细管柱(100 mm×0.25 mm×0.20 μm,Sigma-Aldrich公司);FID氢火焰离子检测器;载气(N2)压为0.8 kg/cm2;空气压为0.5 kg/cm2;采用分流进样,分流比为100∶1;进样口温度为260 ℃。
1.3.3 抗氧化特性测定
血清中SOD、CAT、GSH、GSH-Px,采用分光光度计比色检测法测定,检测所用试剂盒购自南京建成生物工程公司,货号分别为:A001-1、A007-1、A006-1、A005,具体检测步骤详见试剂盒说明书。VA和VE含量检测采用高效液相色谱分析仪(美国Agilent公司UPLC1290)进行检测。
1.4 数据处理
采用Excel 2016整理数据,SPSS 19.0进行交叉分组方差分析,用Duncan’s多重比较检验组间差异性(P<0.05或P<0.01)。
2 结果与分析
2.1 牛至精油对羊肉抗氧化指标的影响
由表2可知,经过104 d试验期后,试验组1和试验组2甘肃高山细毛羊血清中GSH均显著高于对照组(P<0.05),且试验组2甘肃高山细毛羊血清中GSH显著高于试验组1(P<0.05)。试验组2甘肃高山细毛羊血清中GSH-Px显著高于对照组(P<0.05)与试验组1无显著差异(P>0.05),试验组1甘肃高山细毛羊血清中GSH-Px与对照组也无显著差异(P>0.05)。试验组1和试验组2甘肃高山细毛羊血清中VA均显著高于对照组(P<0.05)。其他抗氧化指标SOD、CAT和VE在各组间差异不显著(P>0.05)。
2.2 牛至精油对羊肉品质的影响
由表3可知,各组甘肃高山细毛羊背最长肌 pH、熟肉率、亮度(L*)、黄度(b*)均无显著差异(P>0.05)。试验组1和试验组2甘肃高山细毛羊背最长肌蒸煮损失显著低于对照组(P<0.05)。试验组1和试验组2甘肃高山细毛羊背最长肌a*值显著高于对照组(P<0.05),试验组1和试验组2甘肃高山细毛羊背最长肌a*值无显著差异(P>0.05)。试验组1和试验组2甘肃高山细毛羊背最长肌失水率显著低于对照组(P<0.05),试验组1和试验组2甘肃高山细毛羊背最长肌失水率无显著差异(P>0.05)。各组间甘肃高山细毛羊背最长肌剪切力差异显著(P<0.05),试验组2显著低于试验组1和对照组(P<0.05),对照组甘肃高山细毛羊背最长肌剪切力最大。
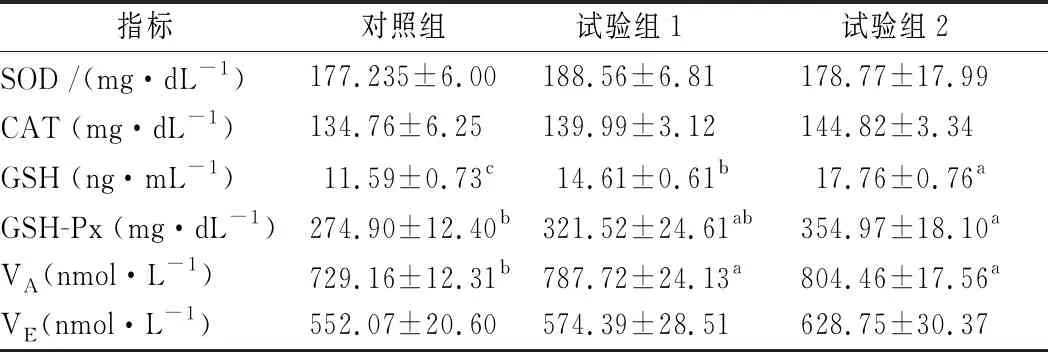
表2 牛至精油对甘肃高山细毛羊血清抗氧化指标的影响Table 2 Effects of oregano essential oil on serumantioxidant indices of Gansu Alpine fine-wool sheep
注:同行数据肩标无字母或相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)(下同)
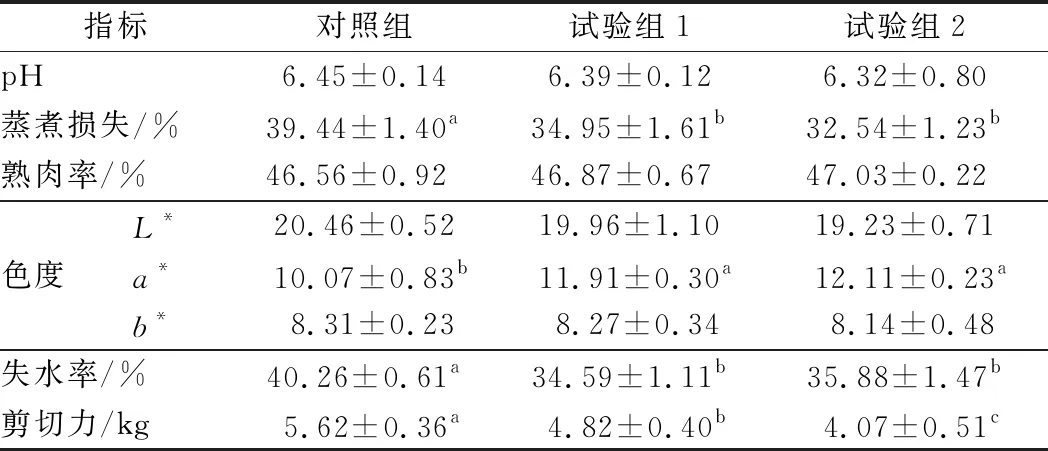
表3 添加牛至精油对甘肃高山细毛羊背最长肌肉品质的影响Table 3 Effects of oregano essential oil on meat qualityin longissimus dorsi muscle of Gansu Alpine fine-wool sheep
2.3 牛至精油对羊肉中脂肪酸组成的影响
由表4可知,各组甘肃高山细毛羊背最长肌中共检测出10种饱和脂肪酸(saturated fatty acid, SFA)、8种单不饱和脂肪酸(monounsaturated fatty acid, MUFA)和9种多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)。SFA含量最高的为棕榈酸(C16∶0),MUFA含量最高的为油酸(C18∶1n9c),PUFA含量最高的为亚油酸(C18∶2n6c)。各组间甘肃高山细毛羊背最长肌中SFA和UFA(不饱和脂肪酸)差异显著(P<0.05):对照组甘肃高山细毛羊背最长肌中SFA含量显著高于试验组1和试验组2(P<0.05),对照组甘肃高山细毛羊背最长肌中UFA含量显著低于试验组1和试验组2(P<0.05)。PUFA和MUFA在各组间差异均不显著(P>0.05)。此外,饱和脂肪酸中,肉豆蔻酸(C14∶0)、十五烷酸(C15∶0)、棕榈酸(C16∶0)、十七烷酸(C17∶0)、榆树酸(C22∶0)在各组间差异显著(P<0.05):对照组甘肃高山细毛羊背最长肌中C14∶0含量显著高于试验组1(P<0.05)与试验组2无显著差异(P>0.05),且试验组1和试验组2差异不显著(P>0.05);对照组甘肃高山细毛羊背最长肌中C15∶0含量显著低于试验组2(P<0.05),与试验组1差异不显著(P>0.05);对照组甘肃高山细毛羊背最长肌中C16∶0含量显著高于试验组1和试验组2(P<0.05);试验组1甘肃高山细毛羊背最长肌中C17∶0含量显著高于对照组和试验组2(P<0.05);对照组甘肃高山细毛羊背最长肌中C22∶0含量显著低于试验组1(P<0.05)与试验组2差异不显著(P>0.05)。单不饱和脂肪酸中,十七碳烯酸(C17∶1)、二十碳烯酸(C20∶1)、神经酸(C24∶1)在各组间差异显著(P<0.05):试验组2甘肃高山细毛羊背最长肌中C17∶1含量显著低于试验组1(P<0.05)与对照组差异不显著(P>0.05);试验组2甘肃高山细毛羊背最长肌中C20∶1含量显著高于对照组(P<0.05)与试验组1差异不显著(P>0.05);对照组甘肃高山细毛羊背最长肌中C24∶1含量显著低于试验组1和试验组2(P<0.05)。各组间,多不饱和脂肪酸与饱和脂肪酸的比值(P/S)、n-6多不饱和脂肪酸(n-6 PUFA)、n-3多不饱和脂肪酸(n-3 PUFA)及n-6 PUFA与n-3 PUFA比值(n-6/n-3)差异均不显著(P>0.05)。
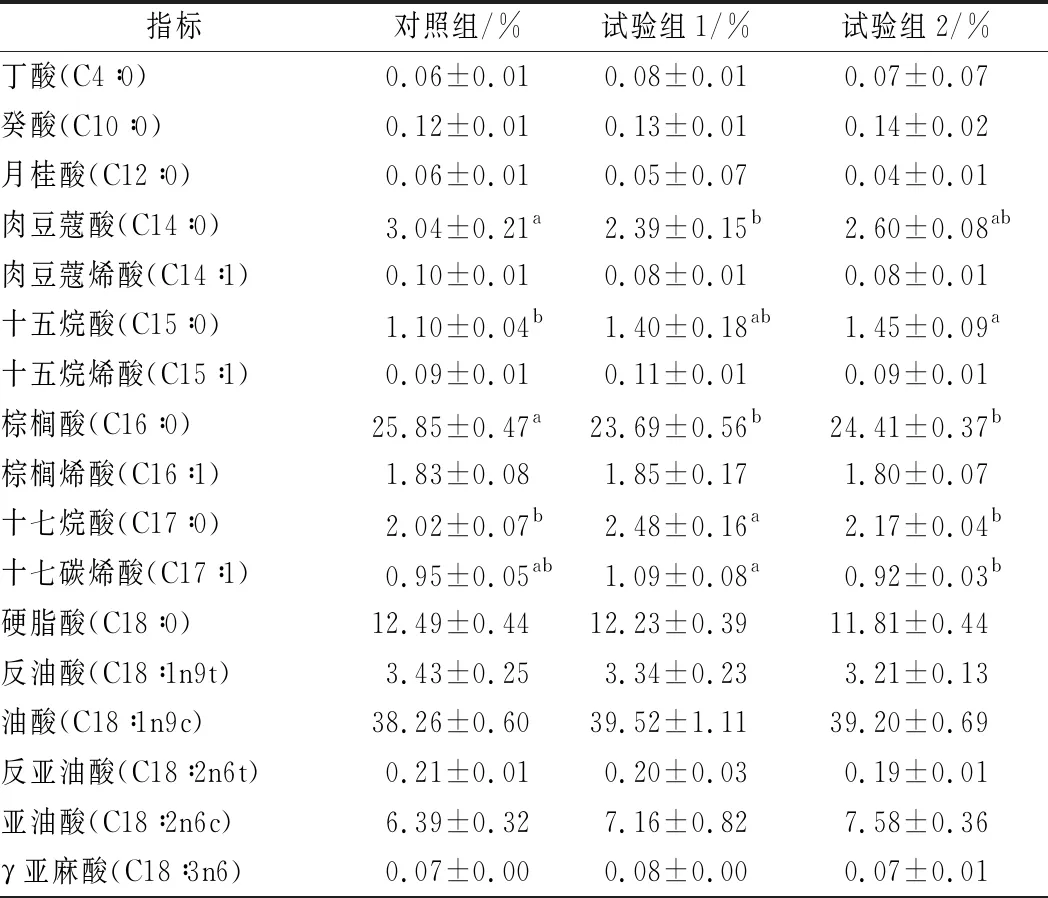
表4 添加牛至精油对甘肃高山细毛羊背最长肌脂肪酸组成的影响
续表4
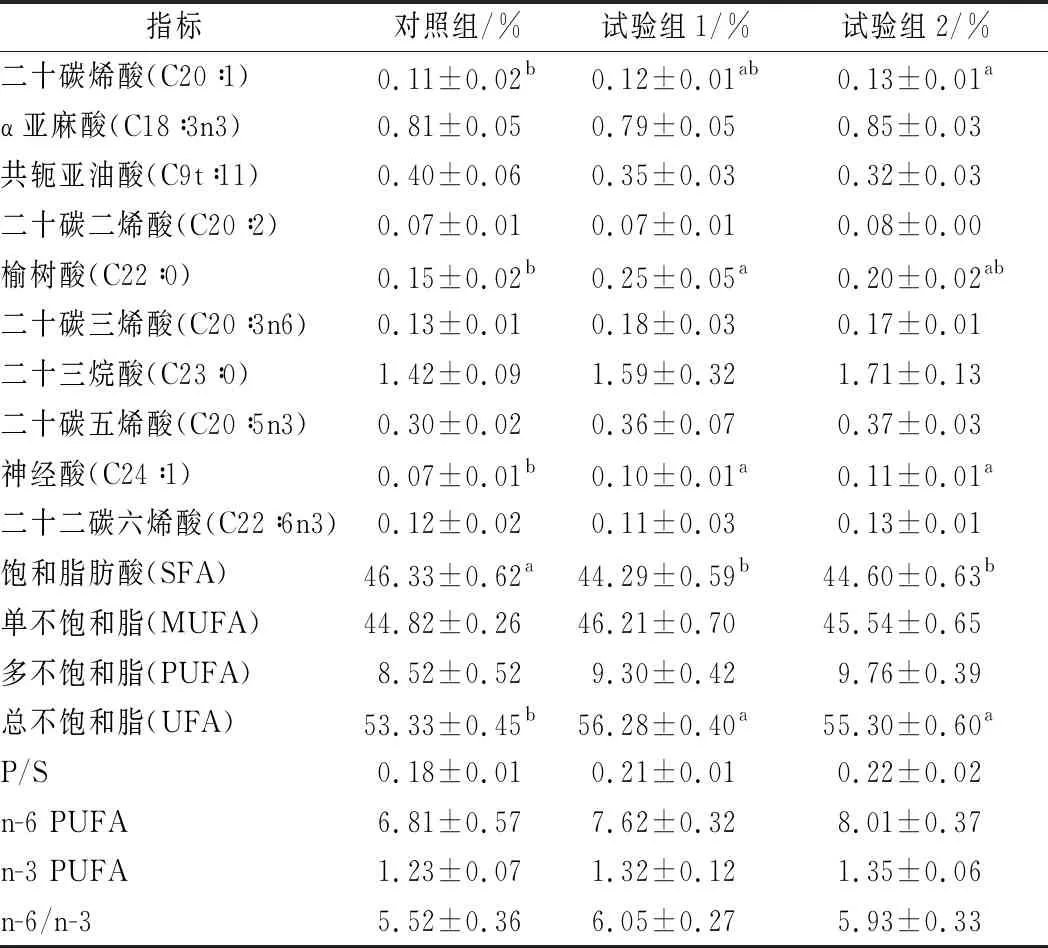
指标对照组/%试验组1/%试验组2/%二十碳烯酸(C20∶1)0.11±0.02b0.12±0.01ab0.13±0.01aα亚麻酸(C18∶3n3)0.81±0.050.79±0.050.85±0.03共轭亚油酸(C9t∶11)0.40±0.060.35±0.030.32±0.03二十碳二烯酸(C20∶2)0.07±0.010.07±0.010.08±0.00榆树酸(C22∶0)0.15±0.02b0.25±0.05a0.20±0.02ab二十碳三烯酸(C20∶3n6)0.13±0.010.18±0.030.17±0.01二十三烷酸(C23∶0)1.42±0.091.59±0.321.71±0.13二十碳五烯酸(C20∶5n3)0.30±0.020.36±0.070.37±0.03神经酸(C24∶1)0.07±0.01b0.10±0.01a0.11±0.01a二十二碳六烯酸(C22∶6n3)0.12±0.020.11±0.030.13±0.01饱和脂肪酸(SFA)46.33±0.62a44.29±0.59b44.60±0.63b单不饱和脂(MUFA)44.82±0.2646.21±0.7045.54±0.65多不饱和脂(PUFA)8.52±0.529.30±0.429.76±0.39总不饱和脂(UFA)53.33±0.45b56.28±0.40a55.30±0.60aP/S0.18±0.010.21±0.010.22±0.02n-6 PUFA6.81±0.577.62±0.328.01±0.37n-3 PUFA1.23±0.071.32±0.121.35±0.06n-6/n-35.52±0.366.05±0.275.93±0.33
3 讨论
甘肃高山细毛羊是我国培育出的第一个高原型细毛羊品种,该品种是在高寒牧区育成的“毛肉兼用”型细毛羊品种,目前已从“毛主肉从”型转变为“肉毛兼用、肉主毛从”型,是甘肃省肃南县的主要生产家畜之一(全县饲养细毛羊45.99万只)。肃南县地处河西走廊南部,祁连山中段北麓(东西长 650 km,南北宽 120~200 km)。全县由 3 块不连片的地域组成,是祁连山生态环境保护与修复的主战场。随着祁连山生态环境保护与修复力度加深,禁牧和草畜平衡制度的严格执行,高山细毛羊的生产方式由放牧向舍饲转变[14]。有研究报道,全舍饲条件下饲养的动物,其肉品嫩度、色泽和风味等会因缺乏运动(肌肉中抗氧化酶活性下降)而受影响[15]。在饲粮中添加外源性抗氧化剂以提高动物机体抗氧化能力,从而改善肉品质[15]。特别是,在肉类和肉制品中添加控制脂质氧化的添加剂变得越来越重要,因为脂质氧化是肉变质的主要现象,对肉的风味、色泽和营养价值都有负面影响[16]。本试验结果表明:在饲料中添加牛至精油可显著提高甘肃高山细毛羊肉的红度(a*)、减少羊肉蒸煮损失、失水率和剪切力(P<0.05);降低pH值并提高熟肉率(P>0.05)。由表2可知,牛至精油提高了甘肃高山细毛羊机体的抗氧化性能。众所周知,氧合肌红蛋白和高铁肌红蛋白的形成对肉色尤为重要,当肌红蛋白与氧结合生成氧合肌红蛋白时肉色为鲜红色,而当肌红蛋白受氧化形成高铁肌红蛋白时肉色则成褐色[17]。因此,本试验结果甘肃高山细毛羊肉的红度(a*)、蒸煮损失、失水率和剪切力在试验组中与对照组中存在显著的统计学差异,可能与牛至精油较强的抗氧化性有关。这与类红梅等[18]综述中的报道相一致,许多学者将天然抗氧化剂(橄榄油、棕榈油、亚麻籽、葡萄籽等)添加在饲料中,均显著提高了家畜宰后的肉品质、肌肉脂质氧化能力、血液总抗氧化能力等 (P<0.05)。此外, 肌肉pH值与动物宰后肌糖原的酵解速度和强度有关,可影响肌肉肉色、嫩度、保水性等。本研究中各组间pH虽差异不显著(P>0.05),但对照组甘肃高山细毛羊肉中pH值高于2个试验组,且试验组1和2甘肃高山细毛羊背最长肌中剪切力显著低于对照组(P<0.05),这与韦胜等研究牛至精油对羊肉pH值和剪切力的结果相一致[19]。各试验组间甘肃高山细毛羊背最长肌剪切力差异显著(P<0.05),试验组2显著低于试验组1和对照组(P<0.05)。综上所述,饲料中添加牛至精油可改善甘肃高山细毛羊肉品质且试验组2甘肃高山细毛羊肉品质更好。
牛至精油的抗氧化作用被认为与减少肿瘤细胞增殖及细胞凋亡或坏死效应有关[10]。精油可清除 ROS,ROS是机体有氧代谢产生的高活性的含氧及其衍生物,可介导细胞凋亡与自噬、坏死等死亡方式最终影响肉品质,同时还可直接攻击核酸、脂质及蛋白质等生物大分子,引起肉色泽、风味和嫩度等品质的变化[20]。生物体为保证其正常的代谢机能,本身对活性氧的氧化伤害具有相应的适应和抵御能力,表现在其机体内的抗氧化系统[21]。生物的抗氧化系统分为酶促清除系统和非酶促清除系统:酶促清除系统即抗氧化酶类,包括对活性氧直接起作用的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物酶(GSH-Px)等,非酶促清除系统即抗氧化剂类,包括维生素A和维生素E等[20-21]。本试验结果表明:在饲料中添加牛至精油可显著提高甘肃高山细毛羊肉的GSH、GSH-Px和VA含量(P<0.05),提高SOD、CAT和VE的含量(P>0.05)。傅帅等[22]报道牛至、甘草、连翘、金银花和黄芪等药材组成的中草药制剂可显著提高肉仔鸡的总抗氧化能力、超氧化物歧化酶、谷胱甘肽过氧化物酶活性且显著降低血清丙二醛含量(P<0.05),与本试验结果相似。此外,动物体在代谢过程中产生过多的ROS若不能及时被清除,则会引起动物的应激反应和多种生理病变,屠宰后肉质表现出肉色变暗、系水力下降、肌内脂肪降解、风味前体物质降解、肌肉细胞损伤而产生劣质肉[23]。研究发现抗氧化性能强的猪肉肉质鲜红、肉品品质优良、具有良好的加工性能和较长的保质期[23]。WANG等也报道了肌肉中SOD、GPX活性越高,肌肉的系水力越高、肉色越鲜艳且肉质越细嫩[25]。本试验结果表明,饲料中添加牛至精油在显著提高甘肃省高山细毛羊肉GSH、GSH-Px和VA值(P<0.05)的同时,甘肃高山细毛羊的肉色、剪切力和蒸煮损失也得到了显著改善(P<0.05),这与上述报道结果一致。此外,试验组2甘肃省高山细毛羊肉GSH值显著高于试验1组(P<0.05)。综上所述,饲料中添加牛至精油可增强甘肃高山细毛羊肉抗氧化性能且试验组2甘肃高山细毛羊肉抗氧化性能更优。
羊体脂中已被发现的脂肪酸有一百多种,主要有油酸(C18∶1)、硬脂酸(C18∶0)、棕榈酸(C16∶0)和亚油酸(18∶2),此外还有少量的豆蔻酸(C14∶0)、亚麻酸(C18∶3)、花生四烯酸(C20∶4)等[26]。本试验各组甘肃高山细毛羊背最长肌中:棕榈酸(C16∶0)为含量最高的SFA,油酸(C18∶1n9c)为含量最高的MUFA,亚油酸(C18∶2n6c)为含量最高的PUFA,与该报道相似。油酸(C18∶1)于1985年首次被MATTSON等报道是一种良性脂肪酸,人们所熟知的橄榄油因油酸含量高而著称(油酸约55%~80%)[27]。油酸(C18∶1)作为能够降低胆固醇和低密度脂蛋白的一种单键不饱和性脂肪酸,在羊体脂脂肪酸中最为重要,其含量占到总脂肪酸的34.15%~43.75%[27]。本试验中,试验组1(39.52%)和组2(39.20%)油酸含量高于对照组(38.26%)(P>0.05),说明牛至精油可能有提高反刍动物油酸的潜能。棕榈酸是一种饱和性脂肪酸,在羊体脂肪中的含量可达到24%,它和肉豆蔻酸已被证明可提高血清中低密度脂蛋白水平,而低密度脂蛋白是人类心血管疾病的危险因素,因此摄入过量的肉豆蔻酸和棕榈酸可能会引起营养学问题[28]。本试验中,试验组1(23.69%)和试验组2(24.41%)甘肃高山细毛羊背最长肌中棕榈酸含量显著低于对照组(25.85%)(P<0.05),且试验组1(2.39%)和试验组2(2.60%)肉豆蔻酸含量也低于对照组(3.04%)(P>0.05)。说明牛至精油具有改善高山细毛羊脂肪酸含量的潜力。此外,硬脂酸在羊体脂肪酸中较为特殊,它通常被认为是饱和性脂肪酸中可提高人体血液中低密度脂蛋白胆固醇(LDL)含量的SFA,有引起心血管疾病特别是冠状动脉硬化疾病的潜在危险。KEYS等就饱和性脂肪酸与体内胆固醇的含量进行过研究,结果显示饱和性脂肪酸确有提高体内胆固醇水平的作用[29]。但BONAMONE等的研究发现,羊肉的硬脂酸并不会提高血中胆固醇的水平和低密度脂蛋白胆固醇(LDL)的水平,其机理可能是由于该脂肪酸的消化程度很低,容易进行不饱和化作用转变成油酸,而油酸没有提高胆固醇的作用[30]。还有报道指出,硬脂酸是造成羊肉膻味的重要脂肪酸,硬脂酸含量会随着动物年龄的增加而提高[31]。本试验研究结果表明,牛至精油对硬脂酸(C18∶0)含量并无显著影响,但对照组硬脂酸含量(12.49%)高于试验组1(12.23%)和试验组2(11.81%),且与饲料中牛至精油的添加量成反比,这说明牛至精油可能具有降低羊肉膻味的潜能,这有待进一步研究。此外,各组间甘肃高山细毛羊背最长肌中SFA和UFA差异显著(P<0.05),对照组UFA含量显著低于试验组1和试验组2(P<0.05)。这可能归因于牛至精油提高了甘肃高山细毛羊机体抗氧化性能(表2),类红梅等[18]的综述中报道:植物具有的抗氧化物质均有清除自由基的作用,可有效降低肉类氧化水平。如丁香提取物(丁香酚、没食子酸等)可以显著降低猪肉饼的脂质氧化和蛋白氧化(P<0.05),而脂质氧化是影响脂肪酸组成的重要因素。综上所述,饲料中添加牛至精油可改善甘肃高山细毛羊肉中脂肪酸含量。
4 结论
在饲料中添加牛至精油可改善甘肃高山细毛羊肉肉色、蒸煮损失、失水率、嫩度、脂肪酸含量并提高其体内抗氧化性能;本试验环境下,2 g/d牛至精油为甘肃高山细毛羊饲料中最佳添加量。然而,关于饲料中添加牛至精油提高肉质和抗氧化性能的机理以及对羊肉风味的影响还有待进一步研究。

