肉牛源细极链格孢菌的分离鉴定
彭 彦,杨 超,姜尧章,马晓平,申纪饶,胡 静,古 玉,彭广能,钟志军,左之才
(1. 四川农业大学 动物医学院/动物疫病与人类健康四川省重点实验室,四川 成都 611130;2. 四川水利职业技术学院,四川 成都 611231;3. 四川农业大学 生命科学院,四川 成都 611130)
肉牛真菌性皮肤病主要是由皮肤癣菌感染引起的一类接触传染性较强的人畜共患病,可继发引起多种患病动物生长发育迟缓、生产性能以及机体抵抗力下降等,常给养牛业造成一定的经济损失。近年已报道的肉牛皮肤真菌病有由毛孢子菌属导致的肉牛皮肤大面积脱毛[1];感染小芽胞癣菌引起的铜钱癣、痂癣;感染疣状毛癣菌引起的犊牛全身性感染脱毛。肉牛皮肤真菌病在国内外的研究主要集中在临床诊疗上,而对病原真菌的分类、致病性和耐药性研究较少。
细极链格孢菌(Alternaria tenuissima)是属于半知菌纲、链孢霉目、黑霉科、链格孢属的一种广泛存在于自然界的腐生丝状条件致病菌,可引起植物、动物和人患病。
迄今为止,全世界已经发现约500种链格孢属真菌且仍不断有新种发现,虽然其95%寄生于植物但仍存有5%对动物和人致病。有些链格孢菌可以感染人和动物,引起手足等皮肤及皮肤深部真菌病[2];有研究曾多次从儿童皮癣组织中分离到一种类似侵染链格孢的真菌[3]。这些链格孢属真菌可以引起儿童不同程度的脱毛、皮屑增多、瘙痒等症状;甚至可导致免疫力低下的动物患链格孢属深部真菌病。张芝元等从健康犬体表分离出21 株链格孢属真菌,同时发现链格孢属为犬体表的优势种,广泛分布于犬耳背、脸颊、背部及后腿内侧等多个部位[4]。链格孢属真菌在一定条件下可使动物不同程度感染,而国内外目前少有关于动物细极链格孢菌引起的皮肤真菌病及其致病性的研究。基于此本实验采集疑似为皮肤真菌病(自然发病)的肉牛病变部位皮屑、毛发和痂皮分离病原真菌,通过形态学和核糖rDNA内部转录间隔区(Internal transcribed spacer,ITS)序列分析鉴定该菌株为细极链格孢菌,并以此为基础研究该菌对小鼠的致病性和筛选敏感药物,以期为细极链格孢菌引起的皮肤真菌病的诊断和治疗提供参考。
1 材料与方法
1.1 实验动物与主要试剂 27 只20 g~24 g 体况相近的6 周龄~8 周龄的健康SPF 级KM 小鼠(雌雄不限),购自成都达硕实验动物公司。酵母基因组DNA 提取试剂盒(离心柱型)、溶壁酶Lyticase、DL 2000 DNA Marker 和2×Taq PCR Master Mix 购自北京天根生物技术公司;放线菌酮购自美国Amresco 公司;氯霉素购自北京索莱宝科技公司;酮康唑、灰黄霉素购自上海源叶生物科技公司;伊曲康唑、氟康唑购自上海瑞永生物科技公司。
1.2 患病肉牛临床表现及病料样品采集 某养殖场23 头肉牛头颈部局部出现不同程度的脱毛脱屑和皮癣,严重部位呈团块状脱毛,患部瘙痒常与周围物体等摩擦出现红疹。其余精神食欲正常。
用75%酒精消毒肉牛头、颈、背等皮肤脱毛区域,再用无菌刀片在病健结合部刮至微出血,用无菌镊子取其皮屑、毛发、痂皮少许分别放于无菌密封袋中并编号,放入4 ℃的保温箱送实验室分离培养,最后20 g/L 碘酊对取样处消毒。
1.3 真菌分离及纯化培养 参照文献[5]方法对收集病料镜检观察。同时取少量毛发或皮屑用灭菌生理盐水反复冲洗3 次以后,用灭菌滤纸吸干,采用3 点接种法平行接种至含有放线菌酮和氯霉素的沙氏葡萄糖琼脂培养基(SDA)中25 ℃培养7 d,每天观察菌落生长情况,将形态不同的单个菌落分别接种到新的普通SDA 培养基中于25 ℃培养7 d,用铜圈培养法(用融化的石蜡将直径约1.5 cm,高度为3 mm,侧面有一小孔的铜圈粘在载玻片上,盖上盖玻片,将SDA 培养基灭菌后用注射器注入铜圈使其形成很小的斜面,用接种针将分离真菌通过小孔接种斜面上)培养以观察菌丝和孢子形态,经棉兰染色后经显微镜观察并拍照记录。
1.4 分离菌株的分子生物学鉴定 取分离株在SDA培养基中纯化后提取病原基因组。采用ITS 区通用引物ITS1:5'-TCCGTAGGTGAACCTGCGG-3'/ITS4 5'-TC CTCCGCTTATTGATATGC-3'PCR 扩 增ITS 基 因,引 物由成都擎科梓熙生物技术公司合成。PCR 产物由成都擎科梓熙生物技术公司测序,测序结果利用NCBI中BLAST 进行序列比对分析,利用MEGA-X 建立该基因的系统进化树。
1.5 小鼠致病性试验 利用无菌生理盐水冲洗并刮取纯化菌落表面的菌丝和孢子,将冲洗下来的生理盐水和孢子混合液静置5 min~10 min,取上清液涡旋15 s制成孢子悬液。将孢子悬液用生理盐水调至0.5 麦氏浊度单位[6],悬液浓度为1×106cfu/mL。随机选取9 只/组小鼠进行试验分组:A组免疫抑制组:分别注射环磷酰胺(50 mg/kg)、青霉素钠(15 mg/只),B组非免疫抑制组:注射青霉素钠(15 mg/只),C 组阴性对照:注射0.1 mL 生理盐水)。每组分3 种接种途径(皮肤涂擦为A1、B1 和C1 组;皮下注射A2、B2 和C2 组;腹腔接种A3、B3和C3组)进行接种,每组各3只。
每日观察小鼠接种处皮肤是否出现皮屑、红斑、结痂,毛发生长变化并记录。感染后第10 d 乙醚麻醉后颈椎脱臼迫杀并解剖小鼠,观察主要脏器病变并取接种处皮肤和脾脏用福尔马林固定后由武汉赛维尔生物科技有限公司制作切片,HE 染色后经显微镜观察病理组织切片并拍照。
1.6 药敏试验 选用灰黄霉素、氟康唑、伊曲康唑、酮康唑,按照参考文献[1]方法进行分离菌株的药敏试验,并计算分离菌对各药物的最低抑菌浓度(MIC)。根据M38-A 标准判读结果,对于酮康唑、氟康唑和灰黄霉素,其MIC 值定义为与对照组相比出现50% 生长抑制时的最低药物浓度;对于伊曲康唑MIC 值则定义为与对照组相比出现完全不生长时的最低药物浓度。试验重复2 次。
2 结果与讨论
2.1 真菌分离及形态学鉴定结果 将采集的样品分别接种于含有放线菌酮和氯霉素的SDA 培养基出现表面密绒状,具同心轮纹的菌落;初为乳白色,随生长时间颜色逐渐变深从淡黄色、棕黄色至黑褐色,中心色比边缘色更深,边缘仍呈乳白色(图1A),背面也呈乳白色至棕黄色至黑褐色过渡的菌落。将形态不同的单个菌落分别接种到新的普通SDA 培养基中于25 ℃培养7 d,用铜圈培养法观察菌丝和孢子形态,将其经棉兰染色后于显微镜下观察到菌丝和孢子。结果可见有隔菌丝直立而偶分支;孢子呈倒棒形,0~2个纵或斜隔膜,喙及假喙柱状(图1B)。其在25 ℃SDA 培养基上生长良好。以上特征与链格孢属真菌孢子相似。结合临床症状,初步诊断该批肉牛患真菌性皮肤病,但真菌种类太多,从显微镜下仅观察到真菌孢子,不能作为最终鉴定或诊断的依据。从多份病灶样品中分离到菌落和孢子形态相似的数株真菌,经形态学特征和ITS 结果综合分析,最终确认为均是同1株真菌,将其命名为PY2-1-2。本实验中在培养基中加入放线菌酮主要是抑制腐生真菌和环境中的杂菌,人医通常认为加放线菌酮仍能生长的真菌几乎均具有致病性。其菌落及孢子形态与标准链格孢属真菌相似,疑似病牛皮肤病为链格孢属真菌感染。
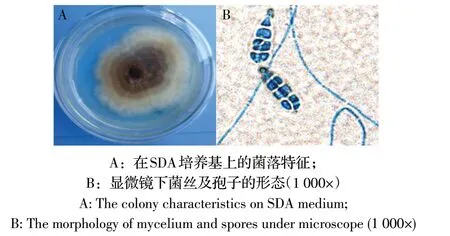
图1 分离菌的形态特征Fig.1 Morphological characteristics of the isolate
2.2 分子生物学鉴定结果 经PCR 扩增分离菌株的ITS 基因获得543 bp 目的基因片段。提交序列至GenBank 获得序列号为MH656780.1。利用BLAST 与GenBank 数据库对该基因序列进行比对,该菌株与细极链格孢菌(MG975630.1)的相似性为99%。采用最大简约法经过1 000 次自展分析得到系统发育树,显示两者以95%支持率聚在同一分支(图2)。表明该菌为细极链格孢菌。
真菌核糖体RNA 基因(rDNA)有广泛的保守区和可变区,可选用一个或几个合适保守区基因片段进行测序分析和菌种鉴定,而ITS 基因序列在不同种属真菌间可变性很大,可鉴定其属、种水平[7],因而ITS 基因序列分析是真菌分子生物学鉴定的可靠方法,广泛应用于致病菌的鉴定和分型[8],且相似性超过98%的菌株可认定为同一菌种。本研究在初步诊断病因后,鉴于ITS 基因序列分析在链格孢属真菌的分类鉴定及系统进化研究中被证明是一种快速有效的方法[9],所以采用真菌通用引物ITS1、ITS4 进行PCR 扩增、序列测定,测序结果利用BLAST 比对分析,结果与表型鉴定结果相吻合。构建分离菌株的ITS 基因系统发育树后显示分离株PY2-1-2 与A. tenuissima 聚为同一支,置信度检测结果为99%,因此结合形态学和BLAT 比对结果将PY2-1-2 菌株鉴定为A.tenuissima,确诊病牛皮肤病为细极链格孢菌感染的真菌病。
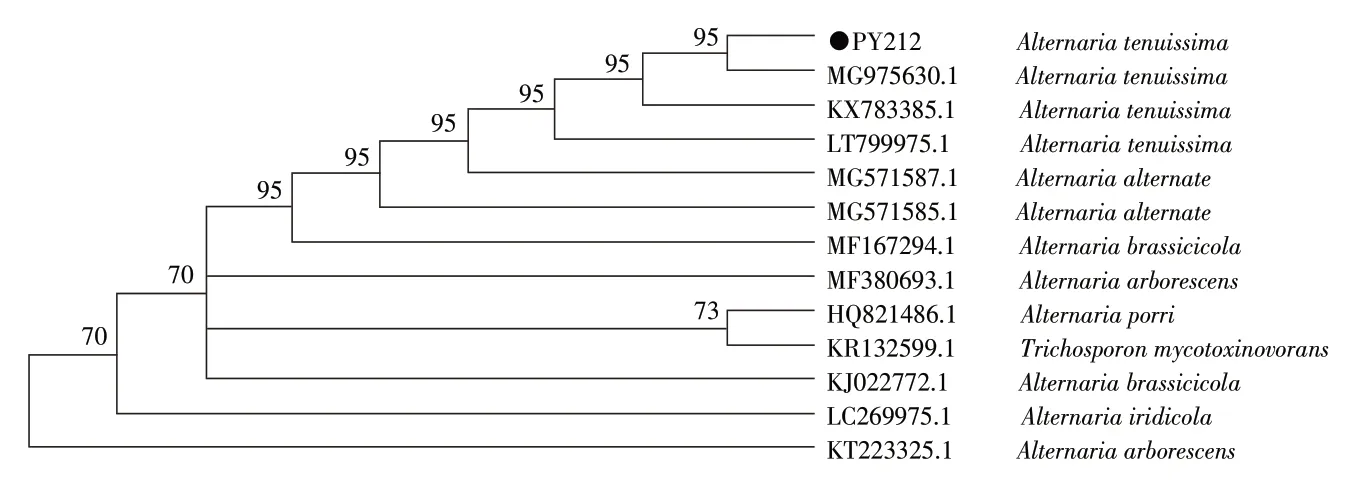
图2 分离菌株的ITS 基因系统发育树Fig.2 Phylogenetic tree based on ITS gene sequence of the isolate
2.3 小鼠致病性试验 将菌悬液通过皮肤涂擦、皮下注射和腹腔注射方式接种小鼠,同时设免疫抑制组和非免疫抑制组和阴性对照组,也经同样的方式接种小鼠。结果显示,免疫抑制皮下接种组的小鼠出现炎性肉芽肿,接种处出现皮屑与脱毛症状,与相关报道[10]症状一致;免疫抑制皮肤涂擦组相较于非免疫抑制涂擦组的皮肤痊愈速度较慢,可能是因免疫抑制使小鼠对该菌的感染程度更严重,使得机体需一定时间抵御异物感染;腹腔注射组小鼠无论是免疫抑制组还是非免疫抑制组均未出现临床症状,仅免疫抑制腹腔注射组中1 只小鼠腹腔腹膜出现橙色小颗粒,可能是个体差异导致。阴性对照组无明显症状。致病性试验结果表明,细极链格孢菌可导致小鼠出现脱毛和皮屑等皮肤病症状,与肉牛的临床表现类似。
剖检后,可见免疫抑制皮下组小鼠和非免疫抑制皮下组小鼠皮下均有结节脓肿,触摸质地较硬。免疫抑制皮下和腹腔注射组小鼠脾脏均出现不同程度肿大。阴性对照组无明显剖检变化。免疫抑制皮下组皮肤组织病理变化主要为感染性肉芽肿,病变处有细胞坏死和炎性细胞浸润,皮肤表皮层明显增厚;脾脏红细胞浸润(图3)。表明,该菌对小鼠有感染性并且产生相应的皮肤感染症状。有研究显示仅有5%的链格孢属菌感染人和动物,但大多数为其属中的链格孢霉[11]和侵染链格孢[3],少有报道细极链格孢菌感染动物可以引起其患皮肤病。链格孢属真菌大量繁殖菌丝导致机体发病,引起的病理变化普遍为脓肿和慢性炎症肉芽肿。
2.4 分离菌的药敏试验结果 药敏试验结果显示:该菌对灰黄霉素、氟康唑、伊曲康唑、酮康唑的MIC值分别为0.5 μg/mL、4 μg/mL、1 μg/mL、1 μg/mL,该菌对酮康唑、氟康唑、伊曲康唑和灰黄霉素均敏感,其中灰黄霉素抑菌效果最好。
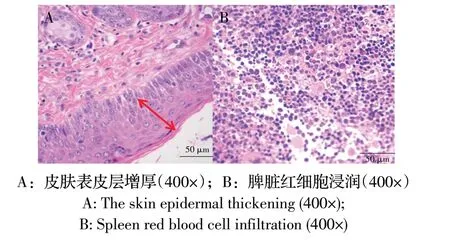
图3 小鼠皮肤及脾脏病理组织变化Fig.3 The mouse skin and spleen of pathological changes
目前,因美国临床和实验室标准化研究所(CLSI)针对丝状真菌的微量液基稀释法(M38-A2 方案)具有良好的准确性和重复性而获得广泛认可和应用。赵禹皓实验表明链格孢属各菌株对两性霉素B、酮康唑、伊曲康唑和制霉菌素均敏感[11];也有研究称链格孢属菌对5-氟胞嘧啶敏感度最高,且大多数常见真菌均对其敏感[1]。临床上对细极链格孢菌的药物敏感性研究十分有限,不同种的链格孢属菌对药物的敏感性存在一定差异,且相同种属的不同菌株的药物敏感性也存在一定差异,因此有必要对不同菌株的体外药物敏感性进行试验后再参考用药,对临床选择合适抗真菌药物治疗真菌感染有重要意义。
本研究将丰富肉牛真菌性皮肤病的病原学,为诊断和治疗本病提供参考。

