食源性致病菌核酸检测技术研究进展
钟宜科,邹大阳,赵彤,花晓丹,冯洋,刘威,*,王永霞,*
(1.河北工程大学生命科学与食品工程学院,河北邯郸056000;2.中国人民解放军疾病预防控制中心,北京100000)
在过去的30年食源性疾病的发病率明显增加,食源性疾病已经成为全球主要的公共问题之一[1]。世界卫生组织(World Health Organization,WHO)[2]统计显示由病原微生物引起的食源性疾病比例达50%以上。食源性疾病是因为食用致病菌或其毒素污染的食物或水引起。食源性致病菌包括细菌、病毒、真菌和寄生虫[3]。据报道[4]已被确认的食源性致病菌多达31种。引起食源性疾病常见致病菌为大肠杆菌O157、金黄色葡萄球菌、肠道沙门氏菌、空肠弯曲菌、单核细胞增生李斯特菌、蜡样芽胞杆菌、产气荚膜梭状芽胞杆菌和产志贺毒素大肠杆菌等[1,4]。各种街边食品[5]、水果,蔬菜等即食食品、生的或未煮熟的食物海鲜、肉类[6],这些都会引起食源性疾病的发生。为确保食品供应安全,减少食源性疾病的发生,对食品中是否存在食源性致病菌进行分析至关重要。
食源性致病菌的检测方法包括传统培养法和免疫学方法。其中,传统培养法[7]是金标准,但操作繁琐,对操作人员技术水平要求比较高且检测周期长,需要2 d~20 d不等,而且属内种间生化差别不明显;免疫学[8]方法是基于抗原抗体特异性结合的反应原理,操作简单、方便快速是其突出特点,但其最大的缺点是灵敏性不足,经常造成假阴性结果,容易漏筛,不能完全满足致病菌的检测需求。
多年来,为了克服传统检测方法的局限性,一种简便、高特异性、高灵敏的核酸检测方法应运而生,其通过检测目标病原体的特定DNA或RNA序列,将目标核酸序列杂交到与目标序列互补的合成寡核苷酸(探针或引物)来完成病原体的检测。另外,一些产毒素的病原体,如霍乱弧菌、大肠杆菌O157、副溶血弧菌、金黄色葡萄球菌等也可通过核酸检测技术检测到其中的毒力因子[3]。
1 核酸检测技术
1.1 常规PCR
常规聚合酶链式反应(polymerase chain reaction,PCR)技术是食源性致病菌检测常用的分子生物学方法。常规PCR可以通过检测特定目标DNA序列来检测食品中存在的单一细菌病原体。其原理为:首先经过热变性双链DNA解链成为单链DNA;然后退火,引物与模板的互补区相结合;最后经过延伸,合成DNA,获得目的片段。最后将扩增产物进行琼脂糖凝胶电泳进行扩增产物的检测。Chiang等[9]和Zhou等[10]建立了食品中大肠杆菌O157、单核细胞增生李斯特菌、副溶血弧菌、沙门氏菌和志贺氏菌常规PCR检测方法。这种检测方特异性强、灵敏度高、仪器便宜,但易受到抑制剂的影响;并且要通过琼脂糖凝胶电泳对扩增产物进行结果判读,耗时长,对检测人员技术要求高。
1.2 多重PCR
多重PCR(multiplex-PCR,mPCR)是由常规PCR衍生出的一种扩增技术。在一个反应体系中加入两对以上的引物,可同时扩增出多个目的片段,较常规PCR更加快速方便。引物设计是多重PCR最关键的步骤,只有反应中引物具有相似的退火温度时,才能成功的进行多重PCR分析[3]。此外,反应体系中的引物浓度、缓冲液、mg2+和dNTP浓度、DNA模板浓度、反应温度和Taq酶都会影响检测结果[11]。Park等[12]建立了同时检测食品中大肠杆菌O157:H7(Stx2A)、沙门氏菌(Its)、金黄色葡萄球菌(Cap8A-B)和单核细胞增生李斯特菌(Hly)的多重PCR方法;Ryu等[13]建立了一种同时检测和鉴别6种李斯特菌的多重PCR方法,且具有较高的特异性;Zhou等[14]建立一种新的多重PCR方法,即GeXP-PCR,可检测食品中大肠杆菌O157、单核细胞增生李斯特菌等6种病原菌。其中,GeXP[15](genome lab gene expression profiler)多重基因表达遗传分析系统与毛细管电泳分析技术相结合,利用带有荧光标记的通用引物和特异性嵌合引物的联合扩增,使目的基因得到高效表达,该技术具有特异性强、灵敏度高、高通量及检测速度快等优点。
1.3 实时荧光定量PCR
实时荧光定量PCR(quantitative real-time PCR,qPCR)与常规PCR相比,其不需要对样品进行扩增后处理,而是通过荧光染料或荧光标记特异性的探针,对PCR产物进行标记跟踪,实时在线监控[16]。由于其快速、特异性强和灵敏度高等特点,越来越多的应用到食源性致病菌的检测中。qPCR还可以通过研究合适的靶基因的表达来量化食物中的一种特定微生物。目前应用较多的qPCR方法有染料法(synergy brands green,SYBR Green)、探针(TaqMan probes)和分子信标(molecular beacons)。
SYBR Green是一种只与双链DNA结合的染料,当反应液钟只有单链DNA时,其不发光,只有掺入DNA双链中才可发光。其工作原理见图1。
在扩增反应过程中,引物退火并形成PCR产物,扩增完成后,SYBR Green染料与双链DNA结合,定量PCR系统检测到荧光值升高。Tyagi等[18]建立了一种用于检测热带贝类中致病性tdh阳性副溶血性弧菌的高灵敏性SYBR Green qPCR检测方法;Jun Kawase等[19]建立了一种可同时检测16种食源性致病菌的SYBR Green qPCR方法。TaqMan探针法的工作原理见图2。
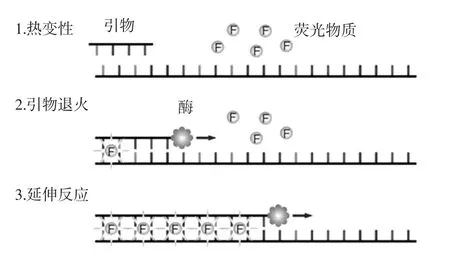
图1 SYBR Green荧光定量PCR原理[17]Fig.1 Principle of SYBR green quantitative PCR
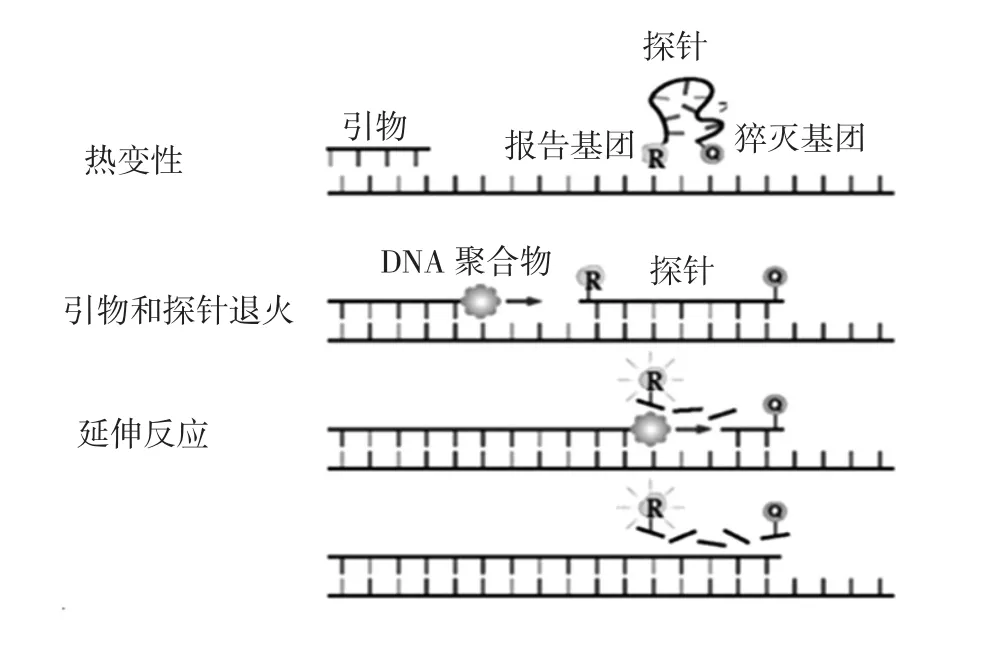
图2 TaqMan探针荧光定量PCR原理[17]Fig.2 Principle of TaqMan probe fluorescence quantitative PCR
探针 3′端淬灭基(quencher,Q)能够吸收 5′端报告基团(reporter,R)发出的荧光,因此,没有扩增反应时,无法检测到荧光信号,当溶液中有PCR产物(模板)时,探针与模板退火,即产生了适合于核酸外切酶活性的底物,从而激活Taq酶的5′外切酶活性,将探针5′端连接的报告基团切割下来,破坏了两个荧光分子间的荧光共振能量转移,从而发出荧光,检测到扩增信号。Fusco等[20]通过TaqMan qPCR定性、定量分析了牛奶中的产肠毒素金黄色葡萄球菌。
分子信标(molecular beacon)[21]是一种荧光标记的寡核苷酸链。由3部分组成:(1)环状区:由15~30个可与靶分子特异性结合的核苷酸组成;(2)茎干区:由5个~8个可发生可逆性解离的碱基对组成;(3)荧光基团和淬灭基团:分子信标的两个末端分别标记荧光基团和淬灭基团。其工作原理见图3。
没有靶分子存在的时候,分子信标的荧光基团和淬灭基团靠得很近,荧光被淬灭,但与靶分子结合后,分子信标的空间构型发生了改变,使荧光恢复。Liming等[22]首次通过分子信标qPCR技术检测了水果和蔬菜中的沙门氏菌。

图3 分子信标荧光定量PCR原理[17]Fig.3 Principle of molecular beacon fluorescence quantitative PCR
上述3种方法中,SYBR Green法较TaqMan探针法和分子信标法更加便宜和简单,并且其扩增结果可通过溶解曲线的Tm值进行直观的判断。但SYBR Green法检测的是体系中的所有双链DNA,因此,反应中产生的非特异性扩增或引物二聚体,容易造成假阳性,而TaqMan探针法和分子信标法是序列特异性探针,只能与靶序列结合,不会产生引物二聚体,较SYBR Green法更加的灵敏,但Klerks等[23]研究表明基于PCR的检测方法的灵敏性主要受引物特异性,引物序列和退火温度的影响。
1.4 环介导等温扩增技术
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是 Notomi等[24]在 2000 年建立的一种核酸扩增技术。该方法需要4条~6条引物特异性的识别目标片段的6个~8个区域,具有简单、特异、高效、迅速的优点。在DNA聚合酶的链置换作用下,可在短时间内扩增靶序列,同时产生白色的焦磷酸镁,这一特性可通过浊度来判断。Maruyama等[25]首次通过这种方法进行了食源性致病菌大肠杆菌O157:H7(stxa2)的检测;Wang等[26]研究表明,由于LAMP引物需特异性的结合目标片段的6~8个区域,使得LAMP比PCR具有更高的灵敏性和特异性。目前,由LAMP衍生的检测方法有反转录LAMP[27]、多重LAMP[28]、实时反转录LAMP[29]等。
1.5 聚合酶螺旋反应
聚合酶螺旋反应(polymerase spiral reaction,PSR)是由Liuwei等[30]建立的一种新型的恒温扩增技术。该方法是利用具有热稳定性、链置换功能和DNA聚合酶活性的酶(Bst DNA聚合酶)在等温条下进行扩增的方法。该法从LAMP引物设计中得到启示,并融合PCR法引物设计简便的优点,仅在PCR引物的基础上从目标序列上再取一段序列加到PCR引物的5′端,构成正反向复合引物,满足了简便快速、高灵敏度和特异性的要求。朱渊等[31]建立了铜绿假单胞菌PSR检测方法;董德荣[32]通过PSR建立了一种具有高特异、高灵敏性,用于现场检测食品中霍乱弧菌的方法。
1.6 重组酶聚合酶扩增技术
重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA),是由Olaf Piepenburg等研发的一种等温核酸扩增技术。它依赖于特定的酶和蛋白组合(重组酶、单链结合蛋白和DNA聚合酶),在常温条件下反应5 min~20 min即可获得结果。目前,由RPA衍生出的检测方法有直接重组酶聚合酶扩增技术(Direct-RPA)[33]、重组酶聚合酶扩增侧流层析技术(RPALFD)[34]、实时重组酶聚合酶扩增技术(Rea-ime RPA)[35]等。Ji等[36]建立了肠炎沙门氏菌实时荧光RPA快速检测方法,用于检测鸡蛋和鸡肉中的肠炎沙门氏菌。研究发现,该方法和实时荧光PCR相比,具有检测时间更短,灵敏度更高的优点。郭燕华等[37]以Cytb基因为靶序列,建立了一种用于检测生鲜肉中猪源成分的RPA技术,该方法能快速鉴别猪肉中的猪源成分,特异性好,灵敏度高。Heeseop等[38]建立了一种基于纸芯片的一步法RPA,于37℃反应20 min即可获得结果。
快速检测食品中的食源性致病菌,防止食源性疾病的爆发和食源性致病菌的传播具有重要意义。目前,已经建立许多食源性致病菌快速检测方法,见表1。
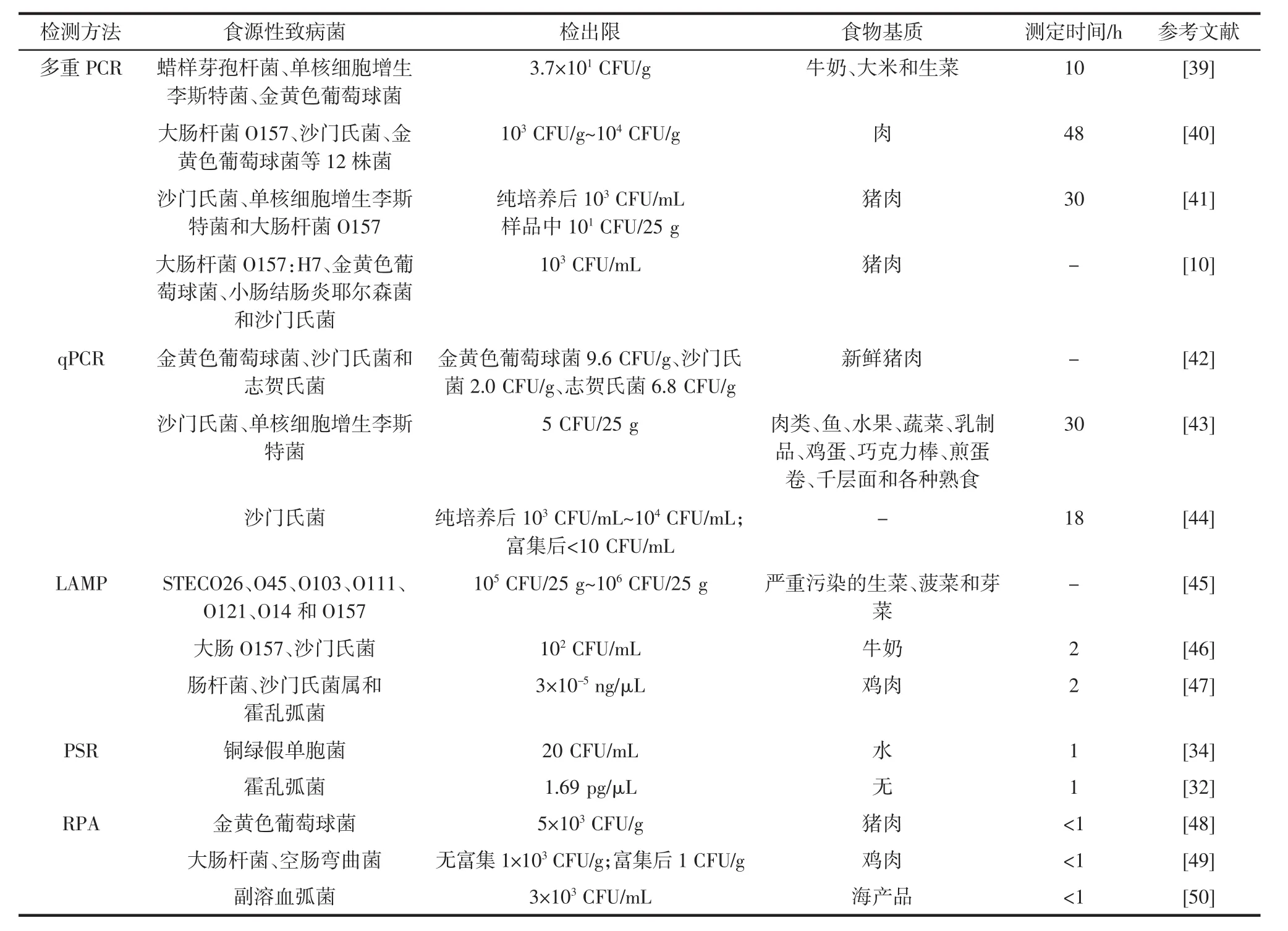
表1 核酸检测技术在食源性致病菌检测中的应用Table 1 Examples of the application of nucleic acid-based methods for the detection of various foodborne pathogens present in food samples
但是大多数的方法需要一些技术人员、昂贵的仪器,只能在实验室进行,无法满足现场快速检测,限制了其使用范围。基于核酸检测的方法都有其各自优点和局限性见表2。
但是怎么将这些优点集于一体,是我们未来研究的重点。本文综述了10年来基于部分核酸快速检测方法及其在食源性细菌性致病菌检测中的应用及其优点和局限性。

表2 快速检测方法的优点和局限性Table 2 The summary of advantages and limitations of each rapid detection methods
2 结论
以传统培养法为基础的食源性致病菌检测方法具有选择性,但费时费力,在实际使用中,需要数天到一周的时间,因此急需建立快速的检测方法,以此来克服传统检测方法的局限性。快速检测食品中的食源性致病菌,防止食源性疾病的爆发和食源性致病菌的传播具有重要意义。新兴的等温扩增技术如LAMP、RPA和PSR因其操作简单、不需要热循环以及不需要大型仪器等,未来其在食源性致病菌现场检测具有广泛的前景。
几十年来,研究人员在食源性致病菌检测方面进行了大量研究,但目前的技术仍需要改进。所有的快速检测方法都需要一定的前处理,这是快速检测中一个非常重要的环节,也是快速检测发展中的一个瓶颈。食品基质、致病菌的数量(<100 CFU/g)都会影响检测结果的正确性。综合各种方法的优点,创造新的检测方法,以此加快食源性致病菌检测技术进程。

