铜催化N′-芳基苯磺酰肼的N′-芳基化反应
叶秋香, 任淼锋, 胡 馨, 刘晋彪*
(1. 江西理工大学 化学系,江西 赣州 341000; 2. 赣南医学院 药学院,江西 赣州 341000)
多取代肼是一类常见且重要的有机片段,广泛存在于天然产物、药物分子和材料分子中[1-7]。肼含有两个氮原子,如何实现其两个氮原子的选择性官能团化,是构建种类多样的肼化合物的关键。其中,磺酰肼类化合物的多取代衍生,如N′-位的二芳基取代,通常可由N′-芳基苯磺酰肼与其他金属芳基化试剂,发生C·N偶联制得[8-10]。由于金属偶联试剂制备相对较难,反应条件苛刻,拓展新的二芳基取代磺酰肼合成方法是重要的研究方向。
近年来,本课题组开发了一类新型芳基化试剂——N′-芳基苯磺酰肼,可参与多种过渡金属催偶联反应[11-13]:N′-芳基苯磺酰肼可分别与芳基硼酸发生Suzuki偶联反应[11-12],也可与烯烃发生Heck偶联反应[13];N′-芳基苯磺酰肼可在碱性条件下与2-萘酚反应,在2-萘酚的1-位引入芳香偶氮基,制得苏丹红类产物[14]。鉴于N′-芳基苯磺酰肼可作为一类高效的芳基化偶联试剂,我们设想利用N′-芳基苯磺酰肼产生芳基片段,继而被尚未分解的原料N′-芳基苯磺酰肼中的氮原子(N′)捕获,实现N′,N′-二芳基取代苯磺酰肼的高效合成(Scheme 1)。
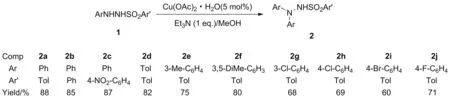
Scheme 1
1 实验部分
1. 1 仪器与试剂
Bruker-400 MHz型超导核磁共振仪(TMS为内标);Agilent 6410型三重串联四极杆质谱仪。
所用试剂均为分析纯或化学纯。
1. 2 化合物2的合成通法
依次将N′-芳基苯磺酰肼1(0.3 mmol)、 Cu(OAc)2·H2O 3.0 mg(0.015 mmol)和三乙胺30.4 mg(0.3 mmol)加入盛有2 mL甲醇的圆底烧瓶中,常温下搅拌4~8 h。用薄层色谱法(TLC)监测反应。向反应体系中加入10 mL 水,再用二氯甲烷(3×10 mL)萃取,合并有机相,向有机相中加入无水硫酸钠干燥,减压蒸馏除去溶剂,最后经硅胶柱层析纯化得纯品2。
4-甲基-N′,N′-二苯基苯磺酰肼(2a)[10]: 白色固体44.7 mg, m.p.140~141 ℃,产率88%;1H NMR(400 MHz, CDCl3)δ: 7.63(d,J=7.2 Hz, 2H), 7.15(t,J=7.2 Hz, 4H), 7.08(d,J=7.6 Hz, 2H), 6.98(dd,J=15.2 Hz, 7.7 Hz, 6H), 2.33(s, 3H);13C NMR(100 MHz, CDCl3)δ: 146.88, 143.95, 135.59, 129.32, 128.99, 128.27, 123.85, 120.75, 21.49。
N′,N′-二苯基苯磺酰肼(2b)[9]: 白色固体41.4 mg, m.p.155~156 ℃,产率85%;1H NMR(400 MHz, CDCl3)δ: 7.75(dd,J=8.4 Hz, 1.2 Hz, 2H), 7.44(dd,J=10.8 Hz, 4.4 Hz, 1H), 7.30(t,J=7.8 Hz, 2H), 7.16(dd,J=10.8 Hz, 5.2 Hz, 4H), 7.07(s, 1H), 6.98(dd,J=10.6 Hz, 4.2 Hz, 5H);13C NMR(100 MHz, CDCl3)δ: 146.78, 138.65, 133.00, 129.04, 128.73, 128.20, 123.98, 120.73; HR-MS(ESI)m/z: Calcd for C18H16N2O2S{[M-H]-}323.0860, found 323.0834。
4-硝基-N′,N′-二苯基苯磺酰肼(2c)[9]: 黄色固体48.2 mg, m.p.155~156 ℃,产率87%;1H NMR(400 MHz, DMSO-d6)δ: 10.98(s, 1H), 8.15(d,J=8.0 Hz, 2H), 7.84(d,J=8.0 Hz, 2H), 7.17(t,J=7.4 Hz, 4H), 6.95(d,J=7.8 Hz, 6H);13C NMR(100 MHz, DMSO-d6)δ: 149.37, 146.03, 145.05, 128.96, 128.84, 123.99, 123.35, 120.28, 40.10, 39.89, 39.69, 39.48, 39.27, 39.06, 38.85; HR-MS(ESI)m/z: Calcd for C18H15N3O4S {[M-H]-}368.0711, found 368.0700。
4-甲基-N′,N′-二对甲苯基苯磺酰肼(2d): 黄色固体45.1 mg, m.p.159~160 ℃,产率82%;1H NMR(400 MHz, CDCl3)δ: 7.65(d,J=7.6 Hz, 2H), 7.11(s, 2H), 6.94(s, 4H), 6.78(d,J=14.0 Hz, 5H), 2.36(s, 3H), 2.25(s, 6H);13C NMR(100 MHz, CDCl3)δ: 145.02, 143.85, 135.71, 133.38, 129.50, 129.28, 128.33, 120.73, 21.48, 20.64; HR-MS(ESI)m/z: Calcd for C21H22N2O2S{[M-H]-}365.1329, found 365.1201。
4-甲基-N′,N′-二间甲苯基苯磺酰肼(2e): 白色固体41.2 mg, m.p.107~108 ℃,产率75%;1H NMR(400 MHz, CDCl3)δ: 7.63(d,J=8.0 Hz, 2H), 7.11(d,J=8.0 Hz, 2H), 7.04(t,J=7.8 Hz, 2H), 6.93(s, 1H), 6.79(d,J=7.4 Hz, 2H), 6.74(d,J=8.0 Hz, 2H), 6.69(s, 2H), 2.35(s, 3H), 2.18(s, 6H);13C NMR(100 MHz, CDCl3)δ: 147.01, 143.82, 138.84, 135.75, 129.23, 128.79, 128.35, 124.62, 121.51, 117.90, 21.45, 21.31; HR-MS(ESI)m/z: Calcd for C21H22N2O2S{[M-H]-}365.1329, found 365.1337。
4-甲基-N′,N′-二(3,5-二甲苯基)苯磺酰肼(2f): 白色固体47.3 mg, m.p.147~148 ℃,产率80%;1H NMR(400 MHz, CDCl3)δ: 7.65(d,J=7.8 Hz, 2H), 7.14(d,J=7.6 Hz, 2H), 6.67(s, 1H), 6.63(s, 1H), 6.49(s, 4H), 2.37(s, 3H), 2.15(s, 12H);13C NMR(100 MHz, CDCl3)δ: 147.38, 143.86, 138.78, 135.90, 129.33, 128.61, 125.76, 118.83, 29.85, 21.46; HR-MS(ESI)m/z: Calcd for C23H26N2O2S {[M-H]-}393.1642, found 393.1663。
4-甲基-N′,N′-二间氯苯基苯磺酰肼(2g): 白色固体41.5 mg, m.p.163~164 ℃,产率68%;1H NMR(400 MHz, CDCl3)δ: 7.61(d,J=8.0 Hz, 2H), 7.17~7.05(m, 5H), 6.97(d,J=0.8 Hz, 1H), 6.90(dd,J=8.0 Hz, 2.0 Hz, 2H), 6.85(s, 2H), 2.37(s, 3H);13C NMR(100 MHz, CDCl3)δ: 147.17, 144.67, 135.16, 134.82, 130.17, 129.57, 128.17, 124.32, 121.01, 118.87, 21.52; HR-MS(ESI)m/z: Calcd for C19H16N2O2SCl2{[M-H]-}365.1329, found 365.1337;
4-甲基-N′,N′-二对氯苯基苯磺酰肼(2h): 白色固体42.1 mg, m.p.159~160 ℃,产率69%;1H NMR(400 MHz, CDCl3)δ: 7.59(d,J=8.4 Hz, 2H), 7.14~7.09(m, 6H), 6.90~6.87(m, 4H), 2.38(s, 3H);13C NMR(100 MHz, CDCl3)δ: 144.92, 144.51, 135.38, 129.50, 129.39, 129.12, 128.16, 121.99, 21.51; HR-MS(ESI)m/z: Calcd for C19H16N2O2SCl2{[M-H]-}405.0237, found 405.0251。
4-甲基-N′,N′-二对溴苯基苯磺酰肼(2i): 黄色固体44.7 mg, m.p.169~170 ℃,产率60%;1H NMR(400 MHz, CDCl3)δ: 7.57(d,J=8.2 Hz, 2H), 7.26~7.24(m, 4H), 7.12(d,J=8.2 Hz, 2H), 6.84(d,J=8.6 Hz, 4H), 2.39(s, 3H);13C NMR(100 MHz, CDCl3)δ: 145.23, 144.54, 135.39, 132.06, 129.51, 128.13, 122.34, 116.97, 21.54; HR-MS(ESI)m/z: Calcd for C19H16N2O2SBr2{[M-H]-}494.3983, found 494.3953。
4-甲基-N′,N′-二对氟苯基苯磺酰肼(2j): 白色固体39.9 mg, m.p.152~153 ℃,产率71%;1H NMR(400 MHz, CDCl3)δ: 7.64(d,J=8.0 Hz, 2H), 7.15(d,J=8.0 Hz, 2H), 6.87(t,J=6.4 Hz, 8H), 2.37(s, 3H);13C NMR(100 MHz, CDCl3)δ: 160.52, 158.26, 144.29, 143.36, 129.44, 128.26, 122.44, 115.65, 21.49; HR-MS(ESI)m/z: Calcd for C19H16N2O2SF2{[M-H]-}373.0728, found 373.0836。
N′-芳基苯磺酰肼在碱性条件下可产生芳基,研究发现,应用醋酸铜可高效地催化N′-芳基苯磺酰肼的N′-芳基化。经过条件筛选,发现在5 mol%的醋酸铜催化下,三乙胺作为碱,N′-苯基对甲基苯磺酰肼在室温下即可自身反应,生成4-甲基-N′,N′-二苯基苯磺酰肼2a,产率可达88%。
在上述条件下,我们研究了一系列N′-芳基苯磺酰肼的反应(Scheme 1)。N-位取代位,除了对甲基苯磺酰肼能参与反应,苯磺酰肼也能顺利发生反应,得到产物2b,产率85%;并且强吸电子的硝基也可以兼容,得到预期产物2c,产率高达87%。然后,我们对N′-芳基进行了考察,发现甲基取代在对位和间位,以及3,5-二甲基取代苯基,均能高产率地得到目标产物(2d~2f)。除了给电子取代基,当吸电子的卤素原子取代时,反应同样可以发生。氯、溴,以及氟取代产物(2g~2k)的产率均超过60%。卤素原子的引入,有助于产物进行后续交叉偶联衍生化反应。对于1a参与的模板反应,在氮气氛围下产物2a的收率仅为23%。鉴于此,我们认为空气中的氧气在反应中起到重要作用。

Scheme 2
根据上述反应结果,结合已有的文献[9-17],提出该反应可能经历的途径,如Scheme 2所示。在碱性条件下,原料1与醋酸铜发生阴离子交换,生成铜中间体A。与此同时,1在碱和空气中的氧气作用下,生成重氮中间体B,继而均裂并脱去一分子氮气得到芳基自由基。芳基自由基与铜中间体A反应得到目标产物2和一价铜,一价铜被氧气氧化生成二价铜,从而实现铜催化剂循环。
在室温下,以N′-芳基苯磺酰肼为原料,甲醇为溶剂,三乙胺为碱,在醋酸铜催化下高效合成了一系列N′,N′-二芳基苯磺酰肼。该方法操作简便,产率较高,为简单、高效地合成多取代磺酰肼衍生物提供了新的方法选择。

