新疆地区一株羊驼源链球菌的分离鉴定与耐药性分析
井郁金 金映红 参都哈西·加吾丁 王杰 赵洁雅 马文戈 黄炯 夏俊


摘 要:为了解新疆北部某羊驼养殖场病死羊駝的病因,从死亡羊驼的肝脏及其心脏血液样品中分离培养病原菌。本试验采用细菌分离、革兰氏染色、生化反应鉴定和PCR试验鉴定,进行动物致病性试验和抗菌药的敏感性试验。结果表明,革兰氏染色呈阳性,球菌,生化指标和PCR结果均与链球菌相符。序列结果表明,分离株为链球菌,与一株新型的链球菌(序列号为NR_159140.1)同源性最高;动物致病性试验中白兔接种100 μL·只-1,均在72 h内死亡,病死率为100%。药敏试验表明,分离株对环丙沙星、左氧氟沙星、庆大霉素、头孢曲松钠、阿奇霉素、氟苯尼考、头孢曲松钠、替米考星均敏感,而对克林霉素和氨苄西林有一定的耐受性。本试验从羊驼上分离得到的病原菌为新型的链球菌属成员,这为新疆地区羊驼链球菌的分子流行病学以及防治链球菌病提供参考。
关键词:羊驼;链球菌;分离鉴定;药敏试验
中图分类号:S858.299 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.03.010
Identification and Drug Resistance Analysis of Streptococcus Isolated from Alpaca in Xinjiang
JING Yujin1, JIN Yinghong2, JIAWUDING·Canduhaxi2, WANG Jie2, ZHAO Jieya1, MA Wenge2, HUANG Jiong2, XIA Jun2
(1.College of Animal Medicine, Xinjiang Agricultural University, Urumqi, Xinjiang 830009, China; 2.Veterinary Research Institute of Xinjiang Academy of Animal Science(Animal Medical Research Center of Xinjiang Academy of Animal Science),Urumqi, Xinjiang 830011,China)
Abstract: In order to understand the cause of dead alpacas in an alpaca farm in northern Xinjiang, pathogenic bacteria were isolated and cultured from dead alpaca liver and heart blood samples. This test used the methods of bacterial isolation, Gram staining, biochemical reaction identification, and PCR test identification to conduct animal pathogenicity tests and antimicrobial sensitivity tests. The results showed that Gram staining was positive, cocci, biochemical indicators and PCR results were consistent with streptococcus. The sequence results showed that the isolate was streptococcus, which has the highest homology with a new strain of streptococcus.(NR_159140.1) In the animal pathogenicity experiment, white rabbits were inoculated with 100 μL·head-1, and all died within 72 h. The case fatality rate was 100%. The drug sensitivity test showed that the isolates were sensitive to ciprofloxacin, levofloxacin, gentamicin, ceftriaxone sodium, azithromycin, flufenicol, ceftriaxone sodium, and telmicoxin, but clindamycin and ampicillin had a certain tolerance. The pathogenic bacteria isolated from alpaca in this experiment were members of the new streptococcus, which provided a reference for the molecular epidemiology of streptococcus from alpaca in Xinjiang and the prevention and treatment of streptococcosis.
Key words: alpaca; streptococcus; isolation and identification; drug seasitirity test
羊驼(Alpaca)原产于南美洲的安第斯山脉,又叫南美小型驼,别名美洲驼[1]。目前,据不完全统计,新疆羊驼的存栏量为400只左右[2],现在研究者对羊驼的疾病防控认识不充分,研究不深入。
链球菌在自然界中分布非常广泛,革兰氏染色呈阳性,是有荚膜多呈双球形的细菌,间或有4~6个短链,偶见个别单球散在分布。其可致多种动物发病,易感动物是绵羊,山羊次之[3]。近年在骆驼上有少数报道[4- 5],均表现为后肢球结下感染,出现溃疡面或化脓疱,关节肿大,但羊驼因链球菌病致死的国内外少见到报道[6-7]。
2019年1月,实验室收到新疆伊犁地区某养殖场死亡羊驼的病料。该养殖场羊驼存栏量35只,在不到一个月的时间内4只死亡。死亡前出现全身性出血性败血症及浆液性肺炎与胸膜肺炎等症状。在2018年11—12月期间,共发病死亡羊驼4只。发病羊驼均表现出精神萎靡、食欲不振、咳嗽等;剖检后可见败血症病变,大叶性肺炎、肺肝变、肝脏肿大、胆囊肿大等。经过病原分离、培养特性、菌落形态致病力和生化试验等初步认为病原为链球菌,进行PCR鉴定,结果与链球菌的同源性高达97%。本次试验为羊驼健康养殖和对羊驼链球菌感染的诊断和治疗有重要的意义。
1 材料和方法
1.1 材 料
1.1.1 病料采集 按照无菌操作要求采集病死羊驼的心脏、肝脏和肺脏。
1.1.2 主要试剂 BHI培养基购自青岛海博生物技术有限公司;Taq PCR Master Mix(2×,blue dye)购自生工生物工程(上海)股份有限公司;革兰氏染色液购自北京索莱宝科技有限公司;TAE、DL-2000 DNA Marker购自天根生化科技(北京)有限公司,生化试剂及其它试剂均为国产分析纯产品。
1.1.3 试验动物 长耳白兔4只,体质量(3±0.2) kg,购于新疆维吾尔自治区疾病预防控制中心。
1.2 方 法
1.2.1 细菌分离培养 无菌取少量的羊駝心脏血液直接接种于BHI液体培养基中,37 ℃恒温培养16~20 h;同时将剪取的肝脏和肺脏病料接种于BHI液体培养基和涂抹于BHI琼脂培养基,37 ℃培养16~20 h。观察菌落颜色和形态特征,并挑选形态一致的优势单菌落。
1.2.2 染色鉴定 取少量培养物进行涂片与革兰氏染色、显微镜下观察及纯化,将菌接种于BHI液体中留用,置于4 ℃备用。
1.2.3 生化反应试验 取适量纯化培养的菌置于生化反应管中进行一系列的生化试验鉴定,37 ℃恒温培养20~24 h。根据使用说明书,观察并记录结果。
1.2.4 16S rRNA基因PCR扩增 参考文献报道[8],设计细菌通用鉴定引物一对,上游5′-AGAGTTTGATCCTGGCTCAG-3′,下游5′-ACGGTTACCTTGTT
ACGACTT-3′,由上海生工生物工程技术服务有限公司合成。将镜下检测的纯培养物作为DNA模板,进行PCR扩增。PCR反应体系共50 μL:2×Taq PCR Master mix为25 μL;引物为2 μL,模板为1 μL;超纯水22 μL;扩增程序为95 ℃ 5 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 10 min;共30个循环;延伸需要72 ℃ 10 min,最后4 ℃保存。取PCR产物5 μL于1%的琼脂糖凝胶胶孔中点样后电泳,并在成像仪内成像进行鉴定。
1.2.5 16S rRNA基因序列测序 将所获得的PCR产物测序,挑选不同种链球菌的16S rDNA基因序列,应用GenBank中的已知核酸序列进行BLAST比对分析,用MEGA X软件进行系统发育树的构建。
1.2.6 动物致病性试验 把纯培养物37 ℃摇菌18 h左右,制备成悬液。将试验的健康白兔4只,随机分成2组,每组2只。试验组白兔采取静脉注射菌液100 μL·只-1(约2.9×108 CFU·mL-1),对照组注射等量的生理盐水。每隔12 h观察发病和死亡情况,并详细记录。
1.2.7 药物敏感性试验 根据无菌操作严格要求[9]。将分离菌接种于BHI培养基中,37 ℃恒温震荡培养18~20 h后,用移液器取200 μL菌液,用灭菌玻璃棒均匀涂布于平板,待平板中的液体完全吸收后,选取常用的10种抗菌药物纸片贴于营养琼脂平板中,每张药敏片间的距离尽量均等,于37 ℃培养箱培养18~24 h,对产生的抑菌圈直径和判定标准判定结果。
2 结果与分析
2.1 细菌分离培养
病料均匀涂于平板后,该菌在BHI琼脂平板上生长良好,菌落扁平、湿润、透明、微小(图1)。
2.2 染色镜检结果
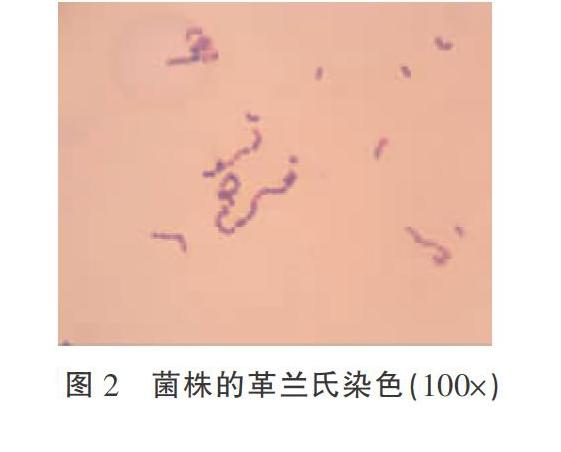
革兰氏染色镜检:组织涂片在镜下可见蓝色成双排列的球菌。用取菌环钓取纯培养物染色镜检,可见染色为革兰氏阳性的球菌,成单/双出现,或短链状排列(图2)。
2.3 生化反应结果
根据《常见细菌系统手册》的参考标准和链球菌阳性对照标准菌株的生化结果进行判定。结果符合链球菌的特征,分离株的生化特性结果见表1。
2.4 16S rRNA PCR扩增结果
待电泳结束后在凝胶成像仪内呈像,拍照并保存图片。结果:扩增出预计的目的条带,大小为1 470 bp的片段,见图3。
2.5 16S rRNA基因序列分析
将测定的序列结果在NCBI网站( http://www.ncbi.nlm.gov/BLAST)进BLAST搜索比对,其基因序列显示为链球菌属。用MEGA软件绘制遗传进化树。结果表明,该菌与从绵羊乳房皮下脓肿分离的新型链球菌属(streptococcus ovuberis strain,序列号为NR_159140.1)的同源性最高,可以达到97%;将分离株标记为SXJA1,可以确认该菌株是链球菌属(图4)。
2.6 动物致病性试验
接种后8 h试验组中的白兔精神不佳,活动减少。在接种72 h后全部死亡(图5)。对照组接种72 h后的白兔均健康存活着。从死亡白兔的心脏血、肝脏中均分离到革兰氏染色镜检出现大量呈链状排列的蓝紫色的球菌,与接种的菌株形态相同;该菌株对白兔具有致病性。
2.7 药敏试验结果
在试验所用的10种药物中,分离株仅对克林霉素和氨苄西林耐药。对环丙沙星、左氧氟沙星、庆大霉素、头孢曲松钠、阿奇霉素、氟苯尼考、头孢曲松钠、替米考星均敏感(表2)。
3 结论与讨论
羊驼的链球菌病是由链球菌属的细菌引起羊驼出现败血症的一种传染病[10],多为散发。目前主要的防控措施是药物杀菌。根据本养殖场的疫病疫情分析中发现,主要的临床症状与剖检结果是菌血症和败血症。从发病到死亡,病程短暂,经济损失严重,疑似细菌所致。为有效控制该病的传播和扩散,及时进行了病原体的分离和鉴定。传统鉴定细菌主要是以生物学特征为基础,按照细菌的形态、生化特点等进行分类,但是却因环境、培养条件等因素影响,结果的稳定性和可靠性都存在较大差异。笔者采用基因部分序列的分析,可以从分子水平上确定出病原体。从养殖场的发病情况,结合病死羊驼病料的剖检变化,细菌培养和核苷酸序列的测定等,最终可判定导致羊驼死亡的主要病原是链球菌。剖检有肺炎特征,实验室也做了有关支原体的检测,结果为阴性,故排除了支原体的感染,可以确诊羊驼感染链球菌引发肺炎而致死。
在进化树分析中分离菌SXJA1与分离株VB15-00779T的同源性最高[11],文献描述这是新型的未鉴定种的链球菌,与莫氏链球菌和骆驼链球菌的亲缘关系最近,是链球菌属的一个新的种。由于是一新型的菌株,目前的研究和参考文献比较少,受条件因素影响的限制,未能继续研究。
链球菌在环境中的存在十分广泛,大部分都不具有致病性。在综合全面地考虑问题时,环境因素也不容忽视。在新疆各地均存在致病性链球菌发病的报道[12],尤其是未达到规模化养殖条件的场所。粪便污染和环境的脏乱差是主要的原因。随着羊驼养殖业的迅速发展,集约化养殖羊驼也在迅速的发展,但是养殖新技术还需不断完善。此次病死羊驼必须深埋,同时环境需要彻底消毒,防止该病的再次发生。
本试验分离的菌株确诊为羊驼源的链球菌,通过实验室一系列的分离鉴定使得这次发病的诊断更加快速和精准。药物的耐药性试验与分析中,该分离株的耐药药物只有两种,对青霉素类和林可酰胺类耐药,所以可以选择其他种类的抗生素进防治。药敏试验也较为快速有效地检测出菌株对各种抗菌药的敏感性,为指导临床合理用药提供了一个方向,方便灵活选药,选出最敏感的药物。羊驼作为产毛型动物在未来有很高的经济前景[13],在新疆畜牧养殖业的发展过程中,羊驼的常见传染病需要慢慢摸索和研究。分离到的链球菌能为后续相关的研究提供数据支持,試验为新疆羊驼养殖中链球菌病的防治提供一定的科学依据。
参考文献:
[1]吕雪峰, 邢巍婷, 许艳丽, 等. 新疆引进羊驼遗传多样性与系统发育研究[J]. 中国畜牧兽医, 2017,44(9):2709-2715.
[2]杨启堂. 新疆羊驼养殖业的进展研究[C]//中国畜牧业协会. 第四届(2015)中国骆驼大会论文汇编, 2015.
[3]付明哲, 李长安, 白涛, 等. 羊链球菌的自动鉴定和耐药性分析[J]. 西北农业学报, 2014,23(1):36-40.
[4]周宇, 邱启官. 一例骆驼马链球菌病诊治[J]. 湖南畜牧兽医, 2014(5):30-31.
[5]伊特格勒, 莫日根高娃, 苏日拉格, 等. 骆驼链球菌病的诊治[J]. 中国畜牧兽医文摘, 2016,32(1):219.
[6]CORPA J M, CARCALLO F, ANDERSON M L, et al. Streptococcus equi subspecies zooepidemicus septicemia in alpacas: three cases and review of the literature[J]. J vet diagn invest, 2018,30(4):598-602.
[7]喻昌盛, 杨启堂. 一例羊驼瘤胃酸中毒继发链球菌感染的诊治[C]//中国畜牧业协会. “一带一路”骆驼科技、产业与文化国际研讨会暨第五届中国骆驼产业发展大会论文集, 2017.
[8]师福山, 赵德明. 禽大肠杆菌的分离与16S rRNA的鉴定[J]. 中国畜牧兽医, 2009,36(2):111-113.
[9]陈楠楠, 秦平伟, 尹珺伊, 等. 东北民猪源停乳链球菌的分离鉴定与药敏试验[J]. 动物医学进展, 2019,40(8):126-130.
[10]张常印. 进境美洲驼的风险分析[D]. 南京:南京农业大学, 2004.
[11]ZAMORA L, PEREZ-SANCKO M, FERNANDEZ-GARAYZ
ABAL J F, et al. Streptococcus ovuberis sp. nov., isolated from a subcutaneous abscess in the udder of a sheep[J]. Int j syst evol microbiol, 2017,67(11):4340-4344.
[12]吴静, 赵文胜. 南疆地区猪链球菌流行病学调查[J]. 中国动物检疫, 2014,31(3):58-60.
[13]李维红, 高雅琴, 王宏博, 等. 羊驼的研究现状及应用前景[J]. 草食家畜, 2007(1):10-11.

