PD-L1和IFN-γ与系统性红斑狼疮患者免疫功能的关系*
孟芳 ,廖永强 ,肖妮 ,戴森华 ,夏洪娇 ,陈波
(江西省萍乡市人民医院,1.检验科;2.风湿免疫科,萍乡 337000)
系统性红斑狼疮 (systemic lupus erythematosus,SLE)是以产生多种身抗体为特征的自身免疫性疾病,免疫功能紊乱为SLE患者,尤其是活动期SLE患者的主要临床特征[1]。细胞抗原分子表达失调、信号转道、基因转录错误及细胞因子共同作用使SLE患者T 淋巴细胞分化异常,导致B 细胞活性失调而产生大量的自身抗体[2]。体外研究显示[3],程序性死亡分子1 ( programmed death 1,PD1)与可溶性程序性死亡分子配体1 ( programmed death ligand-1,PD-L1) 相互作用使SLE患者和健康人T淋巴细胞的增殖和细胞因子的产生均具有抑制作用。另有研究显示[4],IFN-γ 抑制调节性 T 细胞(Treg)功能并增加Th17 细胞分化,诱导B 淋巴细胞刺激因子(B lymphocyte stimulator,BLyS)的产生,促进B 细胞的活化产生致病性自身抗体。本研究通过检测并比较分析活动期和非活动期SLE患者淋巴细胞表面和血清PD-L1、IFN-γ 表达水平,分析PD-L1 与IFN-γ 及体液免疫功能和疾病活动性相关指标的相关性,旨在探讨SLE患者体内PDL1 与IFN-γ 及它们与免疫功能的关系。
1 资料与方法
1.1 研究对象SLE组50例,均为 2018 年 1 月-2019 年12 月我院门诊及住院SLE 患,均为女性患者,年龄 20-52 岁,平均年龄为(44.4±19.6)岁,所有患者均符合美国类风湿病学会2009 年修订的SLE诊断标准[5]。根据活动性判定以SLEDAI-2000 为标准[6],将 SLE患者分成活动组(18 例)和非活动组(32 例),平均年龄分别为 35.6±16.3 和 40.9±15.1。健康对照组,45 例,均为健康体检者,其中男6 例,女39 例,平均年龄为(37.8±12.4)岁,无自身免疫性疾病,心肌酶谱、肝、肾功能正常。收集所有研究对象,包括健康对照的静脉血血清于-80℃保存备用。
1.2 方法与试剂 抗dsDNA 抗体滴度、PD-L1 与IFN-γ 血清水平检测,采用酶联免疫吸附法,试剂盒分别购自欧蒙医学诊断(中国)有限公司和R&D Systems China;CD4+T 细胞、CD8+T 细胞和 CD19+B细胞表面PD-L1 分子表达采用贝克曼库尔特FC500 流式细胞仪分析,小鼠抗人 IgG1-FITC、IgG1 -PE、CD3 -FITC、CD4 -FITC、CD8 -FITC、CD19-FITC、和红细胞裂解液购自贝克曼库尔特(中国)公司,小鼠抗人PD-L1-PE 单克隆抗体购自abcam 中国公司。免疫球蛋白 G、M 和 A、补体 C3、C4 采用贝克曼IMAGE800 全自动特定蛋白仪检测,试剂购自贝克曼库尔特(中国)公司。
1.3 统计学方法 应用SPSS22.0 软件对所有数据资料进行统计学分析,计量资料以mean±SD 表示,计数资料以例数和百分率表示,组间比较采用单因素方差分析; 图表制作使用统计学软件GraphPad Prism5.0,变量间的相关性用Spearman等级相关进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 SLE患者的一般资料及临床特征 SLE患者一般资料及抗核抗体检检测情况与临床特征见表1。健康对照组共纳入45 例,男女比例为6/39,平均年龄为(37.8±12.4)岁。

表1 SLE 组与健康对照组一般人口学资料
2.2 SLE 组和健康对照组CD3+CD4+T 细胞、CD3+CD8+T 细胞和CD19+B 细胞表面PD-L1 分子表达的比较 PD-L1 在CD3+CD4+T 细胞上表达水平显著高于健康对照组(均P<0.01),且活动组显著高于非活动组(P<0.01),而在 CD8+T 细胞和 CD19+B 细胞表面PD-L1 分子表达显著低于非活动组和健康组(均 P<0.01),结果见表2。
表2 PD-L1 在SLE患者及健康对照组淋巴亚群上阳性表达率(±s)%

表2 PD-L1 在SLE患者及健康对照组淋巴亚群上阳性表达率(±s)%
注:*,与健康对照组比较,P<0.05;△,与dsDNA 抗体阴性组相比,P<0.05
组别 PD-L1+CD3+CD4+T cell PD-L1+CD3+CD8+T cell PD-L1+CD19+T cell活动组非活动组健康对照组18 32 45 25.05±2.66*△12.14±1.59*5.22±4.25 16.62±2.64*△18.66±2.40*18.86±1.87 4.82±1.44*△12.46±2.11*14.50±2.24
2.3 SLE患者和健康对照组外周血血清中PD-L1、IFN-γ 水平及疾病活动度指标的比较 活动组外周血清PD-L1 表达水平显著低于非活动组和健康对照组(均P<0.01),而IFN-γ 显著高于非活动组和健康组(均P<0.01),两者在非活动组和健康组间无显著性差异(P>0.05)。活动组 SLE患者 SLEDAI、血清抗dsDNA 抗体滴度和CRP 水平显著高于非活动组和健康对照组(均P<0.01),且非活动组显著高于健康组(P<0.01),补体C3、C4 水平显著低于非活动组和健康对照组(均P<0.01),且非活动组显著低于健康组(P<0.05),所有结果见表3。
2.4 SLE患者外周血清中PD-L1 表达水平与IFN-γ 及它们分别与疾病活动度指标的相关性分析通过对SLE患者外周血清中PD-L1 表达水平与IFN-γ 及它们分别与疾病活动度指标的相关性分析,发现,PD-L1 与 IFN-γ、SLEDAI、抗 dsDNA 抗体滴度和 CRP 呈负相关 (均 P<0.01),结果见图1b,1a,1c 和 1f,与补体 C3 和 C4 呈正相关(均 P<0.05),结果见图1d 和 1e。

表3 SLE患者和健康对照组外周血血清中PD-L1、IFN-γ 水平及疾病活动度指标的比较
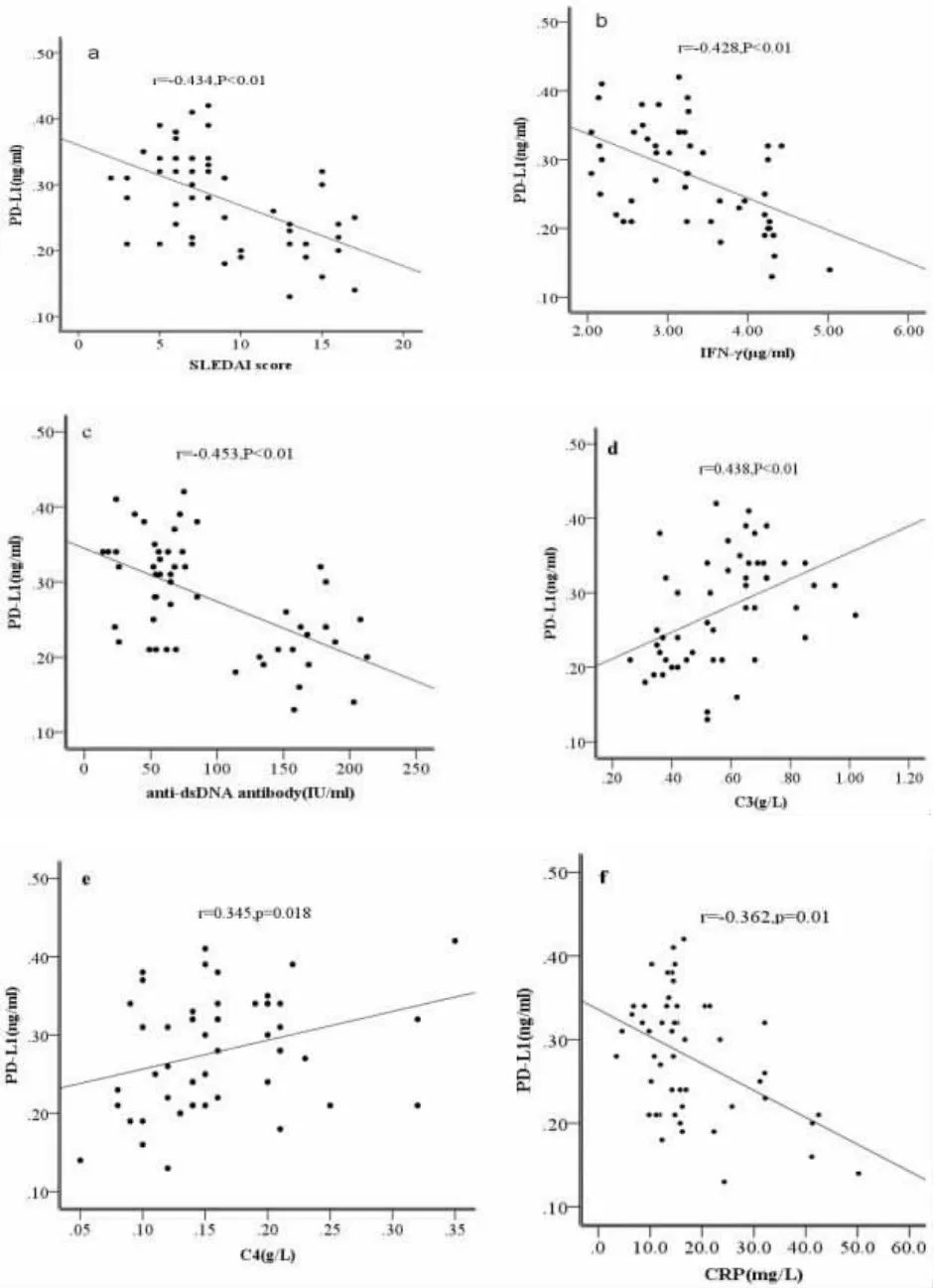
图1 SLE患者外周血清中PD-L1 表达水平与疾病活动性指标的相关性
3 讨论
SLE 为一种自身免疫性疾病,细胞免疫和体液免疫都存在异常,淋巴细胞亚群的异常在SLE 疾病进展中的作用一直是国内外研究的热点。先前研究[7]提示:活动期 SLE患者,CD4+T 细胞升高,CD8+T 细胞下降,CD4+/CD8+比值升高,SLE 发病 T淋巴细胞亚群的改变相关,尤其是CD8+下降引起B 细胞异常激活产生大量自身抗体。王友莲等[8]却发现活动期SLE患者CD8+T 淋巴细胞反而升高,而 CD4+T 细胞减少,CD4+/CD8+比值下降。SLE患者免疫功能紊乱可能是体外环境的诱导、遗传因素和体内细胞因子共同作用的结果[9],但是具体机理尚不清楚。PD-1/PD-L1 这对共刺激分子在自身免疫性疾病的发生发展中可能发挥重要的作用。PD-1 与PD-L1 结合后可以传递负性信号,降低T 细胞的活化程度和炎症反应程度[10]。PD-1 与PD-L1结合还与免疫耐受相关,动物实验发现PD-1 或者PD-L1 基因敲除小鼠容易发展成为自身免疫性疾病[11]。有研究表明,SLE患者外周血 PD-1+CD3+T 细胞和CD19+B 细胞显著升高,PD-L1+CD19+B 细胞和 PD-L2+CD14+单核细胞显著升高[12]。付文哲等[13]研究发现,PD-1 在 SLE患者外周血 T、B 细胞上表达上调,PD-L1 在SLE患者外周血B 细胞和单核细胞上表达上调。本文研究发现,PD-L1 在SLE患者外周血CD4+T 表面表达显著升高,且阳性组高于阴性组,说明当CD4+T 细胞过度活化时,机体通过其他信号通路产生细胞因子促进PD-L1 表达平衡体内细胞免疫,或许与PD-1/PD-L1 参与免疫耐受有关,与本文发现阳性组SLE患者血清IFN-γ 表达显著升高相符。有趣的是,本文发现活动期SLE患者CD8+T 细胞和 CD19+B 细胞表面PD-L1分子显著低于阴性组和健康组。PD-L1 组成性表达在 T、B 细胞淋巴细胞。SLE患者 B 细胞表面PD-L1 表达减少,理论上使PD-L1 /PD-1 通路传递给T 细胞的负信号减弱,从而使T 细胞持续激活,激活的T 细胞可以辅助B 细胞激活,其中可能包括自身反应性B 细胞,后者分泌更多的自身抗体,最终加重 SLE 病情。SLE患者 CD8+T 细胞表面PD-L1 分子表达下调,可能与SLE患者发生病毒感染相关,尤其是巨细胞病毒感染有关,PD-L1分子表达下调使CD8+T 细胞活化对病毒进行杀伤,与本课题前期研究一致[14]。
当SLE患者免疫功能紊乱时,辅助性T 淋巴细胞和单核细胞分泌细胞因子,包括Ⅰ型干扰素、肿瘤坏死因子和白介素等一起参与免疫功能的调节[15]。人体中血清可溶性分子和细胞膜表面的分子一样具有相应的生物学功能,和细胞因子一样参与血液循环在免疫应答中发挥重要的调节作用,它们既能够影响邻近细胞又能够和远端细胞表面的受体相互结合,从而参与疾病的发生、发展。研究发现,血清中可溶性PD-L1 在肺癌患者血清中表达升高,并且与肺癌分期,转移和临床结局密切相关[16],说明在可溶性PD-L1 分子能与肿瘤细胞膜上的PD-1 分子相互作用参与免疫功能调节。IFN-γ 作为Toll 样受体 (TLR) 通路和干扰素刺激通路(STING pathway)的最终产物,能够反向调节T 淋巴细胞,使活化的T 淋巴细胞生存期延长,还能促进记忆性 T 淋巴细胞的分化[17]。IFN-γ 还能诱导 B 淋巴细胞刺激因子的产生,B 淋巴细胞通过细胞受体和免疫球蛋白的结合而活化和分化,最终产生致病的自身抗体[18]。本文研究发现,与健康组相比,SLE患者PD-L1 血清水平表达显著下降,而IFN-γ 血清水平显著升高,且PD-L1 血清水平与IFN-γ呈显著负相关。说明IFN-γ 能反向调控PD-L1 在SLE患者在血清中表达,一同参与免疫功能调节。本分还发现,PD-L1与SLE患者SLEDAI、抗dsDNA 抗体滴度和CRP 呈负相关,与补体C3 和C4 呈显著正相关。说明当SLE患者免疫功能严重紊乱时,血清PD-L1 分子表达减少,抗dsDNA 抗体滴度显著增加,激活干扰素刺激和Toll 样受体通路,促进辅助性淋巴细胞和单核细胞产生IFN-γ,反向调节PD-L1 表达,调节SLE患者免疫功能。
总之,本研究研究发现,SLE患者PD-L1 血清水平与IFN-γ 呈显著负相关,与SLE患者疾病活动度呈负相关,说明PD-1/PD-L1 通路和IFN-γ调节免疫功能通路为两条不同的途径,一起参与SLE患者疾病的发展。本研究仅为临床实验室数据及淋巴细胞表面和可溶性血清细胞因子的检测及相关性分析,其具体机制有待进一步研究。

