硅藻硅酸盐转运子(silicate transporter, SIT)研究进展
商晓梅 , 孙 军 , 信业宏 , 张 珊
(1. 天津科技大学 天津市海洋资源与化学重点实验室, 天津 300457; 2. 天津科技大学 印度洋生态系统研究中心, 天津 300457)
硅藻是一类广泛分布于海洋、淡水以及湿润的土壤中的微型藻类, 目前已知种类超过 20 000种,贡献了约20%的全球初级生产力[1-4]。而硅藻的独特是可以吸收水中的硅酸盐形成形态多样且精致的硅质壁[5-6]。这一特性使其在成为海洋生物硅最大贡献者的同时形成了巨大的硅质矿藏, 从而造成了主要的海洋碳汇[3-6]。
研究发现硅藻出现在上亿年前, 当时海洋中硅酸盐浓度相较于现在高出一个数量级, 当硅酸盐浓度大于 30 μM 时, 会以自由扩散方式进入胞内, 低于30 μM时, 需要硅酸盐转运子(silicate transporter,SIT)的协助进入细胞[4,6-7]。目前海洋表层海水硅酸盐浓度普遍低于30 μM, 其中河口、近岸地区较高大洋较低[4], 硅藻需借助硅酸盐转运蛋白(silicate transporter, SIT)从周围的环境中吸收转运硅酸盐[6]。硅质壁的形成分为转运、转移和沉积三个阶段, 首先硅藻通过硅酸盐转运蛋白将硅酸盐吸收转运到细胞, 在硅藻细胞内硅酸盐被储存在非聚合态可溶性硅转运小泡(silicon transport vesicles, STVS)中, 之后会被运送到硅沉积囊泡(silica deposition vesicle, SDV), 在SDV中合成生物硅参与硅质壁的形成[8-14]。因此, 硅酸盐转运机制的阐明是理解硅质壁形成的关键, 有助于建立硅藻代谢途径模型和进一步阐明硅藻在海洋生态系统及生物地球化学循环中作用, 为解决当前的全球气候变化问题提供研究基础。
1 硅酸盐转运子分子特征
硅元素(Si)存在于所有主要的真核生物类群中,在真核生物中最显著的作用是形成生物矿化的细胞结构[15-19]。首个转运硅酸盐功能的蛋白是在硅藻中被发现的[20]。Hildebrand等(1997)根据细胞对硅吸收的变化从隶属于硅藻门羽纹纲的海洋硅藻纺锤筒柱藻(Cylindrotheca fusiformis)中分离鉴定硅酸盐转运子基因 1(SIT1), 它编码的蛋白是一种分布于细胞膜上的跨膜功能蛋白, 可以直接与硅酸盐作用并将其从细胞外转运到细胞内[20]。后续通过SIT1特异性探针从该藻中分离获得 4种同源蛋白基因, 分别命名为SIT2、3、4和5, 从而证实硅藻 SITs属于多拷贝基因家族[21]。
近年来与SITs相关的研究越来越多。目前已在硅藻36属中发现了超过400条SITs基因序列[20-30]。在目前已完成全基因组测序的9种硅藻中, 有8种硅藻 SITs的cDNA全长基因序列已被发现, 这些硅藻包括纺锤筒柱藻[20-21]、假微型海链藻(Thalassiosira pseudonana)[23]、三角褐指藻(Phaeodactylum tricornutum)[24]、中肋骨条藻(Skeletonema costatum)[25]、圆柱拟脆杆藻(Fragilariopsis cylindrus)[7]、多列拟菱形藻(Pseudo-nitzschia multiseries)[7]、谷皮菱形藻(Nitzschi apalea)[25]和丹麦针杆藻(Synedra danica)[30]。其中在纺锤筒柱藻和多列拟菱形藻中发现了5种SITs类型(SIT1、SIT2、SIT3、SIT4和 SIT5), 在圆柱拟脆杆藻中发现了 7种 SITs, 类型(SIT1、SIT2、SIT3、SIT4、SIT5、SIT6和SIT7), 在假微型海链藻、三角褐指藻和丹麦针杆藻中发现了3种SITs类型(SIT1、SIT2和SIT3), 在中肋骨条藻(SIT2)和谷皮菱形藻(SIT1)中发现了1种SITs类型。根据硅藻中SITs的cDNA全长序列预测 SIT蛋白结构域, 通过同源性分析显示,SIT蛋白功能域同源性相对较高, 都存在 10个跨膜片段(transmembrane domains, TMDs)组成的SIT跨膜结构域, 其中存在重复结构EGXQ-GRQ分布在第2与 3跨膜结构之间和第 7与 8跨膜结构之间, 有些C-末端存在卷曲螺旋结构(coiled-coil structure, COILS)和丝氨酸富集区(Serine-enriched regions, SER)(如图1, 2)[7,31]。通过对纺锤筒柱藻5种SIT蛋白全长比对结果显示, 它们都包含一个SIT跨膜结构域, 其中跨膜结构域同源性高达90%, 而C-末端存在COILS同源性 50%左右; 通过系统进化树分析表明 SIT2与SIT4聚为一枝, 与SIT5聚为一大枝, SIT2和SIT4跨膜结构域同源性高达 99%, 而 C-末端结构域同源性为 67%[21]。但不同种硅藻 SITs同源性较低, 例如假微型海链藻SITs与中肋骨条藻SITs羧基末端不存在卷曲螺旋结构, 与纺锤筒柱藻 SITs同源性也只有44%左右[25]。

图1 预测5种硅藻硅酸转运子2(SIT2)蛋白全长序列比对结果Fig. 1 Prediction of the full-length sequence alignment of five diatom silicate transporter 2 (SIT2) proteins
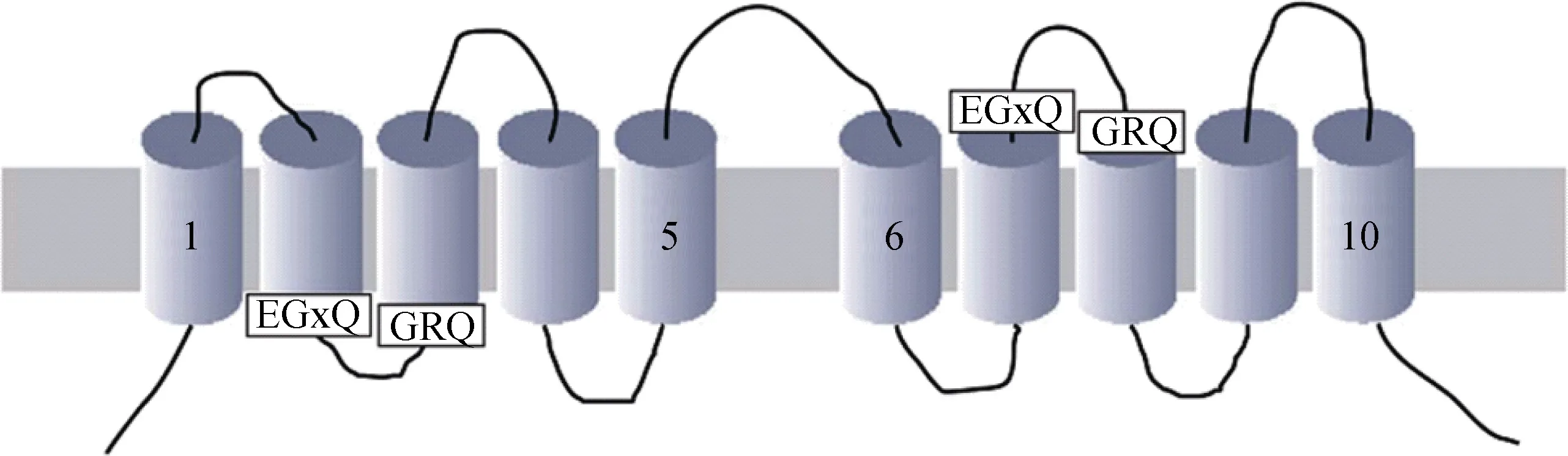
图2 硅酸盐转运子(silicate transporter, SIT)结构示意图[32]Fig. 2 Schematic of silicate transporter (SIT) structure [32]
早期硅藻 SITs研究较少, 但是通过物种的系统发育分析发现SITs和SIT蛋白的同源性不高。Durkin等根据四个硅藻基因组(假微型海链藻、三角褐指藻、圆柱拟脆杆藻、多列拟菱形藻)中SIT 的911个氨基酸(amino acid, AA)(包括间隙AA)同源性分为五个主要分枝, 分别命名为 A、B、C、D和 E, 其他 SITs分类是根据其最保守的114个AA系统进化关系远近鉴定[33]。通过分析发现 A和 D分枝 SITs具有一个SIT跨膜结构域, C-末端存在COILS结构, 但不存在丝氨酸富集区, 例如纺锤筒柱藻5种SITs属于A分枝, 圆柱拟脆杆藻SIT7属于D分枝; C和E分枝只包括一个 SIT跨膜结构域, 例如假微型海链藻三种SITs属于E分枝, 三角褐指藻SIT1和SIT2属于C分枝; B分枝功能结构域具有较多的变化特征, 只存在一个SIT跨膜结构域或多个SIT跨膜结构域, 有的在N-端和跨膜结构之间含有富含丝氨酸区域[7,33], 大部分硅藻SITs都属于B分枝[7]。B分枝被认为是较早进化而来且在海洋硅酸盐浓度很高时就已经出现,而且在如今较低的硅酸盐浓度环境下依然发挥着重要的作用[34]。
2 硅酸盐转运子分子功能机制
通过比对研究纺锤筒柱藻(A分枝)、三角褐脂藻(C分枝)、牟氏角刺藻(B分枝)和淡水藻尖杆针藻(B分枝)4种硅藻中的8个SIT蛋白序列, 发现保守结构域锌结合位点 CMLD(Cys-Met-Leu-Asp), 该位点位于两个不含Lys和Arg的跨膜结构域之间[35-36], 提出基于锌参与硅酸盐转运的模型[36-37]。分析45种海链藻属(包括26种海水属和19种淡水属)的 97条SIT蛋白序列发现 CMLD功能结构域虽然很保守, 但半胱氨酸保守性不高, 且不是所有硅藻都含有 CMLD蛋白功能结构域, 与 CMLD功能结构域相比,GXQ(Gly-X-Gln, X代表不同的氨基酸)功能结构域却相对更保守[6-7,24], 2006年Thamatrakoln等根据保守蛋白功能域提出: 硅酸盐转运子的转运机制是以交替存取转运的功能模式为基础, 根据细胞外或内的环境蛋白质构象交替变化暴露出底物结合位点——GXQ序列模型[25]。通过对包括淡水藻、海水藻以及其他硅化生物大约400条SIT蛋白序列进行系统进化分析表明所有的SIT蛋白序列都包括2个重复结构域EGXQ-GRQ[7], 体外重组实验研究 SIT结构和功能, 也进一步证实保守的GXQ功能结构域与硅酸盐结合和转运密切相关[25,38-39]。通过对来自17种硅藻的48条SIT蛋白全长序列比较分析, 还发现了两个保守功能结构域YQXDXVYL和DXDID, 推测富含天冬氨酸的DXDID保守序列可能作为SIT裂解过程中的蛋白水解位点, 该保守序列没有脯氨酸残基的侧链, 脯氨酸残基可能会使蛋白质二级结构发生弯曲, 从而阻止半胱氨酸的结合, 是其可能作为蛋白水解位点的又一佐证[40]。
3 硅酸盐转运子功能多样性
硅酸盐转运活性受细胞周期的调控, 且与细胞壁结构形成时细胞对硅的吸收密切相关[20,41-42]。而硅饥饿会使细胞周期完全停滞, 细胞周期一般停滞在两个阶段: G1期(G1末期)和G2+M期(即DNA复制完成至子细胞分裂之间)[41,42]。硅藻细胞同步化能够用于研究细胞特定时期表达的蛋白和基因。
根据硅藻对硅酸盐的吸收特性从纺锤筒柱藻中发现了第一个硅酸盐转运子基因, 将该基因导入非洲爪蟾卵母细胞并使其成功表达, 研究发现该整合细胞对硅元素示踪剂68Ge(OH)4的吸收比正常细胞提高84倍, 从而证明其具有硅酸盐转运功能[20]。进一步研究发现该藻种中 SITs在硅质壁合成之前或合成过程中易于诱导表达, 且在硅质壁合成过程中表达量变化显著。其中SIT1基因与其他四种表达模式不同, 推测每一种 SITs在硅酸盐转运过程中发挥特定的作用, 细胞通过控制每一种 SITs表达部位和表达量来调节硅酸盐的吸收或转运[21]。
采用SIT特异性抗体和实时定量PCR技术相结合从蛋白和基因水平检测了假微型海链藻在细胞周期同步化过程中 SIT表达量变化。研究发现蛋白与mRNA表达水平不一致, 蛋白表达量的变化与硅质壁形成过程更相关, 且 mRNA表达最大值发生在 S期,分析推测 mRNA之所以有积累但没有相应地被翻译成蛋白质的原因可能是当需要蛋白时,mRNA的积累能够使细胞产生快速的反应[43]。Curnow等将假微型海链藻 SIT1、SIT2和 SIT3与绿色荧光蛋白(Green fluorecent protein, GFP)基因重组并在酿酒酵母成功表达, 在体外建立了成熟的硅酸盐转运体系,研究发现SIT对硅酸盐的吸收依赖于Na+梯度, 但在硅藻细胞中SIT3与SIT1和SIT2不同, 不仅其表达量较低且对硅限制没有反应[27]。2015年Shrestha和Hildebrand检测了不同硅酸盐体系下这三种 SITs的mRNA和蛋白丰度的变化, 并通过基因敲除技术建立了 SITs基因缺陷型假微型海链藻细胞系, 研究了在硅饥饿状态下该藻系对硅酸盐转运、二氧化硅结合和脂质积累方面的影响[44-46]。研究发现与正常藻细胞相比, 假微型海链藻 SITs基因缺陷型细胞系对硅酸盐的转运和二氧化硅的合成影响不同, 且对脂质积累要早于正常藻细胞, 这说明细胞是主动感受硅酸盐的限制。大量研究数据表明, 在硅酸盐充足的条件下, SIT转运作用相对较小, 它们主要作用是检测硅酸盐水平, 以评估细胞是否能继续其子细胞壁的形成和分裂过程。
4 硅酸盐转运子进化关系
目前硅藻硅酸盐转运子进化起源仍不清楚。硅藻属于SAR超类群(包含不等鞭毛生物Heterokonts、囊泡虫 Alveolates和有孔虫 Rhizaria三大类群)中的不等鞭毛类生物[31,47]。目前在有砂壳的领鞭毛藻双肋立领藻(Stephanoeca diplocostata)和格蓝迪球领藻(Diaphanoeca grandis)中发现了 SIT-type基因序列,其蛋白预测结构与硅藻SIT相似, 都包含一个SIT跨膜结构域(10个 TMDs)和 2个重复结构域 EGXQGRQ[31,37]。对其功能进一步研究发现领鞭毛虫的SITs基因可以分为 SITα和 SITβ两种功能型, 其中SITα表达量较高且受硅酸盐浓度影响显著, SITβ表达量普遍较低且不受硅酸盐浓度影响[31]。
根据数据库比对检索发现在聚球藻属(Synechococcus)、不透明红球菌(Rhodococcus opacus)和海蠕虫(Capitella teleta)也存在SIT-like(SIT-L)基因序列, SIT-L基因序列只编码了5个TMDs和一个EGXQ- GRQ结构域, EGXQ位于C-端第2个TMD跨膜片段, GRQ位于 N-端第 3个 TM 跨膜片段[31]。Durak等在颗石藻(Prymnesium neolepis)中也发现了SIT-type的同源序列,包含一个 SIT跨膜结构域(10个 TMDs)和 2个重复EGXQ-GRQ片段的基本结构, 与硅藻SIT同源性达到39.8% ~ 47.0%, 随后在钙化相对比较强的三种颗石藻阿氏篮石藻(Scyphosphaera apsteinii)、帕氏颗石藻(Coccolithus braarudii)和细孔钙盘藻(Calcidiscus leptoporus)也被发现有SIT-L基因序列的存在[32]。
真核生物中存在的SITs同源序列可分为Group 1 SITs、 Group 1 SIT-Ls和Group 2(包含不属于硅藻的不等鞭毛类、囊泡虫和放射虫族系等的SITs和SIT-Ls)三大类群[31]。研究发现陆生植物例如水稻(Oryza sativa)等不存在 SIT-L, 而是存在与 NIP III(nodulin-26-like intrinsic protein III)蛋白功能相似的基因Lsi1和 Lsi6[18,48], 与硅酸盐流出活性相关转运蛋白基因Lsi2[49]。Lsi2与细菌砷酸盐转运体 ArsB有关, 介导植物细胞内硅酸盐流出[49]。Lsi2在硅藻和金藻新鳞普林藻(Prymnesium neolepis)中也存在, 其转录调控与假微型海链藻中的 SIT2高度相似, 但其在细胞中功能作用尚未被鉴定[50]。研究表明硅质较强的海绵种居蟹皮海绵(Suberites domuncula)并未发现SIT同源序列的存在, 分析原因可能是由于海绵中 Na+/共转运体在硅酸盐的转运中发挥主要作用[51]。Lsi2不仅在非硅质化生物中存在, 在硅质化生物也存在 Lsi2-like (Lsi2-L), 表明其在真核生物硅化过程的作用较为保守。研究推测这些不同种类的与硅酸盐转运相关的基因最初是作为海洋中高硅浓度的一种解毒机制进化而来, 是为了应对前寒武纪海洋中高硅毒性而出现的[31]。真核生物硅酸盐转运蛋白系统发育分析推测生物硅化在不同谱系生物中是独立进化的, 从而导致硅酸盐转运基因的多样性。真核生物硅酸盐转运子广泛分布和古老起源表明硅酸盐的利用可能不仅局限于硅质生物, 硅酸盐在其他真核生物的进化和生物学中也发挥广泛且基础的作用。
5 总结与展望
有关硅藻 SIT相关的研究很多, 但都偏向于基因序列的发现(即硅藻物种中SITs存在与否), 或是简单的表达量的变化, 并没有过多的深入性的功能探究。这导致 SITs进化源不清晰、SIT的转运机制不清楚, 这些阻碍了硅藻SIT研究进展。SITs在更多硅藻物种中研究的同时着重硅藻模式物种的研究和开发, 使其功能得到全面的研究和阐明, 能够为硅藻SIT的研究提供更明确的研究方向和目标。SIT转运机制的阐明是硅质壁形成的关键。硅藻硅质壁的形成不仅是海洋生物矿化中非常重要的部分, 在通过压载有机物质从真光层下沉, 向深海输出碳方面同样发挥着重要作用。提高对硅质壁形成细胞机制的认识将使我们了解过去气候事件对硅藻影响、更好地预测它们对未来环境变化的反应、进一步完善硅藻的在海洋生物地球化学过程演变中的作用, 为解决当下的全球气候变化问题提供科学基础和依据。

