白及假鳞茎薄片诱导不定芽及快繁体系的构建
樊 莉 王仁睿 余 马 刘金焕 侯大斌 唐志康
(西南科技大学生命科学与工程学院,绵阳 621010)
白及(Bletillastriata)为兰科(Orchidaceae)白及属(Bletilla)多年生草本植物,主要分布于我国陕西南部、甘肃东南部、江苏、安徽、四川、贵州、云南、湖南等地[1]。据《中国药典》记载,白及干燥块茎具有收敛止血,消肿生肌的功效,可用于咯血、吐血、外伤出血、疮疡肿毒和皮肤皲裂[2],为我国常用的中草药。白及富含联苄类、白及胶、菲类化合物等成分,可起到美白、抗衰老等作用,广泛应用于化妆品行业[3]。此外,白及还被应用于食品工业、烟草工业等多领域。因此白及具有重要的开发价值,市场需求量巨大。据不完全统计,白及的年需求在4 000吨以上[4]。
白及药材主要来源于野生资源,但长期的过度挖掘使白及野生资源急剧萎缩,目前白及已被列入国家珍稀濒危保护植物名录[5]和《濒危野生动植物国际贸易公约(CITES)》[6]。白及的人工繁殖以块茎繁殖为主,但繁殖系数较低,成本高,难以满足大规模生产的需求[7]。人工规模化繁殖是实现白及药用资源可持续发展的必由之路。组织培养技术以规模化、低成本为优势,目前已逐渐成为白及人工繁育的重要技术手段。
白及的组织培养相关研究中,种子是最为常用的外植体材料[8~11]。白及的蒴果中通常含有数万颗无胚乳的种子,通过人工组培可极大地提高繁殖系数,蒴果易于消毒,污染率低,且有利于保持亲本优良性状[12]。但通过种子繁殖的苗由于数量多,生长较为细弱,需要一段时间才能健壮,且性状上也会有一定差异。其次幼根[13]、茎尖[14]、侧芽[15]、原球茎[16]和块茎[17]也被用作外植体进行组织培养,但与种子相比,这些外植体培养分化时间长、分化效率较低,该类研究数量较少。由此可见,继续筛选适宜的外植体,建立效率高、周期短的组织培养体系对于白及的工厂化生产具有重要意义和广阔前景。本文以白及假鳞茎为外植体,采用切取假鳞茎薄片的方式,探索假鳞茎薄片不同部位、不同激素种类与浓度配比的培养基,比较假鳞茎薄片不同厚度的褐化程度及出芽数,筛选适合假鳞茎直接诱导不定芽的方式,通过正交设计筛选组培苗的增殖培养基,以期建立以假鳞茎薄片组织诱导不定芽为技术核心、简单高效的快繁体系,为白及的繁育提供技术支持。
1 试验材料与方法
供试材料白及(Bletillastriata)由同一母株分苗扩繁而成,由乐山市乐福生物科技有限责任公司提供。
1.1 外植体消毒
以白及的块茎为外植体,饱和漂白粉水浸泡10 min,自来水冲洗0.5 h,在超净工作台上用75%酒精浸泡外植体30 s,无菌水清洗1次,0.1%升汞+1~2滴吐温灭菌15 min,无菌水冲洗5次,接种于MS+BA 1.0 mg·L-1+NAA 0.1 mg·L-1+蔗糖30 g·L-1+琼脂7.0 g·L-1[17]的培养基上进行芽的诱导,其中MS+蔗糖30 g·L-1+琼脂7.0 g·L-1为基本培养基(BM),pH5.8,培养温度26±1℃,光照为12 h·d-1,光照强度1 500 lx,培养6周。
1.2 芽的壮苗及假鳞茎的诱导
选取生长正常的芽,接种于BM+1.0 mg·L-1NAA+30 g·L-1香蕉泥的固体培养基上,培养6周进行壮苗和假鳞茎的诱导[18],培养环境同1.1。
1.3 假鳞茎薄片诱导不定芽
将壮苗后的苗(见图1a)诱导出的假鳞茎(见图1b)平均切成上、中、下3个部位(见图1c),分别接种于添加不同质量浓度的NAA、BA和TDZ的基本培养基中培养4周,以筛选出最佳的部位及不定芽诱导培养基。将筛选出的假鳞茎最佳部位按照0.5~1.0、1.1~1.5和1.6~2.0 mm的厚度切取薄片,接种到最佳的不定芽诱导培养基,探索不同厚度对褐化率和出芽率的影响。每个处理10个外植体,重复3次。培养条件同1.1。
1.4 增殖培养
将诱导的芽分别接种于添加不同质量浓度的BA和NAA的基本培养基中培养6周,以筛选出最佳的增殖培养基。每个处理10个不定芽,重复3次。培养条件同1.1。
1.5 壮苗和生根培养
取增殖后的不定芽接入到1/2MS+1.0 mg·L-1NAA+1.0 mg·L-1GA3+2.0 g·L-1活性炭+30 g·L-1蔗糖+7.0 g·L-1琼脂的培养基上培养4周,进行壮苗及生根培养[19]。培养条件同1.1。
1.6 移栽
将苗高5~7 cm、根系生长良好的白及苗小心从培养瓶中取出,清洗干净根部附着的培养基,浸泡于500倍多菌灵溶液中10 min,晾干后栽种于灭过菌的基质上,基质组成为椰糠∶黄土∶蛭石∶珍珠岩=2∶1∶1∶1[20],基质含水量保持在70%~80%。加强通风换气保湿,1个月后统计成活率。
1.7 数据整理与统计分析
出芽率(%)=诱导出芽的假鳞茎薄片数量/接种假鳞茎薄片总数
(1)
褐化率(%)=褐化的假鳞茎薄片数量/接种假鳞茎薄片总数
(2)
增殖系数=一个周期内形成的有效苗数/接种苗数
(3)
数据采用SPSS19.0软件进行分析。
2 结果与分析
2.1 假鳞茎的不同部位、激素对白及假鳞茎薄片诱导不定芽的影响
将白及假鳞茎不同部位接种于不同激素浓度和配比培养基上,试验设计为4因素3水平正交试验,假鳞茎薄片培养1周后可见到不定芽开始生长(见图1d),3周后,芽长至2~3 cm(见图1e)。由表1可知,最佳处理为7号处理,即白及假鳞茎下部薄片在BM+2.0 mg·L-1BA+1.0 mg·L-1TDZ,出芽率为93.3%,平均出芽数为15个,显著高于其他培养基(见表1)。由表2~3可得4个因素对出芽率和出芽数的作用大小关系为假鳞茎部位>TDZ>BA>NAA。假鳞茎的部位对出芽率和出芽数的影响最大且极显著(P<0.01),下部的出芽率为83.3%~93.3%(见表1),显著高于上部和中部。TDZ和BA对假鳞茎薄片的出芽率和出芽数的影响显著(P<0.05),NAA对假鳞茎薄片出芽率影响不显著。
表1 不同部位的假鳞茎薄片、激素浓度和配比处理对不定芽的诱导情况
Table 1 Effect on different position of pseudobulb transverse thin cell layer sections and growth regulator concentration for shoot regeneration ofB.striata
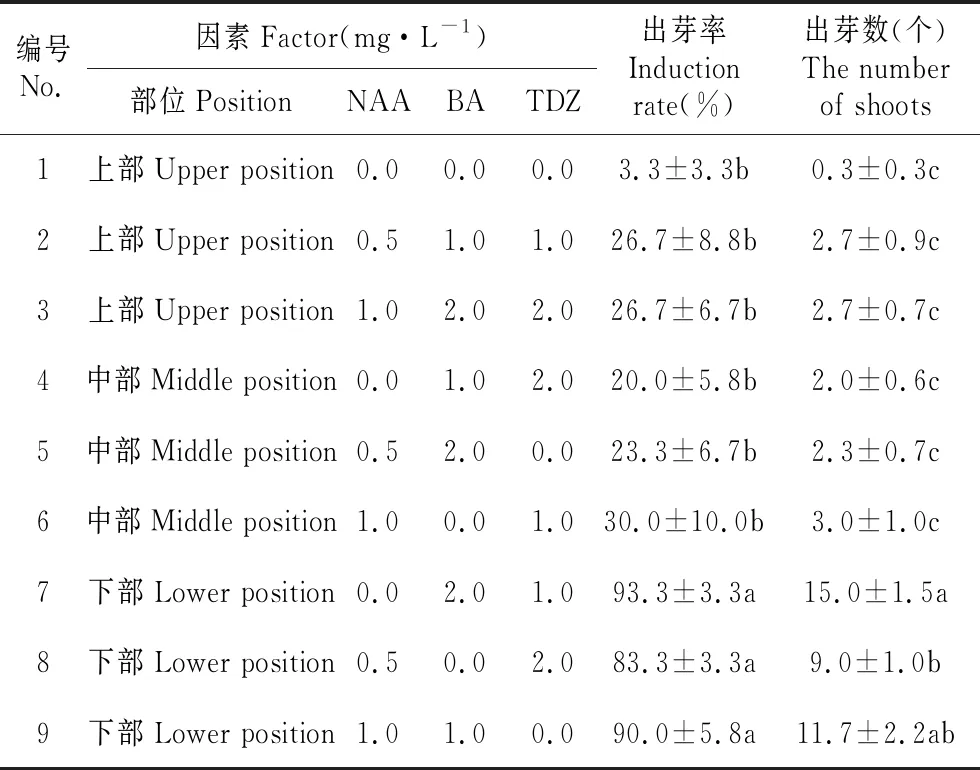
编号No.因素Factor(mg·L-1)部位PositionNAABATDZ出芽率Induction rate(%)出芽数(个)The number of shoots1上部Upper position0.00.00.03.3±3.3b0.3±0.3c2上部Upper position0.51.01.026.7±8.8b2.7±0.9c3上部Upper position1.02.02.026.7±6.7b2.7±0.7c4中部Middle position0.01.02.020.0±5.8b2.0±0.6c5中部Middle position0.52.00.023.3±6.7b2.3±0.7c6中部Middle position1.00.01.030.0±10.0b3.0±1.0c7下部Lower position0.02.01.093.3±3.3a15.0±1.5a8下部Lower position0.50.02.083.3±3.3a9.0±1.0b9下部Lower position1.01.00.090.0±5.8a11.7±2.2ab
注:不同小写字母表示在P<0.05水平上差异显著,下同。
Note: Different lowercase letters mean significant difference atP<0.05 level,the same as below.
表2 白及假鳞茎薄片出芽率的方差分析
Table 2 Analysis of variance of induction rate from pseudobulb transverse thin cell layer sections ofB.striata

变异来源Source of variation平方和Sum of square自由度df均方Mean of squareF值F value显著性sig.部位Position5.68522.84375.990.000NAA0.07420.0370.990.391BA0.29420.1473.9310.038TDZ0.29920.1493.990.037误差Error0.673180.037总计Sum7.02526
表3 白及假鳞茎薄片出芽数的方差分析
Table 3 Analysis of variance of the number of shoots from pseudobulb transverse thin cell layer sections ofB.striata
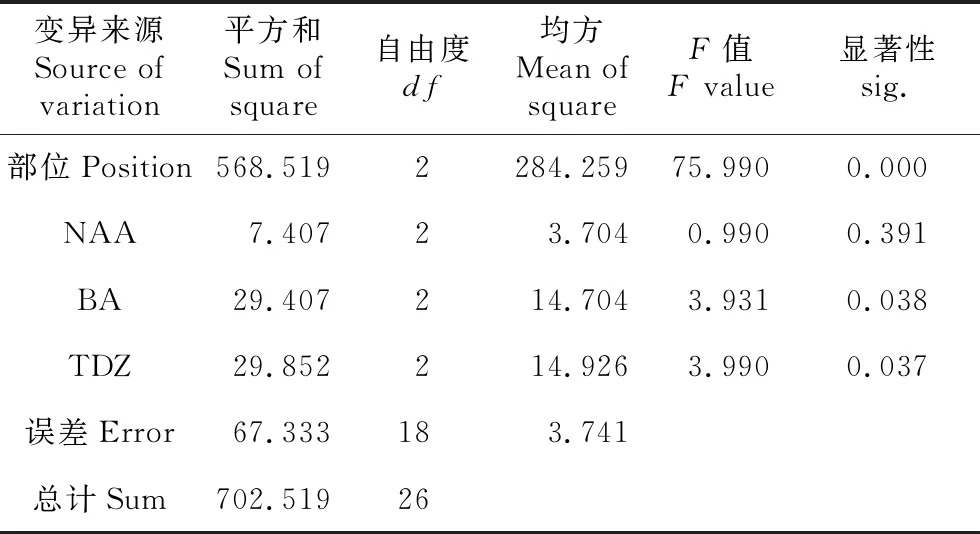
变异来源Source of variation平方和Sum of square自由度df均方Mean of squareF值F value显著性sig.部位Position568.5192284.25975.9900.000NAA7.40723.7040.9900.391BA29.407214.7043.9310.038TDZ29.852214.9263.9900.037误差Error67.333183.741总计Sum702.51926

图1 白及假鳞茎薄片诱导及快繁体系 a.用作切片的白及苗;b.假鳞茎;c.假鳞茎平均切成上、中、下3部位;d.诱导1周后的假鳞茎薄片;e.诱导3周的假鳞茎薄片;f. 0.5~1.0 mm厚度的假鳞茎薄片褐化严重;g. 1.6~2.0 mm厚度的假鳞茎薄片褐化轻微;h. 9号培养基上增殖6周的白及苗;i.生根的白及苗;j.移栽1个月后的白及苗;k.移栽3个月后的白及苗Fig.1 Shoot regeneration from pseudobulb transverse thin cell layers and micropropagation of B.striata a. An in vitro plant used for excision of pseudobulb transverse thin cell layer for shoot regeneration; b. A pseudobulb; c. A pseudobulb was cut averagely for three transverse thin cell layers- upper part, middle part and lower part; d. A pseudobulb transverse thin cell layer was cultured on a medium for one week; e. A pseudobulb transverse thin cell layer was cultured on a medium for three weeks; f. A pseudobulb transverse thin cell layer(0.5-1.0 mm in thickness) was obvious browning; g. A pseudobulb transverse thin cell layer(1.6-2.0 mm in thickness) was scarce browning; h. The shoots were micropropagated on No.9 medium; i. A plantlet with roots; j. A plant after transplantation for one month; k. Growth vigour plants in soil three months after ex vitro transfer
2.2 不同厚度的假鳞茎薄片对不定芽诱导的影响
假鳞茎薄片的厚度对于不定芽的诱导影响很大,0.5~1.0 mm的假鳞茎薄片最易褐化(见图1f),褐化率高达76.7%,随着厚度的增加,褐化率呈明显下降的趋势,出芽数增加。1.6~2.0 mm的假鳞茎薄片不易褐化(见图1g),褐化率为6.7%,出芽数最多,达16.7个,显著优于0.5~1.0和1.1~1.5 mm(见表4)。
表4 不同厚度的假鳞茎薄片对不定芽诱导的情况
Table 4 Effect on thickness of pseudobulb transverse thin cell layer sections for shoot regeneration

厚度Thickness(mm)褐化率The browning rate(%)出芽数The number of shoots(ind.)0.5~1.076.7±3.3a4.7±2.2b1.1~1.526.7±14.5b8.3±0.7b1.6~2.06.7±5.8b16.7±1.9a
2.3 不同激素浓度和配比对不定芽增殖的影响
BA和NAA的不同浓度配比对不定芽增殖具有显著的影响(见表5)。9个配方中,增殖系数为1.5~4.3,平均苗高为1.7~4.7 cm,9号培养基(BM+1.5 mg·L-1BA+0.3 mg·L-1NAA)增殖效果显著优于其他培养基,增殖系数达4.3,平均苗高为7.8 cm,为最佳增殖培养基(见图1h)。
表5 不同激素浓度和配比对不定芽增殖的情况
Table 5 Effect on different growth regulator concentration for shoot multiplication
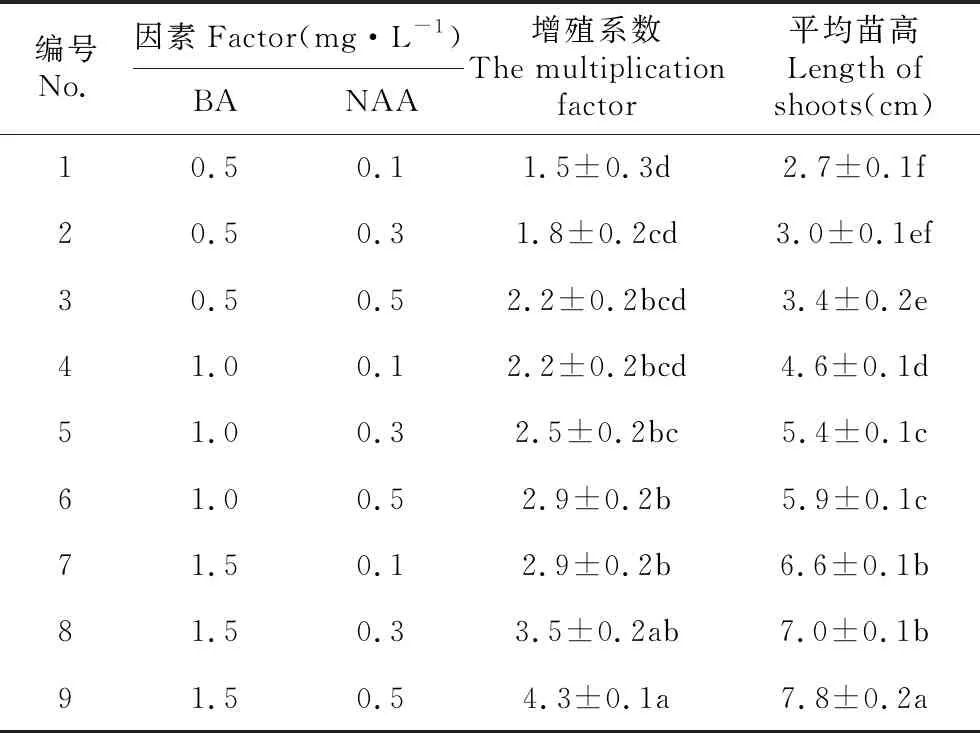
编号No.因素Factor(mg·L-1)BANAA增殖系数The multiplication factor平均苗高Length of shoots(cm)10.50.11.5±0.3d2.7±0.1f20.50.31.8±0.2cd3.0±0.1ef30.50.52.2±0.2bcd3.4±0.2e41.00.12.2±0.2bcd4.6±0.1d51.00.32.5±0.2bc5.4±0.1c61.00.52.9±0.2b5.9±0.1c71.50.12.9±0.2b6.6±0.1b81.50.33.5±0.2ab7.0±0.1b91.50.54.3±0.1a7.8±0.2a
2.4 生根和移栽
白及组培苗在生根培养基上培养6周后,假鳞茎和根系生长健壮(见图1i),适合进行移栽。1个月后,植株存活率达85%,根系明显生长(见图1j)3个月后植株长至12~15 cm,生长旺盛(见图1k)。
3 讨论
本研究建立了以假鳞茎薄片诱导不定芽为关键技术的快繁技术体系。在诱导不定芽过程中,探索了假鳞茎部位、TDZ、BA和NAA对出芽率和出芽数的作用情况,假鳞茎部位影响极显著,下部的出芽率为93.3%,出芽数为15个,显著高于上部和中部;TDZ和BA对出芽率和出芽数影响显著,NAA影响不显著;假鳞茎薄片厚度以1.6~2.0 mm为宜,不易褐化;不定芽的最优培养方式为:假鳞茎下部薄片(1.6~2.0 mm)在BM+2.0 mg·L-1BA+1.0 mg·L-1TDZ上培养3周。最优的增殖培养基为BM+1.5 mg·L-1BA+0.3 mg·L-1NAA,培养6周后,增殖系数达4.3。经过壮苗和生根后白及组培苗即可进行移栽。以一棵白及苗来计算,假鳞茎3个部位薄片最多可诱导不定芽个数为20个,增殖后可达86棵,因此,该体系与之前的研究相比,大大提高了白及的繁殖效率。
众多学者在白及的快速繁殖上主要采取种子无菌播种的方式,但种子萌发成苗后植株过于孱弱,需要较长的时间用以壮苗。部分研究以块茎、侧芽、原球茎等作为外植体,但污染问题始终存在,而且对于兰科植物而言,再生途径的周期较长是普遍存在的问题[21]。本研究以组培苗的假鳞茎为材料,以假鳞茎薄片为材料直接诱导不定芽,可极大地规避污染的风险,而且植株健壮,可直接用于增殖和生根,有效节约时间。
将植物器官切成薄片作为外植体进行不定芽的诱导已在多种植物上有所应用,如菊花[22]、越南人参[23]、黄细心[24]、草类[25]、苹果[26]、铁皮石斛[27]、花椒[28]等。其中在百合[29]、兰花[30]等几种植物上已报道假鳞茎薄片作为外植体进行器官诱导。薄片诱导不定芽的形式是一种高效的再生方式,过程中无愈伤组织的形成,极大地避免了遗传变异的风险[31]。
假鳞茎的不同厚度存在褐化情况明显不同的现象,本研究比较了3种厚度假鳞茎薄片的褐化率,结果表明假鳞茎薄片厚度越小,褐化率越高,出芽数也少。0.5~1.0 mm的假鳞茎薄片其褐化率高达76.7%,出芽率为4.7;1.6~2.0 mm的假鳞茎薄片其褐化率为6.7%,出芽数为16.7,显著优于0.5~1.0 mm和1.1~1.5 mm的假鳞茎薄片,为最适宜的外植体。类似结果在其他研究中有相关描述,刘玫等[31]指出大花惠兰的薄片小于1.0 mm时,诱导效果不理想,外植体容易褐化死亡,2 mm左右的切片可直接诱导形成类原球茎。
本研究的结果显示假鳞茎的部位对不定芽的出芽率和出芽数影响极显著,下部的薄层显著优于上部和中部,分析原因是由于假鳞茎是兰科植物常见的、极度缩短的茎,节间过密。根据李筑荪等[33]的报道,春兰的假鳞茎上部和中部为稀节区,下部为密节区。白及可能与春兰类似,下部是节相对集中的部位,隐芽数量多,因此在下部进行切片进行诱导可获得较高的出芽率和出芽数。如需阐明这一原因需要进一步对白及假鳞茎的不同部位进行解剖学观察。
生长素和细胞分裂素在器官发生的过程中是非常必要的,TDZ、BA和NAA被广泛应用于薄片诱导的相关报道中,如10 μm TDZ最适合菜豆薄片诱导不定芽[34];Teixeira da Silva and Fukai[22]报道菊花的茎薄片在不同的激素种类中诱导情况不同,2 mg·L-1的BA对诱导不定芽有效,TDZ对诱导愈伤组织有效,NAA对诱导根有效;1.5 mg·L-1的BA和0.5 mg·L-1NAA是最适合黄细心的茎切片诱导不定芽的激素组合[24]。本研究结果表明TDZ和BA对白及假鳞茎薄片诱导不定芽起到显著影响。不同的植物在诱导不定芽时对激素的种类需求不同,一是可能和基因型有关,二是可能和植物的内源激素有关。BA和NAA已被证实在白及组培苗的增殖中起到积极的作用[13~14],本研究中BA和NAA的组合也在增殖过程中取得了较好的效果,最佳增殖培养基为BM+1.5 mg·L-1BA+0.3 mg·L-1NAA。本研究成功建立了以白及假鳞茎薄片诱导不定芽为关键技术的快繁技术体系,繁殖效率高,周期短,避免了变异的风险,为白及种质资源创新奠定了基础。

