缅甸产青紫葛的化学成分及细胞毒活性研究
张东东,李兴玉,刘 珮,崔大鹏,王跃虎,杨雪飞*
1中国科学院东南亚生物多样性研究中心,耶津 05282;2中国科学院昆明植物研究所资源植物与生物技术重点实验室;3中国科学院昆明植物研究所云南野生资源植物研发重点实验室;4云南农业大学,昆明 650201
青紫葛CissusjavanaDC.(异名:C.discolorBlume、VitisdiscolorDalzell、C.sicyoides、C.sessilis)为葡萄科(Vitaceae)白粉藤属植物,分布于中国的四川和云南,以及缅甸、越南、尼泊尔等南亚和东南亚地区[1]。根据The Plant List(http://www.theplantlist.org/1.1/browse/A/Vitaceae/Cissus/)的收录,白粉藤属共有324个物种。研究表明一些白粉藤属的植物具有抗癌、抗氧化、抗糖尿病、抗炎、镇痛等药理活性[2],其中方茎青紫葛(C.quadrangularis)、锦屏藤(C.verticillata)和C.pallida具有抗癌活性[3-5]。目前已知该属植物的化学成分主要为二苯乙烯类[6]、环烯醚萜类、酚类及其苷类和木脂素类[2,7]。在缅甸,当地人用青紫葛干燥块根煎水喝,用于治疗癌性肿瘤[8]。缅甸本土知名制药企业FAME(Fame Company)将青紫葛的块根(C.discolor)和白粉藤(C.repens)的块根提取物制成药片,用于治疗肿瘤。尽管如此,青紫葛的药理活性和化学成分均未见报道。本研究旨在分析青紫葛块根的化学成分及其细胞毒活性,为验证缅甸传统医药知识和进一步药物研发提供基础数据。
1 仪器与材料
Autopol VI 旋光仪(鲁道夫,德国)用于测试比旋光度;Avance Ⅲ-500 MHz、Avance Ⅲ-600 MHz和Avance Ⅲ-800 MHz超导核磁共振仪(德国布鲁克拜厄斯宾有限公司)用于测试1H NMR、13C NMR、HMBC、HSQC和COSY光谱数据;UPLC-IT-TOF 液相-离子阱飞行时间质谱仪(岛津,日本)用于测试ESIMS和HRESIMS;柱层析材料包括正相硅胶G(80~100目,300~400目,青岛海洋化工厂)、反相硅胶RP-C18(40~75 μm,日本Fuji Silysia 化学公司)和葡聚糖凝胶SephadexTMLH-20(GE Healthcare Bio-Sciences AB);Agilent 1200 半制备液相色谱仪(美国安捷伦公司),配备色谱柱Welch Ultimate®AQ-C18柱(5 μm,φ4.6 × 300 mm,Welch Materials Inc.,上海)和Agilent Zorbax SB-C18柱(5.0 μm,φ9.4 × 250 mm,美国),用于化合物的半制备;化合物显色剂为5%硫酸-乙醇溶液。
青紫葛试验材料(块根)购买于缅甸东枝市场,样品由中国科学院昆明植物研究所杨珺实验师和张宇工程师鉴定,凭证标本(No.MY1612156)保存于中国科学院昆明植物研究所重点实验室。
2 实验方法
2.1 提取分离
青紫葛的干燥块根2.55 kg,粉碎后用90%的乙醇超声提取40 min(50 ℃),提取液减压浓缩得到浸膏157.8 g。然后用石油醚、乙酸乙酯、正丁醇依次萃取,分别得到石油醚(A,0.9 g)、乙酸乙酯(B,21 g)和正丁醇(C,44 g)部分。
乙酸乙酯部分(B,21.0 g)经硅胶柱色谱(二氯甲烷-甲醇)梯度洗脱,得到6个组分(Fr.B1~Fr.B6)。Fr.B1(4.5 g,二氯甲烷部分)经反相C18中压柱色谱(甲醇洗脱)和硅胶柱色谱(石油醚-丙酮,10∶1)分离得到化合物10(7.8 mg)。Fr.B2(1.2 g,二氯甲烷-甲醇,10∶1)经甲醇重结晶得到化合物4(200.0 mg),其余部分经反相C18硅胶柱(甲醇-水,30∶70→50∶50)、Sephadex LH-20 凝胶柱色谱(MeOH)和硅胶柱色谱(二氯甲烷-丙酮,10∶1)分离到化合物7(13.2 mg)和硅胶色谱柱(二氯甲烷-甲醇,30∶1)分离到化合物8(4.6 mg)。Fr.B3部分(2.1 g,二氯甲烷-甲醇,10∶1)经反相C18中压柱色谱(甲醇-水,50∶50)、Sephadex LH-20凝胶柱色谱(MeOH)和硅胶柱色谱(二氯甲烷-甲醇,20∶1)分离到3(135.1 mg)和6(6.1 mg)以及一个混合物。后者经半制备HPLC分离到化合物5(2.0 mg,Agilent 9.4×250 mm,2 mL/min,甲醇-水,30∶70,tR=21.635 min)。
正丁醇部分(C,44.0 g),经硅胶柱色谱(乙酸乙酯-甲醇)梯度洗脱,得到7个组分(Fr.C1~Fr.C7)。Fr.C1(乙酸乙酯洗脱部分,10.1 g)经反相C18中压柱色谱,得到5个组分(Fr.C1.1~ Fr.C1.5)。Fr.C1.1(甲醇-水,30∶1→40∶1,2.7 g)经硅胶柱色谱(二氯甲烷-甲醇,80∶1)和半制备HPLC分离到化合物9(6.2 mg,Agilent 9.4×250 mm,2 mL/min,乙腈-水,10∶90,tR=41.521 min)。Fr.C1.2(甲醇-水,10∶90→20∶80,1.9 g)经硅胶柱色谱(氯仿-甲醇,50∶1)、Sephadex LH-20凝胶柱色谱(甲醇)和半制备HPLC分离到化合物2(2.0 mg,Agilent 9.4×250 mm,2 mL/min,甲醇-水,10∶90,tR=23.679 min)、15(1.4 mg,Agilent 9.4×250 mm,2 mL/min,乙腈-水,10∶90,tR=33.077 min)和1(31.5 mg,AQ 4.6×300 mm,1 mL/min,甲醇-水,20∶80,tR=3.274 min)。Fr.C1.3(甲醇-水,70∶30→80∶20,45.2 mg)经半制备HPLC分离到化合物14[1.1 mg,Agilent 9.4×250 mm,2 mL/min,乙腈-水(含0.05% TFA),60∶40,tR=26.231 min]。Fr.C1.4(甲醇-水,80∶1,60.5 mg)经Sephadex LH-20凝胶柱色谱(甲醇)、硅胶柱色谱(二氯甲烷-甲醇,20∶1)和半制备HPLC分离到化合物13(1.9 mg,Agilent 9.4×250 mm,2 mL/min,甲醇-水,70∶30,tR=17.955min)。Fr.C1.5(甲醇-水,100∶0,1.47 g)硅胶柱色谱(石油醚-乙酸乙酯,50∶1)和半制备HPLC分离到化合物11(3.0 mg,tR=28.490 min)和12(8.4 mg,Agilent 9.4×250 mm,2 mL/min,甲醇,tR=33.028 min)。Fr.C2部分(乙酸乙酯-甲醇,20∶1,6.7 g)经反相C18硅胶中压柱色谱(甲醇-水,20∶80→30∶70),硅胶柱色谱(乙酸乙酯-甲醇-水,500∶10∶1)和半制备HPLC分离得到化合物16(1.0 mg,tR=21.408 min),19(5.6 mg,tR=25.382 min),17(3.0 mg,tR=28.107 min)(AQ 4.6×300 mm,1 mL/min,甲醇-水,25∶75);18(15.4 mg,AQ 4.6×300 mm,1 mL/min,甲醇-水,30∶70,tR=19.691 min)。
2.2 细胞毒抑制活性
本实验采用MTS[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium]检测法测定青紫葛块根提取物与化合物的细胞毒活性,两点法(Reed and Muench method)计算化合物的IC50值,具体方法参见文献[9]。

图1 青紫葛块根中化合物1~19结构
3 结果
3.1 结构鉴定
从青紫葛块根乙醇提取物的乙酸乙酯和正丁醇部位分离到19个化合物,化合物的结构通过波谱数据推断并与文献中的波谱数据对比进行确定。对于化合物1,在一份专利中进行了如下报道:该化合物“失去一个电子的正离子,可能是岩白菜素在大鼠体内的代谢产物,在电子轰击作用下产生的二级碎片离子”[10],但其波谱数据并未见报道。本文对化合物1的结构进行解析,并对其波谱数据进行补充。19个化合物的结构见图1。
化合物1的高分辨质谱(HR-ESI-MS)显示了其准分子离子峰369.079 3[M + Na]+,推测其分子式为C14H18O10。其1H NMR谱显示了一个单峰在δH6.46(1H,s),推测该化合物结构中存在一个五取代的苯环;一个单峰在δH3.71(3H,s),推测其为甲氧基信号。1H NMR显示存在糖片段以及端头氢δH4.66,根据HSQC相关与端头氢相连的碳为δC79.2,与O-糖苷相比向高场位移,因此该片段为C-糖苷[11];根据葡萄糖H-1′与H-2′的偶合常数为9.7 Hz,推测其为β-葡萄糖[6]。13C NMR(表1)数据显示该化合物具有1个甲氧基信号在δC61.6,5取代苯环碳信号在δC108~149.9,以及羰基(C-7)信号在δC177.9。根据HMBC相关(图2),可以看出从H-6到C-7、C-1、C-2和C-5的相关,从H-1′到C-1、C-2、C-3和C-2′的相关确定了糖苷的连接位置。其结构最终通过HSQC,HMBC和COSY相关得以确认。基于以上数据,化合物1被鉴定为2-C-β-D-吡喃葡萄糖基-3,5-二羟基-4-甲氧基苯甲酸(2-C-β-D-glucopyranosyl-3,5-dihydroxy-4-methoxy-benzoic acid)。

表1 化合物1的1H和13C NMR数据(D2O,δ in ppm,J in Hz)
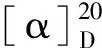

图2 化合物1 COSY(—)和HMBC(→)相关

化合物3棕色固体;1H NMR(500 MHz,CD3OD)δ:6.18(1H,d,J= 2.3 Hz,H-3),5.95(1H,d,J= 2.3 Hz,H-5),5.03(1H,d,J= 7.8 Hz,H-1"),3.92(1H,dd,J= 12.1,2.1 Hz,H-6"),3.72(1H,dd,J= 12.1,5.7 Hz,H-6"),3.54(1H,dd,J= 8.9,7.9 Hz,H-2"),3.48(1H,t,J= 8.9 Hz,H-3"),3.45(1H,m,H-5"),3.40(1H,t,J= 10 Hz,H-4"),3.18(1H,dd,J= 15.8,6.3 Hz,H-2′),2.88(1H,dd,J= 15.8,7.5 Hz,H-2′),2.23(1H,tt,J= 13.2,6.6 Hz,H-3′),0.97(1H,d,J= 6.6 Hz,H-5′),0.93(1H,d,J= 6.7 Hz,H-4′);13C NMR(125 MHz,CD3OD)δ:207.2(C-1′),167.6(C-6),165.8(C-4),162.2(C-2),107.0(C-1),101.9(C-1"),98.3(C-5),95.3(C-3),78.6(C-3"),78.4(C-5"),74.8(C-2"),71.2(C-4"),62.4(C-6"),54.2(C-2′),26.2(C-3′),23.4(C-5′),22.9(C-4′)。ESI-MSm/z395[M + Na]+。以上数据与文献[13]报道基本一致,故鉴定为2-O-β-D-吡喃葡萄糖基氧基-4,6-二羟基异丁基苯基酮。
化合物4白色块状晶体(甲醇);1H NMR(500 MHz,CD3OD)δ:7.03(1H,s,H-7),4.91(1H,d,J= 10.5 Hz,H-10b),4.03(1H,d,J= 9.7 Hz,H-4a),3.99(1H,d,J= 12.1 Hz,H-4),3.86(3H,s,OCH3),3.77(1H,t,J= 9.0 Hz,H-2),3.64(2H,m,H-11),3.40(1H,t,J= 9.0 Hz,H-3);13C NMR(125 MHz,CD3OD)δ:165.8(C-6),152.3(C-8),149.4(C-10),142.2(C-9),119.4(C-6a),117.2(C-10a),111.0(C-7),83.0(C-2),81.4(C-4a),75.6(C-4),74.2(C-10b),71.8(C-3),62.6(C-11),60.9(OCH3)。以上波谱数据,与文献[14]数据基本一致,故鉴定为岩白菜素。
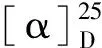
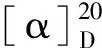
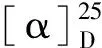
化合物8白色固体;1H NMR(500 MHz,CD3OD)δ:7.35(2H,d,J= 8.6 Hz,H-2′,6′),6.96(1H,d,J= 16.3 Hz,H-7),6.80(1H,d,J= 16.3 Hz,H-7′),6.76(2H,m,H-3′,5′),6.44(2H,d,J= 2.1 Hz,H-2,6),6.16(1H,t,J= 2.1 Hz,H-4);13C NMR(125 MHz,CD3OD)δ:159.6(C-3,5),158.4(C-4′),141.3(C-1),130.4(C-1′),129.4(C-7),128.8(C-2′,6′),127.0(C-7′),116.5(C-3′,5′),105.7(C-2,6),102.6(C-4)。以上数据与文献[17]报道基本一致,故鉴定为(E)-白藜芦醇。
化合物9白色粉末;1H NMR(500 MHz,CD3OD)δ:6.98(1H,d,J= 8.2 Hz,H-5),6.85(1H,d,J= 2.0 Hz,H-2),6.73(1H,dd,J= 8.2,2.0 Hz,H-6),4.15(1H,m,H-2′),3.83(3H,s,OCH3),3.74(4H,m,H-1′,H-3′),3.55(2H,t,J= 6.5 Hz,H-9),2.62(2H,m,H-7),1.81(2H,m,H-8);13C NMR(125 MHz,CD3OD)δ:151.9(C-3),146.8(C-4),138.3(C-1),121.9(C-6),119.4(C-5),114.0(C-2),83.2(C-2′),62.2(C-9),62.0(C-1′,3′),56.4(OCH3),35.6(C-8),32.7(C-7)。以上数据与文献[18]报道基本一致,故鉴定为4-O-(2-羟基-1-羟甲基乙基)-二氢松柏醇。
化合物10白色粉末;1H NMR(500 MHz,CDCl3)δ:5.68(1H,m,H-23),5.52(1H,d,J= 15.8 Hz,H-24),3.28(1H,m,H-3),2.22(1H,m,H-22),1.97(1H,m,H-11),1.90(1H,m,H-16),1.76(2H,m,H-2,22),1.58(6H,m,H-1,2,6,12,17),1.48(2H,m,H-8,20),1.34(6H,s,H-26,27),1.30(2H,m,H-7,15),1.28(3H,m,H-5,15,16),1.23(1H,m,H-1),1.11(1H,m,H-11),1.04(2H,m,H-7),0.97(3H,s,H-18),0.96(3H,s,H-29),0.88(3H,s,H-30),0.86(3H,s,H-21),0.80(3H,s,H-28),0.80(1H,m,H-6),0.55(1H,d,J= 4.1 Hz,H-19),0.33(1H,d,J= 4.2 Hz,H-19);13C NMR(125 MHz,CDCl3)δ:134.6(C-24),130.9(C-23),82.4(C-25),79.0(C-3),52.2(C-17),49.0(C-14),48.1(C-8),47.2(C-5),45.4(C-13),40.6(C-4),39.5(C-22),36.4(C-20),35.7(C-15),32.9(C-12),32.1(C-1),30.5(C-2),30.0(C-19),28.2(C-16),26.5(C-11),26.2(C-10),26.1(C-7),25.6(C-28),24.5(C-27),24.5(C-27),21.2(C-6),20.1(C-9),19.4(C-30),18.5(C-21),18.2(C-18),14.1(C-29)。以上数据与文献[19]报道基本一致,故鉴定为25-过氧羟基环阿尔廷-23-烯-3β-醇。
化合物11白色粉末;1H NMR(500 MHz,CDCl3)δ:4.68(1H,d,J= 2.4 Hz,H-29a),4.56(1H,dd,J= 2.5,1.4 Hz,H-29b),3.18(1H,m,H-3),2.37(1H,m,H-19),1.68,1.68,1.03,0.96,0.83,0.78,0.76(each 3H,s,H-23,24,25,26,27,28,and 30);13C NMR(125 MHz,CDCl3)δ:151.2(C-20),109.5(C-30),79.2(C-3),55.4(C-5),50.6(C-9),48.4(C-19),48.1(C-18),43.2(C-17),43.0(C-14),41.0(C-8),40.2(C-22),39.0(C-4),38.8(C-1),38.2(C-13),37.3(C-10),35.7(C-16),34.4(C-7),30.0(C-21),28.1(C-23),27.6(C-15),27.6(C-2),25.3(C-12),21.1(C-11),19.5(C-29),18.5(C-6),18.2(C-28),16.3(C-25),16.1(C-26),15.5(C-24),14.7(C-27)。以上数据与文献[7]报道基本一致,故鉴定为羽扇豆醇。
化合物12白色粉末;1H NMR(500 MHz,CDCl3)δ:3.22(1H,m),1.15,1.00,0.98,0.93,0.76,0.69(each 3H,s),0.85(6H,s);13C NMR(125 MHz,CDCl3)δ:134.5(C-13),133.3(C-18),79.2(C-3),55.5(C-5),50.9(C-9),44.8(C-14),41.2(C-8),39.5(C-19),39.0(C-1,4),38.8(C-22),37.4(C-10),36.8(C-16),35.6(C-21),35.0(C-7),34.7(C-17),33.5(C-20),32.5(C-30),28.2(C-24),27.5(C-2),26.6(C-12),25.2(C-15),24.2(C-28),23.9(C-29),21.9(C-11),21.5(C-27),18.6(C-6),17.8(C-23),16.5(C-26),15.6(C-25)。以上数据与文献[20]报道基本一致,故鉴定为δ-香树精。


化合物15白色固体;1H NMR(800 MHz,CD3OD)δ:5.98(1H,d,J= 15.6 Hz,H-7),5.87(1H,s,H-4),5.73(1H,dd,J= 15.6,7.3 Hz,H-8),4.54(1H,dd,J= 13.1,6.6 Hz,H-9),4.27(1H,d,J= 7.9 Hz,H-1′),3.85(1H,dd,J= 11.9,2.2 Hz,H-6′),3.63(1H,dd,J= 11.9,6.2 Hz,H-6′),3.28(1H,t,J= 8.9 Hz,H-3′),3.24(1H,t,J= 9.2 Hz,H-4′),3.21~3.17(1H,m,H-2′),3.16-3.12(1H,m,H-5′),2.61(1H,d,J= 16.7 Hz,H-2),2.17(1H,d,J= 17.1 Hz,H-2),1.94(3H,d,J= 1.2 Hz,5-Me),1.29(3H,d,J= 6.5 Hz,9-Me),1.04(3H,s,gem-Me),1.02(3H,s,gem-Me);13C NMR(200 MHz,CD3OD)δ:201.3(C-3),167.1(C-5),133.8(C-7),133.7(C-8),127.1(C-4),101.2(C-1′),78.4(C-3′),78.2(C-5′),75.0(C-2′),74.6(C-9),71.7(C-4′),62.8(C-6′),50.8(C-2),42.4(C-1),24.7(1-Me),23.5(1-Me),22.2(9-Me),19.6(5-Me)。以上数据与文献[23]基本一致,故鉴定为(6R,9S)-roseoside。
化合物16白色固体;1H NMR(800 MHz,CD3OD)δ:6.57(1H,s,H-8),6.38(2H,s,H-2′,6′),4.30(1H,m,H-4),4.24(1H,d,J= 7.8 Hz,H-1"),3.93(1H,dd,J= 10.0,5.7 Hz,H-2a),3.85(3H,s,7-OMe),3.84(1H,m,H-6"),3.73(6H,s,H-3′,5′-OMe),3.66(1H,m,H-6"),3.55(2H,m,H-2a,3a),3.31(3H,s,5-OMe),3.25(3H,m,H-3",4",5"),3.16(1H,dd,J= 9.2,7.9 Hz,H-2"),2.78(1H,dd,J= 15.1,4.4 Hz,H-1),2.57(1H,dd,J= 15.0,11.5 Hz,H-1),1.88(1H,m,H-3),1.83(1H,m,H-2);13C NMR(200 MHz,CD3OD)δ:149.0(C-3′,5′),148.6(C-7),147.7(C-5),139.6(C-4′),138.9(C-6),134.5(C-1′),130.0(C-9),126.5(C-10),107.7(C-8),107.0(C-2′,6′),104.6(C-1"),78.1(C-3"),78.0(C-5"),75.2(C-2"),74.9(C-2a),71.7(C-4"),63.2(C-3a),62.8(C-6"),59.9(5-OMe),56.8(3′,5′-OMe),56.6(7-OMe),50.1(C-3),42.8(C-4),38.2(C-2),34.1(C-1)。以上数据与文献[24]基本一致,故鉴定为(-)-南烛木树脂酚-2a-O-β-D-吡喃葡萄糖苷。

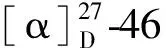

3.2 细胞毒活性测试结果
测试了青紫葛块根乙醇提取物、石油醚、乙酸乙酯、正丁醇萃取部位对人白血病HL-60细胞株、人肝癌SMMC-7721细胞株、人肺腺癌A549细胞株、人乳腺癌MCF-7细胞株、人结肠癌SW480细胞株等 5株肿瘤细胞的体外细胞毒活性。结果表明,青紫葛块根的乙醇提取物对SMMC-7721、A549和MCF-7细胞株均无抑制活性;其乙醇提取物,石油醚部位和乙酸乙酯部位对人结肠癌SW480细胞株具有一定的抑制活性;在浓度为100 μg/mL,乙醇提取物对细胞株HL-60具有微弱的抑制活性,抑制率为45.43%±1.17%,乙酸乙酯部位对细胞株SW480具有微弱的抑制活性,抑制率为49.30%±0.34%;正丁醇部位对细胞株HL-60和SW480都具中度的抑制活性(表2)。将分离得到的19个化合物开展细胞株HL-60和SW480细胞毒活性测试,发现只有25-过氧羟基环阿尔廷-23-烯-3β-醇(10)对人白血病HL-60细胞株和人结肠癌SW480细胞株具有较好的抑制活性。具体活性结果见表2。

表2 青紫葛提取物、萃取部位和化合物10对细胞株HL-60和SW480的抑制活性
注:a为阳性对照,化合物1~9和11~19对这两株细胞均无抑制活性
Note:aPositive control,compounds1-9and11-19were inactive.
4 讨论与结论
本文对青紫葛块根乙醇提取物的乙酸乙酯部分和正丁醇部分进行化学成分的研究,从乙酸乙酯部位分离到7个化合物,从正丁醇部位分离到12个化合物,共分离到19个化合物。化合物1~4,13和14为酚类,5和8为二苯乙烯类,6和7为黄烷醇,9为苯丙素,10~12为三萜类,15是倍半萜苷,16~19为木脂素糖苷。其中有15个化合物为从该属植物中首次分离,它们是1~3、5~7、9、10、13~19,化合物1~3、5、7、9、10、13~17、19这13个化合物首次从该科植物中分离得到。对分离到的所有化合物测试了对人白血病HL-60细胞和人结肠癌SW480细胞的生长抑制活性(细胞毒活性),结果显示化合物10对人白血病HL-60细胞株和人结肠癌SW480细胞株均具有较好的抑制活性,IC50值分别为13.0和21.1 μM。
通过Scifinder和谷歌学术数据库检索,发现化合物10对人肺腺癌A549细胞株、人卵巢癌SK-MEL-2细胞株和人结肠癌细胞株HCT15具有中度的抑制活性,ED50值分别为17.5、21.8和27.9 μM[20]。化合物10对人肺癌H460细胞株、人结肠腺癌HT-29细胞株、人慢性粒细胞白血病K562细胞等多种癌细胞的生长具有一定的抑制活性(GI50为28~38 μg/mL)[27]。另外,岩白菜素(4)[28]、(-)-表儿茶素(6)[29]、(E)-白藜芦醇(8)[30]、羽扇豆醇(11)[31]、(6R,9S)-roseoside(15)[32]和(-)-南烛木树脂酚-3a-O-β-D-吡喃葡萄糖苷(17)[31]对不同癌细胞也具有一定的细胞毒活性。
据文献报道,羽扇豆醇(11)[31]、(6R,9S)-roseoside(15)[32]、(-)-南烛木树脂酚-3a-O-β-D-吡喃葡萄糖苷(17)[32]、(+)-南烛木树脂酚-3a-O-β-D-吡喃葡萄糖苷(19)[32]对人白血病HL-60细胞株生长具有一定的抑制活性,而我们测试结果未发现抑制活性,其活性有待进一步研究验证。本文在一定程度上揭示了青紫葛作为抗肿瘤药物的物质基础,初步验证缅甸传统医药体系中将其作为抗肿瘤药物的合理性,然而其抗肿瘤的活性成分和机制有待进一步深入研究。

