混菌发酵鸭腿工艺优化及其贮藏品质特性
阮一凡,潘道东,,孙杨赢,田宏伟,汤晓艳
(1.宁波大学 浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315800;2.宁波大学食品与药学学院,浙江 宁波 315800;3.湖北周黑鸭企业发展有限公司,湖北 武汉 430040;4.中国农业科学院农业质量标准与检测技术研究所,农业农村部农产品质量安全重点实验室,北京 100081)
肉类发酵自古以来就作为肉类的保存方式,最早的记录可以追溯到公元前1 500年。随着时间的推移,不同的地理区域开发出了不同大小、形状、质地、外观和风味的独特肉类产品[1]。到19世纪中叶,人们认识到细菌、酵母和霉菌在发酵食品生产中的重要性,最终发酵过程才得到规范[2]。现在的发酵肉制品是通过益生菌发酵得到的具有独特风味、营养价值高、易消化、具有保健功效的一类产品[3],也因其具有水分活度低等优势,能很好地长期保藏。而且由于发酵肉制品中的微生物作用,能够把营养物质分解成小分子风味物质或者是易消化吸收的成分[4]。
鸭肉因其具有良好的口感和味道,广受消费者喜爱,同时鸭肉还具有低脂肪、低胆固醇等优点,在当今崇尚健康饮食消费中备受欢迎[5]。添加发酵剂与肉制品中,可以起到抑制有害菌生长、缩短生产周期、改善产品色泽及风味的作用,从而实现大规模生产[6]。国内外已有将发酵剂应用于食品提升产品品质的研究。张洵[7]使用植物乳杆菌、木糖葡萄球菌和酿酒酵母菌改良发酵鱼糜,得到的产品具有良好的理化性质、质构和风味;Palavecino等[8]用清酒乳杆菌分别与小牛葡萄球菌和木糖葡萄球菌混合,制作出两组香肠进行比较,发现两组香肠的硫代巴比妥酸(thiobarbituric acid reactive substances,TBARS)值都不同程度显著低于未接菌组。说明选择正确的发酵剂添加到肉中,会对肉的感官风味品质、安全性能等都有很大的帮助。
发酵肉制品在贮藏过程中,由于受到原料质量、pH值、微生物、酶、温度、湿度和时间等因素的影响,也存在一些潜在的安全隐患,比如亚硝酸盐和生物胺的积累,在适宜条件下会形成致癌物亚硝基化合物[9];虽然脂肪氧化有益于风味的产生,但是过度的氧化会产生毒素,危害人体健康,而且一般发酵肉制品都具有较高的脂肪含量,所以也极易发生脂肪过度氧化[10];最后还有病原菌和霉菌毒素的产生等[11],它们既会影响产品的营养价值,更重要的是会危害到人体健康。谭李红等[12]研究发现戊糖片球菌和木糖葡萄球菌复合发酵能够降低发酵香肠中生物胺含量;胡永金[13]研究发现当植物乳杆菌、木糖葡萄球菌和干酪乳杆菌接种比例为1∶1∶1时,加入鱼糜中可有效抑制肠道菌等杂菌及致病菌的生长繁殖,降低生物胺和挥发性盐基氮(total volatile base nitrogen,TVB-N)累积,提高发酵制品的生物安全性。所以发酵剂的使用可以有效延长发酵肉制品的贮藏期,提高安全品质。
本研究以鸭腿肉为原料,通过对接菌量、菌种配比、发酵温度和发酵时间4 个因素进行发酵鸭腿的单因素试验和正交试验,确定其最佳工艺配比,并对终产品的大肠杆菌、过氧化值、亚硝酸盐和组胺含量进行测定,确定其安全性。然后对发酵鸭腿成品贮藏过程中感官评价、菌落总数、亚硝酸盐含量、TBARS值、TVB-N值及生物胺的变化进行测定,以期为发酵鸭腿产品贮藏品质变化提供参考及理论依据。
1 材料与方法
1.1 材料与试剂
樱桃谷鸭腿、香辛料及辅料为当地市售;植物乳杆菌、酿酒酵母菌为实验室保藏菌株。
亚硝酸盐、抗坏血酸、葡萄糖(均为食品级)宁波航景生物科技有限公司;MRS培养基、酵母膏胨葡萄糖(yeast peptone dextrose,YPD)琼脂培养基、平板计数琼脂(plate count agar,PCA)培养基 青岛高科园海博生物技术有限公司;丹磺酰氯、色胺、苯乙胺等生物胺标准品 美国Sigma公司;甲醇、乙腈、丙酮均为色谱纯;氯仿、高氯酸、碳酸氢钠、氢氧化钠、氨水等均为分析纯;真空包装袋(70 mm×100 mm,厚度0.08 mm) 中国广东佛山市双福包装有限公司。
1.2 仪器与设备
Infinite 200 pro全波长扫描多功能酶标仪 瑞士帝肯公司;1260高效液相色谱仪 美国安捷伦公司;SW-CJ-2FD型双人单面净化工作台 江苏苏州净化设制有限公司;QHZ-12A组合式恒温振荡培养箱 太仓市华美生化仪器厂;H1850R冷冻离心机 湘仪离心机仪器有限公司;HSW型智能恒温恒湿培养箱 浙江宁波江南仪器厂;XHF-D高速分散器 浙江宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 发酵鸭腿的制作工艺
1.3.1.1 发酵剂制备
活化好的植物乳杆菌取1%接入MRS肉汤中,于37 ℃静置培养18 h;酿酒酵母菌接种环挑出单菌落,接入YPD培养基,30 ℃、150 r/min培养24 h后,取出菌液按所需比例混合,8 000 r/min、4 ℃高速冷冻离心10 min后用无菌生理盐水洗涤,重复3 次,收集菌体,最后用无菌生理盐水稀释得到所需液体发酵剂。
1.3.1.2 生产配方
参考王萍萍等[14]方法,稍作修改。按1 kg肉质量计,食盐1.5%,亚硝酸钠0.010%,抗坏血酸0.08%,蔗糖1.5%,葡萄糖1%,味精0.2%,白胡椒粉0.08%,料酒4.0%,花椒0.15%,洋葱粉0.2%,生抽6.5%。
1.3.1.3 工艺流程及主要步骤
工艺流程:原料鸭腿→腌制料→4 ℃、24 h冷藏腌制→添加发酵剂→发酵→煮制→真空包装→杀菌→成品。
步骤:原料鸭腿:从市场挑选刚宰后新鲜鸭腿(均质量约为250 g),洗净血水,用刀背轻敲并且割开几个小口,方便调料入味;腌制:按1.3.1.2节配方依次加入辅料与肉混匀,于4 ℃冷藏腌制24 h;添加发酵剂:将接种量为106CFU/g的发酵剂与腌制好的肉混匀;发酵:将混匀好的鸭腿吊挂在恒温恒湿培养箱内,在一定的发酵温度和发酵时间条件下,相对湿度50%;蒸制:将发酵好的鸭腿于沸水上方蒸制30~35 min,即得到发酵鸭腿成品;包装:待冷却后进行真空包装;贮藏:成品于常温(20 ℃左右)贮藏。
1.3.2 单因素试验设计
1.3.2.1 接菌量对发酵鸭腿品质的影响
接菌量分别为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%,菌种配比1∶1的植物乳杆菌-酿酒酵母菌加入肉料中,发酵温度30 ℃,发酵时间18 h。测定成品的感官评分和pH值。
1.3.2.2 发酵剂菌种配比对发酵鸭腿品质的影响
接菌量选取1.3.2.1节最佳条件,植物乳杆菌-酿酒酵母菌菌种配比分别为1∶1、1∶2、1∶3、2∶3、3∶2、2∶1进行接种,发酵温度30 ℃,发酵时间18 h。测定成品的感官评分和pH值。
1.3.2.3 发酵温度对发酵鸭腿品质的影响
接菌量选取1.3.2.1节最佳条件,植物乳杆菌-酿酒酵母菌菌种配比选取1.3.2.2节最佳条件加入肉料中,发酵温度分别为24、27、30、33、36、39 ℃,发酵时间18 h。测定成品的感官评分和pH值。
1.3.2.4 发酵时间对发酵鸭腿品质的影响
接菌量、发酵剂菌种配比和发酵温度均选取上述最优条件,发酵时间分别为6、12、18、24、30、36 h。测定成品的感官评分和pH值。
1.3.3 正交试验设计
在单因素试验结果基础上,以感官评分和pH值为检测指标进行优化。
1.3.4 感官评定
邀请10 名消费者(固定)参照GB 5009.44—2003《肉与肉制品卫生标准分析方法》[15],对发酵鸭腿产品的颜色、黏度、弹性、气味进行评价,以能否检测出感官的不可接受为最低标准,确定产品感官可接受性。感官评分标准如表1所示。
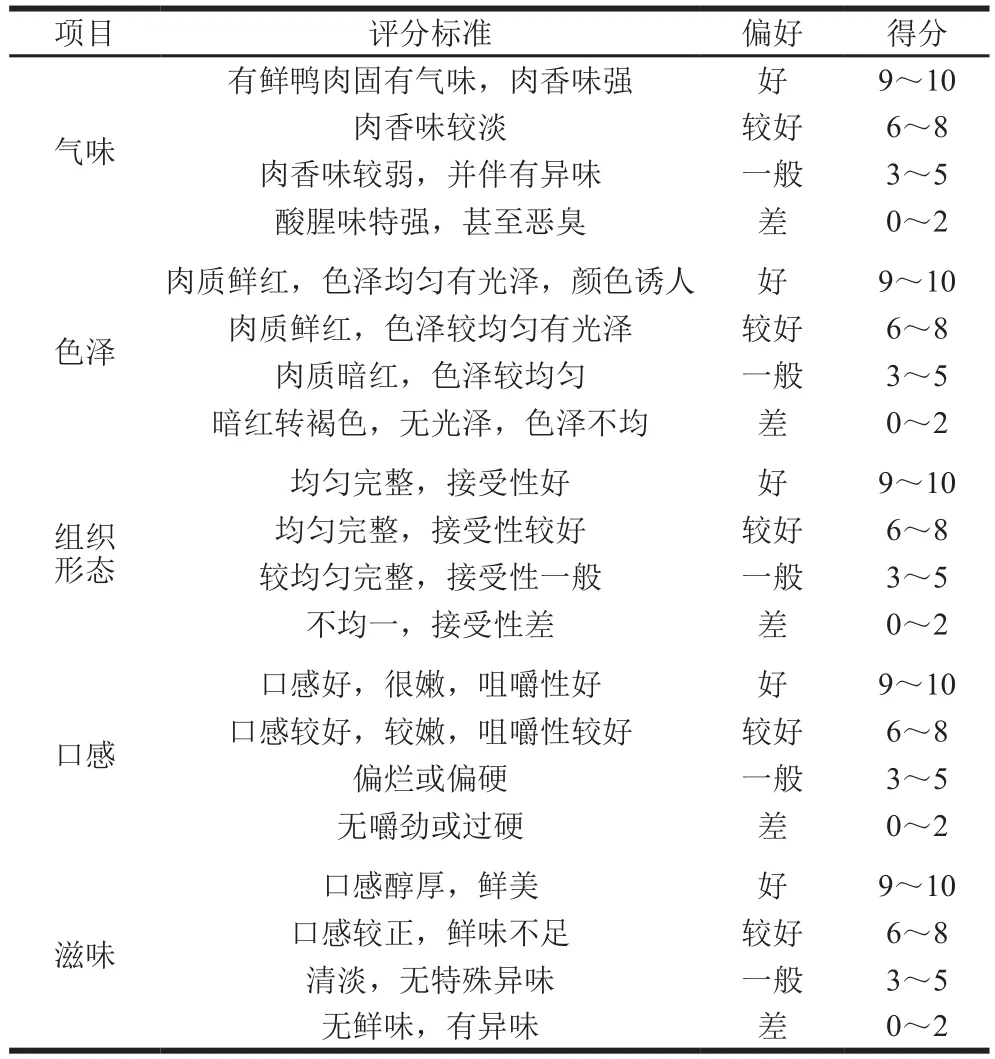
表1 感官评分标准Table 1 Sensory scoring criteria
1.3.5 pH值的测定
参照Aro等[16]的方法,略有修改。取10 g样品剪碎,加入90 mL蒸馏水,匀浆6×10 s,过滤,用pH计测定滤液的pH值。
1.3.6 终产品理化指标测定
1.3.6.1 大肠杆菌的测定
参照GB 4789.38—2012《食品微生物学检验 大肠埃希氏菌计数》[17]方法进行测定。
1.3.6.2 亚硝酸盐的测定
按南京建成生物研究所试剂盒的方法进行测定。
1.3.6.3 过氧化值的测定
参照GB/T 5009.227—2016《食品中过氧化值的测定》[18]方法进行测定。
1.3.6.4 组胺的测定
参考白婷[4]的方法进行测定:超声处理(功率300 W,温度45 ℃)2 min,6 000 r/min离心5 min。取1.0 mL盐酸提取液,置于10 mL离心管中,再加入1 mL水后加氢氧化钠溶液呈碱性;后续方法采用GB/T 5009.45—2003《水产品卫生标准分析方法》[19]进行测定。
1.3.7 贮藏期指标测定
1.3.7.1 菌落总数的测定
参照GB 4789.2—2010《食品微生物学检验 菌落总数测定》[20]的方法进行测定。
1.3.7.2 TBARS值的测定
参照Witte等[21]的方法,略有修改。取10 g鸭腿肉绞碎,向里加入50 mL 7.5%的三氯乙酸(含0.1%乙二胺四乙酸),在冰浴中以10 000 r/min匀浆6×10 s,然后过滤。取5 mL上清液,加入5 mL 0.02 mo1/L TBARS溶液,于沸水浴中保温40 min,取出冷却后再以5 000 r/min离心5 min,上清液取出后加入等体积氯仿混匀,静置分层后,吸取上层清液,分别测定在532 nm和600 nm波长处的吸光度(A),并按下式计算TBARS值:

1.3.7.3 TVB-N值的测定
参考GB/T 5009.44—2003[15]的方法对各组鸭肉样品中的TVB-N含量进行测定。
1.3.7.4 生物胺的测定
参照Tasić等[22]和朱志远[23]的方法,并稍作修改。
标准溶液的配制:将色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺标准品制成1 mg/mL储备液备用。用0.4 mol/L高氯酸溶液将以上标准品储备液配成终质量浓度分别为0.5、1.0、2.0、5.0、10、20、50 μg/mL的混合标准溶液。铝箔避光、-20 ℃冰箱保存。
样品处理:取5 g绞碎肉样加入20 mL的0.4 mol/L高氯酸溶液,冰浴匀浆,5 000 r/min、4 ℃离心10 min取上清液,沉淀用上述方法再提取1 次。合并2 次提取的上清液用0.4 mol/L高氯酸溶液定容到50 mL。
标准溶液和样品的衍生化:取1 mL的混合标准溶液,加入200 μL 2 mol/L NaOH溶液使之呈碱性,接着加入300 μL饱和NaHCO3溶液进行缓冲,然后加入2 mL的丹磺酰氯溶液(10 mg/mL,溶剂为色谱级丙酮,现配现用),于40 ℃水浴中暗以应处理30 min后加入100 μL的氨水中止以应,去除残留的丹磺酰氯溶液。最后用乙腈定容至5 mL,0.22 μm有机滤膜过滤,用于分析检测。取1 mL的样液如标准溶液进行柱前衍生。
色谱条件:Agilent ZORBAX XDB-C18以相色谱柱(4.6 mm×250 mm,5 μm),柱温40 ℃,流速1.0 mL/min,进样体积20 μL,紫外检测波长254 nm;流动相:水(A相)、乙腈(B相)、0.1 mol/L乙酸铵(C相);洗脱程序见表2。

表2 梯度洗脱程序Table 2 Gradient elution program
1.4 数据处理与统计分析
采用SPSS 21软件对数据进行单因素方差及显著性分析(Duncan多重比较),统计学显著水平设定为0.05,用Origin 8.1软件作图,每组实验重复3 次。
2 结果与分析
2.1 单因素试验结果
2.1.1 接菌量的选择

图1 接菌量对发酵鸭腿品质的影响Fig. 1 Effect of inoculum amount on the quality of fermented duck thigh
由图1可看出,随着接菌量的增加,发酵鸭腿的感官评分值呈现先增大后减小的趋势,pH值则逐渐下降,在接菌量2%和2.5%时差异不显著(P>0.05)。在接菌量为2%时,达到最大值82 分。原因可能是随着发酵剂的量增多,经发酵产生的风味化合物增多,使发酵鸭腿口感品质较好。但添加过多的发酵剂后,其发酵剂发酵产物,比如乳酸产生过多,导致产品pH值过低,影响产品接受度。综合感官评分和pH值,选择接菌量2%为最适条件。
2.1.2 发酵剂菌种配比的选择
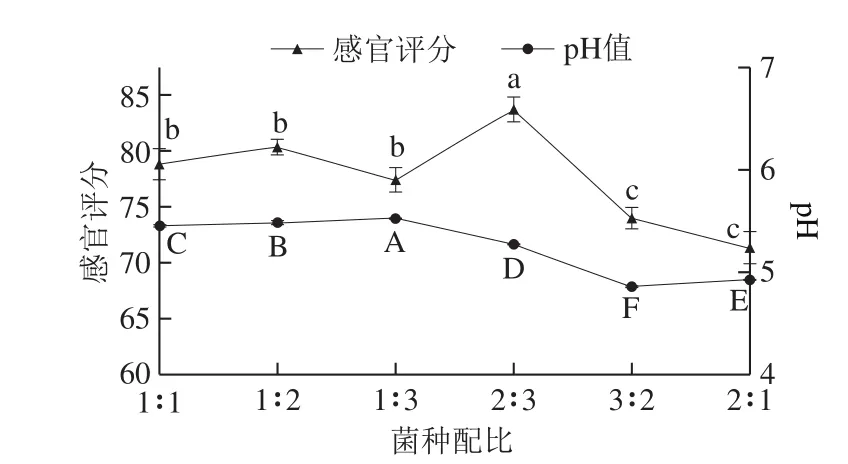
图2 菌种配比对发酵鸭腿品质的影响Fig. 2 Effect of inoculum composition on the quality of fermented duck thigh
由图2可知,当植物乳杆菌比例不变,随着酿酒酵母菌比例的增加,感官评分变化不显著,pH值逐渐上升。当比例为2∶3时,感官评分最高为83 分,说明植物乳杆菌对于感官评分的影响较大,而此时产品pH值为5.27。而当比例为3∶2时,感官评分下降,可能是因为乳酸菌过多,产生乳酸降低了pH值,影响口感,而此时pH值最低为4.75。所以选择菌种配比2∶3为最佳。
2.1.3 发酵温度的选择

图3 发酵温度对发酵鸭腿品质的影响Fig. 3 Effect of fermentation temperature on the quality of fermented duck thigh
由图3可知,随着发酵温度的升高,发酵鸭腿的感官评分呈现先升高后降低的变化趋势,pH值逐渐降低,因为温度越高,发酵会越快,pH值降低越显著。随着温度缓慢升高,感官评分的变化不显著,当温度在33 ℃时达到最大,然后开始下降,可能是因为发酵温度升高,加速了脂肪的氧化,油脂味重影响口感。所以选取发酵温度33 ℃为最适条件。
2.1.4 发酵时间的选择

图4 发酵时间对发酵鸭腿品质的影响Fig. 4 Effect of fermentation time on the quality of fermented duck thigh
由图4可知,随着发酵时间的不断延长,前期感官评分上升趋势快,在12~18 h期间差异不显著,而后在第24小时感官评分达到最大值,然后随着时间的延长缓慢下降,差异不显著。而pH值在6~12 h和18~24 h差异不显著(P>0.05),后期随着时间的延长则逐渐减少。可能的原因是前期发酵时间太短导致发酵不彻底,没有形成很好的风味。随着发酵时间的延长,乳酸菌与酵母菌相互作用,产生良好的风味物质。但时间过长也可能造成乳酸的积累导致风味不佳,后续感官评分逐渐下降。所以,选取发酵时间24 h为最适条件。
2.2 正交试验结果
在单因素试验基础上,根据Minitab17.0数据处理系统中的L9(34)正交试验设计方法,以菌种配比(A)、发酵温度(B)、接菌量(C)、发酵时间(D)作为4 个考察因素,选取3 个水平进行试验并对结果进行极差分析,以确定最佳工艺条件。

表3 正交试验设计及结果Table 3 Orthogonal array design in terms of coded and actual data with experimental results
由表3可知,感官评分最优水平为A3B2C3D2;而低pH值有利于产品保存,所以最优水平为A3B2C3D3。感官评分4 个因素的影响主次顺序为:接菌量(C)>发酵温度(B)>菌种配比(A)>发酵时间(D),说明接菌量作用最大;而pH值4 个因素的影响主次顺序为:接菌量(C)>发酵温度(B)>发酵时间(D)>菌种配比(A),也说明混合发酵剂的接菌量直接影响产品的pH值。选择表3中感官评分最高和pH值较小的A2B2C3D1与上述A3B2C3D2和A3B2C3D3进行验证实验,结果表4所示。

表4 验证实验结果Table 4 Results of validation experiments
由表4可知,A3B2C3D2感官评分最高,但与A2B2C3D1的差异不显著(P>0.05),而A2B2C3D1组的pH值虽高于A3B2C3D3,但高质量发酵产品pH值应控制在4.7~5.2之间[4],此时的发酵产品既有利于产品保存,又不会因为过酸影响口感。所以最后确定A2B2C3D1为最优工艺组合,即菌种(植物乳杆菌-酿酒酵母菌)配比1∶2、发酵温度30 ℃、接菌量2.0%、发酵时间24 h。
2.3 发酵鸭腿理化指标测定结果

表5 发酵鸭腿理化指标Table 5 Physicochemical indicators of fermented duck thigh
pH值是发酵肉制品的一个重要指标,高质量的发酵产品pH值应控制在4.7~5.2之间[4]。此时的产品才能达到抑制腐败菌生长,改善产品色泽、质构,降低亚硝酸盐残留量的效果,从而保证产品卫生质量稳定性[24]。由表5可知,此时接菌发酵的产品pH值为5.02,既满足了消费者对酸度的接受范围,也对产品的安全性有了保障。大肠杆菌作为判断发酵香肠安全性的重要指标之一,根据国家对发酵肉制品的要求是小于30 MPN/100 g,终产品中未检出大肠杆菌,因为发酵剂特别是乳酸菌的生长可以抑制致病菌的生成。过氧化值直接以映了脂肪氧化的程度,乳酸菌会生成乳酸从而降低pH值,当pH值小于7时,脂肪氧化的程度会随着pH值的升高而增强[25],所以终产品脂肪氧化程度低。亚硝酸盐作为腌制剂添加到肉中,但乳酸菌可以一定程度促进亚硝酸盐分解,降低其含量。组胺作为毒性最强的生物胺,一直在发酵肉制品中备受关注,因为发酵肉制品的蛋白含量普遍较高,随着加工和贮藏时间的延长,容易生成生物胺。由于发酵时间短,产品组胺没有检出。
2.4 贮藏期指标测定结果
2.4.1 发酵鸭腿贮藏过程中菌落总数的变化
菌落总数测定用来判定食品被细菌污染的程度及卫生质量,以映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价[26]。根据卫生标准:一级鲜肉,细菌总数≤104CFU/g;二级鲜肉,细菌总数≤106CFU/g;三级鲜肉,细菌总数≤107CFU/g;腐败肉,细菌总数>108CFU/g。
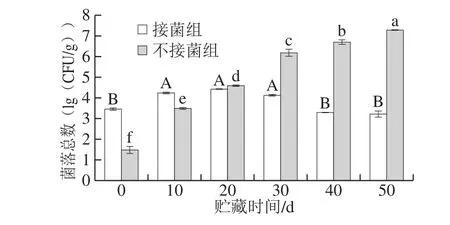
图5 发酵鸭腿贮藏过程中菌落总数的变化Fig. 5 Changes in total plate count during storage of fermented duck thigh
由图5可知,贮藏初期接菌组菌落总数为3.46(lg(CFU/g)),且接菌组数量明显高于对照组,这可能是因为同自然发酵相比,接种的发酵剂中含有植物乳杆菌及酿酒酵母菌。接菌组鸭腿的菌落总数在贮藏过程中呈现先增多后减少的趋势,从第0天的3.46(lg(CFU/g))上升到第20天的4.42(lg(CFU/g)),之后开始下降,到第50天为3.22(lg(CFU/g)),且40 d和50 d没有显著差异,可能是间隔时间短,菌落总数变化量不大。
贮藏初期,乳酸菌可以在真空环境中生长并可耐盐,逐渐成为优势菌群,成为平板菌落计数中的主要组成[27]。随着时间的延长,微生物彼此的竞争作用以及营养物质的消耗,导致微生物的生长繁殖受到抑制,表现为菌落总数的减少[28]。据报道,贮藏后期乳酸菌对有害杂菌的抑制效果更显著[29]。
2.4.2 发酵鸭腿贮藏过程中感官评分的变化
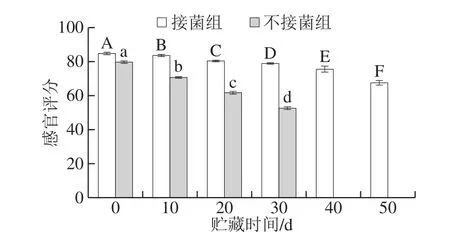
图6 发酵鸭腿贮藏过程中感官评分的变化Fig. 6 Changes in sensory score during storage of fermented duck thigh
由图6可知,第0天接菌组的感官评分为84.7,不接菌组的感官评分为79.66。在贮藏过程中接菌两组发酵鸭腿的产品感官评分逐渐降低,但是接菌发酵组的评分一直高于不接菌组。而且不接菌组的发酵鸭腿在第20天时感官评分为61.71,在第30天已经低于60 分,鸭肉已经散发出不好的腐败气味,从菌落总数指标也可以看出,在第30天时,不接菌组的菌落总数已经大于106CFU/g,所以这种不好闻的气息可能来源于微生物引起的质量劣变,影响了感官评分,后续没有对不接菌的鸭腿进行感官的评分。而接菌组在第50天感官评分仍为67.54。
2.4.3 发酵鸭腿贮藏过程中亚硝酸盐的变化
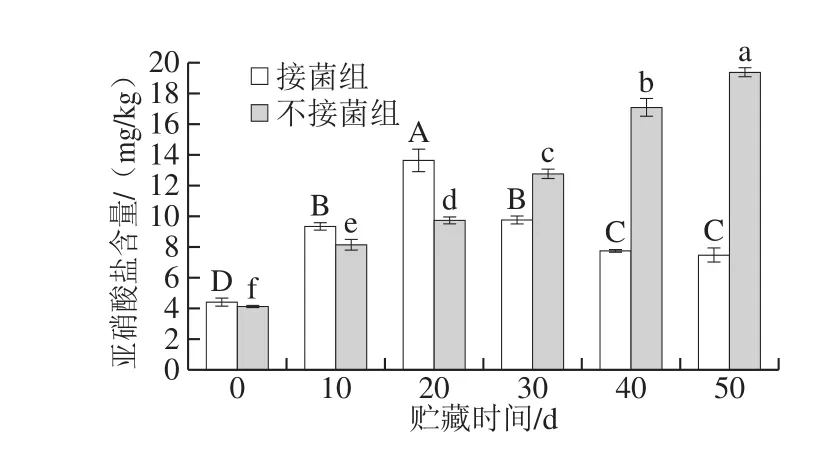
图7 发酵鸭腿贮藏过程中亚硝酸盐含量的变化Fig. 7 Changes in nitrite content during storage of fermented duck thigh
如图7所示,在贮藏期间发酵鸭腿的亚硝酸盐含量在第20天达到最大值,随后逐渐减少。而不接菌发酵鸭腿在贮藏过程中持续增加,但50 d内亚硝酸盐含量始终低于30 mg/kg,符合GB 2760—2014《食品添加剂使用标准》的规定。
在常温下,微生物活动活跃,以引起食物腐败的G+细胞(如肉毒核状芽孢杆菌、金黄色葡萄球菌等)腐败菌繁殖加快,产生毒素导致蛋白质易分解,蛋白质分解产生大量的胺类物质。此时形成的亚硝胺数量更多,从而不接菌组的亚硝酸盐含量会持续增加[30]。而接菌组中的乳杆菌逐渐成为优势菌群从而抑制腐败菌的生成,所以会抑制亚硝酸盐的生成。
2.4.4 发酵鸭腿贮藏过程中TBARS值的变化
TBARS值越大,脂肪氧化的程度越高,产生的小分子物质如酮、醛、酸类等物质越多,因而产品的腐败越严重[31]。产品中TBARS值在0.5~1.0 mg/kg时不会产生腐败气味,小于1.0 mg/kg的产品是可以接受的[32]。据报道[33],TBARS值达到1~2 mg/kg以上就已腐败变质。

图8 发酵鸭腿贮藏过程中TBARS值的变化Fig. 8 Changes in thiobarbituric acid content during storage of fermented duck thigh
由图8可知,随着贮藏时间的延长,接菌组发酵鸭腿的TBARS值从初始的0.49 mg/kg逐渐增加至第50天的0.63 mg/kg,增长的幅度较小,可能是真空环境以及发酵鸭腿在制作过程中使用亚硝酸盐、异抗坏血酸钠和发酵剂的共同作用。而且因为植物乳杆菌可以产生乳酸,导致pH值的下降,抑制脂肪的氧化,所以接菌处理对TBARS具有抑制作用。与本实验相似的研究结果也表明,成熟风干香肠在长期真空贮藏(7 个月)期间,TBARS值只略有上升[34]。而不接菌组从初始的0.65 mg/kg到1.27 mg/kg,在第30天的含量已经高达0.85 mg/kg,说明接种发酵剂可显著影响并延缓发酵鸭腿的脂质氧化。
2.4.5 发酵鸭腿贮藏过程中TVB-N值的变化
肉品中TVB-N值随着贮藏时间的延长而增高[35]。TVB-N值小于15 mg/100 g为一级鲜度,在15~20 mg/100 g之间为二级鲜度,大于20 mg/100 g为变质肉[36]。
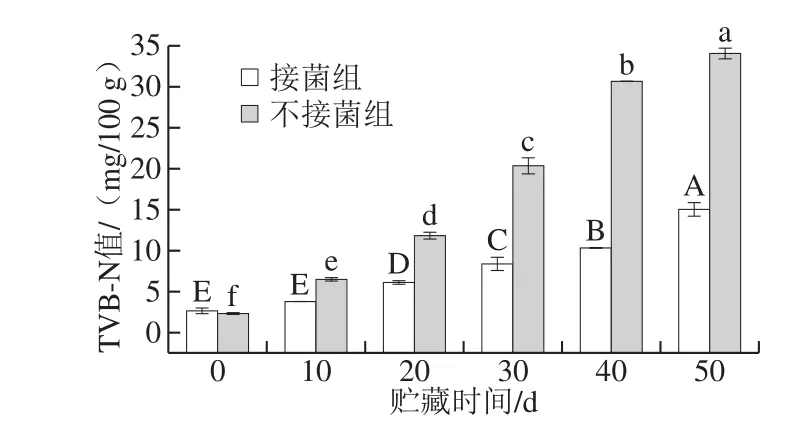
图9 发酵鸭腿贮藏过程中TVB-N值的变化Fig. 9 Changes in TVB-N content during storage of fermented duck thigh
由图9可知,接菌组发酵鸭腿TVB-N值从初始2.61 mg/100 g到50 d的14.98 mg/100 g,不接菌组从初始的2.30 mg/100 g到50 d的34.02 mg/100 g,TVB-N值在整个贮藏过程中持续增加,但接菌组中TVB-N值增加缓慢,且都低于15 mg/100 g。结果表明,接种混合发酵剂可有效抑制TVB-N的生成,提高发酵香肠的卫生质量。与Yang等[37]结果相似。同时Talon等[38]也发现乳酸菌可以通过降低pH值抑制杂菌和致病菌的生长,阻止杂菌利用游离氨基酸等含氮化合物产生挥发性含氮成分。
2.4.6 发酵鸭腿贮藏过程中生物胺含量的变化
在贮藏的前期,接菌组的生物胺含量大多高于不接菌组,这可能是因为生物胺是在微生物作用下由游离氨基酸作为前体物合成的,而且游离氨基酸作为营养物可促进微生物生长,其中就有生物胺形成菌,这些菌能直接加快生物胺的积累[39]。因此,游离氨基酸的存在与生物胺的积累呈正相关,这与之前游离氨基酸的测定结果吻合[4]。生物胺混标色谱见图10。
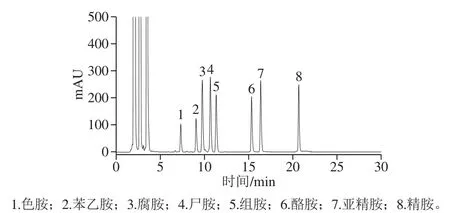
图10 生物胺混标色谱图Fig. 10 Chromatograms of mixed standard solution of biogenic amines
美国食品药品监督管理局规定食品中生物胺总量不得超过1 000 mg/kg,其中组胺含量≤50 mg/kg,酪胺含量≤100 mg/kg[40]。如表6所示,除尸胺外,其他接菌组的生物胺都是呈现先上升后下降的趋势,而不接菌组的生物胺含量一直呈现出上升趋势。通过发酵为生物胺的形成创造了适当条件,包括微生物生长和蛋白质水解。在贮藏前期,微生物的存在及发酵产品成熟过程中微生物脱羧酶的残留活性,水解形成的游离氨基酸作为胺的潜在前体,都会增加生物胺含量[34]。从图5可以看出,从30 d开始菌落总数开始下降,有研究表明,生物胺的减少可能与微生物数量的减少有关,尤其是乳酸菌含量[41],所以证明贮藏后期生物胺含量的下降。细菌在贮藏期间的生长受到贮藏温度、含氧量、氯化钠含量等的影响。而由于大部分与组胺产生有关的细菌为嗜温菌[42],所以前期没有组胺产生,而后期产生可能是因为室温下组胺易形成[4]。而接菌组的生成组胺含量少于不接菌组,说明混菌发酵可以有效控制发酵肉中组胺的积累,这也与Tsai等[43]的结论相似。

表6 发酵鸭腿贮藏过程中各生物胺的含量Table 6 Changes in biogenic amines contents during storage of fermented duck thighmg/kg
3 结 论
本实验在传统发酵产品的基础上,引入新的发酵工艺制备发酵鸭腿,并研究其品质特性的变化规律,得到的发酵鸭腿产品发酵风味浓郁,品质良好。通过对接菌量、菌种配比、发酵温度和发酵时间这4 个因素进行单因素试验和正交试验,得到发酵鸭腿的最佳工艺条件为接菌量2%、植物乳杆菌-酿酒酵母菌菌种配比1∶2、发酵温度30 ℃、发酵时间24 h,通过对此工艺下制作的发酵产品pH值、大肠杆菌、亚硝酸盐、组胺和过氧化值测定,得到产品的指标均在国家标准要求范围内,说明此工艺条件下制得的发酵鸭腿具有较高的感官评分和较好的安全性。在常温贮藏过程中,真空包装的发酵鸭腿其菌落总数和亚硝酸盐含量呈先增加后降低的趋势,TBARS值和TVB-N值始终在缓慢增加,整体的变化范围较小。酪胺、精胺与腐胺是贮藏期间检出的主要胺类物质,接菌组生物胺含量在贮藏期间的后期有所下降,不接菌组生物胺含量初期较低,后期持续升高。不接菌组于30 d因微生物质量劣变引起不好的风味,而接菌组将产品贮藏期延长至50 d。所以添加混合发酵剂能够提升产品口感和延长产品贮藏期,为新型发酵产品的生产提供了新的方向和理论指导。

