聚赖氨酸偶联活性氧诱导酿酒酵母细胞凋亡
侯 颖,马文瑞,程雅文,郑浩然,谭之磊,贾士儒
(省部共建食品营养与安全国家重点实验室,工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
细胞死亡是维持机体正常发展的一个重要过程,有机体生长发育或组织在清除多余或受损细胞时,维持机体完整性的生命特征[1-2]。细胞死亡一般分为主动死亡和被动死亡两种形式[3]。其中,细胞凋亡是一种由基因表达调控的细胞主动死亡的过程,凋亡细胞体积变小,形态逐渐变圆,脱离相邻的细胞[4]。酿酒酵母是单细胞真菌微生物,遗传信息分析研究较为全面透彻,其细胞凋亡生化表征与哺乳动物细胞十分相似,研究细胞凋亡的相关机制,可以作为一类优势的模式生物[5-6]。活性氧(reactive oxygen species,ROS)是细胞凋亡重要的诱导剂,ROS过量产生会使胞内大分子发生染色质浓缩,DNA片段化,磷脂酰丝氨酸(phosphatidylserine,PS)外翻等氧化损伤,进而开启细胞凋亡途径[7]。
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种携带氨基的阳离子表面活性剂,由25~35 个L-赖氨酸组成,通过ε-氨基和α-羧基缩合而成的碱性氨基端同聚物,也称碱性聚酰胺,其对革兰氏阳性菌、革兰氏阴性菌、真菌以及一些病毒均有抑制作用[8-9]。因此,ε-PL的抑菌机制及其应用受到广泛关注。薄涛等[10]研究了不同质量浓度ε-PL对酿酒酵母的抑菌机制,结果表明随着ε-PL质量浓度升高,细胞膜通透性和疏水性升高,细胞活性降低,并确定了亚致死质量浓度为200 μg/mL,致死质量浓度为500 μg/mL。同时,薄涛等[10]研究了ε-PL浓度对酿酒酵母细胞壁的影响,细胞壁压力实验结果表明,ε-PL处理会对其细胞壁产生扰动,变得更加脆弱。在亚致死浓度ε-PL处理组中,细胞壁的主要组成成分磷酸甘露糖和几丁质含量随着ε-PL处理浓度上升而显著上升,β-1,3-葡聚糖含量并没有显著变化,透射电子显微镜照片显示酿酒酵母细胞壁没有明显变化。在致死浓度ε-PL处理组中,上述3 种主要组成成分含量较对照组均显著上升;细胞壁某些位点明显断裂,细胞内物质流出。与此同时,双氢罗丹明123和DAPI染色实验结果显示亚致死浓度ε-PL处理还会引起酿酒酵母胞内ROS积累和DNA断裂[11]。谭之磊等[12]将ε-PL与带负电荷的卵白蛋白形成带不同电荷的复合物,通过静电作用减少与大肠杆菌的相互作用,从而降低抑菌效果。Ye Rusong等[13]研究发现ε-PL会造成大肠杆菌氧化胁迫,使DNA损伤应答调节基因的表达受到影响。Zhao Ruifang等[14]将ε-PL与阳离子聚合物形成可降解的复合纳米粒子,研究对大肠杆菌、金黄色葡萄球菌和大肠杆菌的抑菌性并分析其在药物包封率和抑菌性的应用潜力。但是关于ε-PL与微生物凋亡的相关研究鲜有报道。
本研究以酿酒酵母为模式真菌,研究ε-PL对酵母细胞凋亡的影响及其相关机制,解析ROS与细胞凋亡的偶联关系,旨在为ε-PL的抑菌机理和真菌细胞凋亡机制的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae)AS2399由天津科技大学菌种保藏中心保藏。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:酵母膏10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,pH 6.0,121 ℃灭菌20 min。
ε-PL(≥99%) 浙江新银象生物技术有限公司;N-乙酰半胱氨酸(N-acetylcysteine,NAC) 江苏佰耀生物科技有限公司;细胞凋亡与坏死检测试剂盒、ROS检测试剂盒 上海碧云天生物技术有限公司;JC-1线粒体膜电位试剂盒 北京索莱宝科技有限公司;磷酯酰丝氨酸外翻检测试剂盒 美国BD公司;原位末端凋亡(TdT-mediated dUTP nick-end labeling,TUNEL)检测试剂盒 瑞士Roche公司。
1.2 仪器与设备
SPD2010-230正置荧光显微镜 日本Olympus公司;SU1510扫描电子显微镜 日本Hitachi公司;Multiskan MK3全自动酶标仪 美国Thermo公司。
1.3 方法
1.3.1 酿酒酵母细胞前处理
NAC是一种常见的抗氧化剂,具有干扰自由基生成、清除已生成自由基、调节细胞代谢活性、预防DNA损伤、抗细胞凋亡等功能[15]。为进一步探究ROS在ε-PL抑菌过程中的作用,将抗氧化剂NAC与ε-PL共同作用于酿酒酵母。
活化好的酵母培养液初始细胞密度OD600nm值达到0.3~0.4时,添加ε-PL和NAC,28 ℃、180 r/min条件下连续培养8 h后终止培养。其对照处理组中,一组样品仅有细胞培养液,作为空白对照,另一组向细胞培养液中再加入终浓度为10 mmol/L NAC溶液。ε-PL处理组中,一组需要分别加入200、500 μg/mL的ε-PL溶液,另一组需要分别加入200、500 μg/mL的ε-PL溶液后,再分别加入10 mmol/L NAC溶液。每组样品制备3 份。
1.3.2 酿酒酵母细胞形态观察
参照Hair等[16]的方法并加以改良,细胞培养方法同1.3.1节。
1.3.3 酿酒酵母细胞荧光显微镜检测
1.3.3.1 ROS检测
2,7-二氯二氢荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFHD A)进入细胞后水解生成2,7-二氯二氢荧光素(2,7-dichlorodihydrofluorescein,DCFH),被装载到细胞内后,ROS能够氧化无荧光的DCFH生成有绿色荧光的2,7-二氯荧光素(2,7-dichlorofluorescein,DCF)。通过检测DCF的荧光程度,可以得出细胞内ROS的水平[17]。操作步骤见试剂盒使用手册并加以改良,具体如下:首先,低速离心收集酵母细胞液,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗2 次细胞。其次使用DCFH-DA重悬细胞,37 ℃培养箱内孵育20 min,每隔3~5 min轻微颠倒混匀,使探针和细胞充分接触。然后使用空白培养基洗涤细胞3 次,再次使用PBS洗涤2 次并重悬。最终取200 μL菌液加入96 孔板中,酶标仪检测。同时取适量菌液,制片,荧光显微镜观察。
1.3.3.2 磷酯酰丝氨酸外翻检测
异硫氰酸荧光素-膜联蛋白V(fluorescein isothiocyanate-Annexin V,FITC-Annexin V)利用细胞凋亡早期的细胞膜不对称性,确定凋亡细胞的比例。Annexin V是一种钙离子依赖型的磷脂结合蛋白,对PS有较高的吸附性,同时FITC能够产生绿色荧光。碘化丙啶(propidium iodide,PI)是一种标准的流式红色探针,细胞膜完整时可以将PI排出胞外,以之,PI完全进入细胞。因此,使用Annexin V和PI荧光探针分辨存活和死亡细胞。FITC阳性且PI阴性的细胞即为凋亡细胞,FITC和PI双阳性的细胞是凋亡后期、正在坏死或者已经死亡的细胞,FITC和PI双阴性的细胞是正常细胞或者还未检测到凋亡的细胞[18]。操作步骤见试剂盒使用手册并加以改良,首先,低速离心收集酵母细胞液,PBS清洗2 次细胞。然后使用染色缓冲液重悬细胞,取100 μL菌悬液到5 mL离心管中;同时加入5 μL FITC-Annexin V和5 μL PI染色液,轻微颠倒混匀,25 ℃黑暗孵育15 min,最后加入400 μL染色缓冲液。制片,荧光显微镜观察。
1.3.3.3 染色质固缩检测
蓝色荧光染料Hoechst 33342和PI均可与细胞核DNA或RNA结合,Hoechst穿透细胞膜,染色后凋亡细胞荧光会比正常细胞明显增强。对于坏死细胞,其细胞膜的完整性丧失,PI可以染色坏死细胞。双染后,正常细胞则呈现为弱红色荧光+弱蓝色荧光,细胞核内有较深的蓝色颗粒,凋亡细胞为弱红色荧光+强蓝色荧光,核内浓集而呈亮蓝色,坏死细胞为强红色荧光+强蓝色荧光,核内呈红色[19]。操作步骤见试剂盒使用手册并加以改良,首先,低速离心收集酵母细胞液,用PBS清洗2 次细胞。加入5 μL Hoechst染色液和5 μL PI染色,轻微颠倒混匀,4 ℃黑暗孵育20~30 min后,离心沉淀细胞,使用PBS再次洗涤细胞,涂片,使用荧光显微镜观察。
1.3.3.4 线粒体膜电位检测
亲脂性阳离子荧光染料JC-1结合到线粒体基质并产生红色荧光,其荧光强度说明膜电位的状态。以之,线粒体跨膜电位耗散,细胞进入不可逆的凋亡过程,JC-1单体产生绿色荧光[20-21]。操作步骤见试剂盒使用手册并加以改良,首先,低速离心收集酵母细胞液,用PBS清洗2 次细胞。使用0.5 mL YPD培养基重悬细胞后,再次加入0.5 mL JC-1染色液,立即混匀,37 ℃恒温静置20 min。4 ℃、600×g离心4 min,弃上清液。然后使用JC-1染色缓冲液洗涤2 次细胞,再次使用缓冲液重悬细胞,4 ℃、600×g离心4 min,沉淀细胞,弃上清液,重复2 次。最后将细胞重悬使用荧光显微镜。
1.3.3.5 DNA损伤检测
TUNEL法能够检测DNA损伤。细胞发生凋亡时,部分DNA内切酶被激活,会切断核小体间的基因组DNA。在末端脱氧核苷酸转移酶的催化下,基因组DNA断裂后3’-OH能够结合绿色荧光探针FITC标记的脱氧尿苷三磷酸(deoxyuridine triphosphate,dUTP),使用荧光显微镜检测[22]。操作步骤见试剂盒使用手册并加以改良,首先,低速离心收集酵母细胞液,用PBS清洗2 次细胞。使用0.5 mL YPD培养基重悬细胞后,再次加入10 μL TUNEL染色液,立即混匀。37 ℃恒温孵育2 h,期间,每隔10 min上下颠倒混匀。37 ℃孵育结束后,4 ℃、600×g离心10 min,弃上清液,再次使用PBS洗涤并重悬细胞。取适量菌液,制片,使用荧光显微镜观察。
1.4 数据分析
使用SPSS 20.0对数据进行统计分析。
2 结果与分析
2.1 酿酒酵母菌细胞生长密度结果
通过测定酿酒酵母8 h后的细胞密度OD600nm值,观察菌体的生长情况,结果见图1。ε-PL处理组中,C组酿酒酵母的OD600nm值与A组细胞密度相比降低了83.7%,细胞生长受到明显抑制。E组的OD600nm值与初始接种OD600nm值基本一致,细胞死亡率接近100%,活性完全受到抑制。但是加入NAC,D组的OD600nm值升高49.8%。

图1 酿酒酵母细胞密度OD600 nm值Fig. 1 Cell density (OD600 nm) of S. cerevisiae
2.2 酿酒酵母细胞形态观察结果
通过扫描电子显微镜观察酿酒酵母形态变化,如图2所示。所有样品的细胞大小没有明显变化。对照组细胞形态完整,表面光滑饱满。ε-PL处理组中,C组细胞膜表面粗糙并有明显的凹陷,E组细胞膜表面粗糙,出现明显的凹陷、孔洞和细微凸起。加入NAC后的处理组细胞形态与ε-PL处理组无明显差异。

图2 ε-PL质量浓度对酿酒酵母细胞形态的影响Fig. 2 Effect of ε-PL concentration on cell morphology of S. cerevisiae
2.3 酿酒酵母细胞荧光显微镜检测结果
2.3.1 ROS检测结果
DCFH-DA探针检测酿酒酵母细胞胞内ROS含量,图3结果显示,对照组中,A组和B组荧光强度一致。ε-PL亚致死浓度处理组中,C组荧光强度较A组增加了1.47 倍,ROS显著积累,加入NAC后,D组的荧光强度较C组降低了54.6%。致死浓度处理组中,E组与A组相比减少了9%,说明细胞死亡过多,ROS含量减少,加入NAC后,F组的荧光强度较E组降低了21.1%。结合细胞密度和形态观察结果,说明ε-PL诱发细胞ROS含量上升,使细胞活性受到抑制,同时NAC能够缓解ε-PL对酿酒酵母细胞活性的抑制作用。

图3 ε-PL质量浓度对酿酒酵母ROS含量的影响Fig. 3 Effect of ε-PL concentration on intracellular ROS content of S. cerevisiae
通过DCFH-DA探针对样品进行染色观察,图4结果显示,对照组中,A组和B组均未发现绿色荧光细胞。ε-PL处理组中,亚致死浓度C组的绿色荧光细胞强度和数量最高,致死浓度E组出现少量绿色荧光细胞并且荧光强度降低,说明大部分细胞坏死,ROS含量降低,但是仍有小部分细胞出现ROS迸发现象。加入NAC后的处理组荧光强度均降低,说明外源添加NAC能够抑制胞内ROS含量。

图4 ε-PL质量浓度对酿酒酵母ROS的影响Fig. 4 Effect of ε-PL concentration on intracellular ROS of S. cerevisiae
2.3.2 磷酯酰丝氨酸外翻检测结果
通过Annexin V-PI探针对样品进行染色观察,图5结果显示,A组未发现绿色或红色细胞,证明无磷酯酰丝氨酸外翻现象和细胞坏死现象。ε-PL处理组均出现FITC阳性且PI阴性的绿色细胞和FITC和PI双阳性的红色细胞,说明ε-PL会使酿酒酵母细胞磷酯酰丝氨酸外翻,其中,亚致死浓度处理组的绿色荧光细胞数量相比致死浓度组多,说明在亚致死浓度下,细胞膜较完整,未被PI染色,细胞能够较长时间处于细胞凋亡早期阶段。致死浓度处理组多数细胞呈现红色荧光,说明致死浓度下大量细胞发生坏死。

图5 ε-PL质量浓度对酿酒酵母磷酯酰丝氨酸外翻的影响Fig. 5 Effect of ε-PL concentration on phosphatidylserine externalization of S. cerevisiae
2.3.3 染色质固缩检测结果
通过Hoechst 33342-PI探针对样品进行染色观察,细胞出现蓝色说明染色质固缩,这一现象是细胞凋亡的显著特征之一。图6结果显示,A组中多数细胞为淡蓝色荧光,其中,内部有深蓝色颗粒,即为正常细胞。ε-PL处理组出现3 种细胞,第1种是正常细胞,第2种是细胞核内有分散的亮蓝色细胞即为凋亡细胞,第3种是有红色荧光背景的蓝色坏死细胞,说明ε-PL会使细胞染色质固缩。但是加入NAC后的处理组,凋亡细胞数量明显增多。
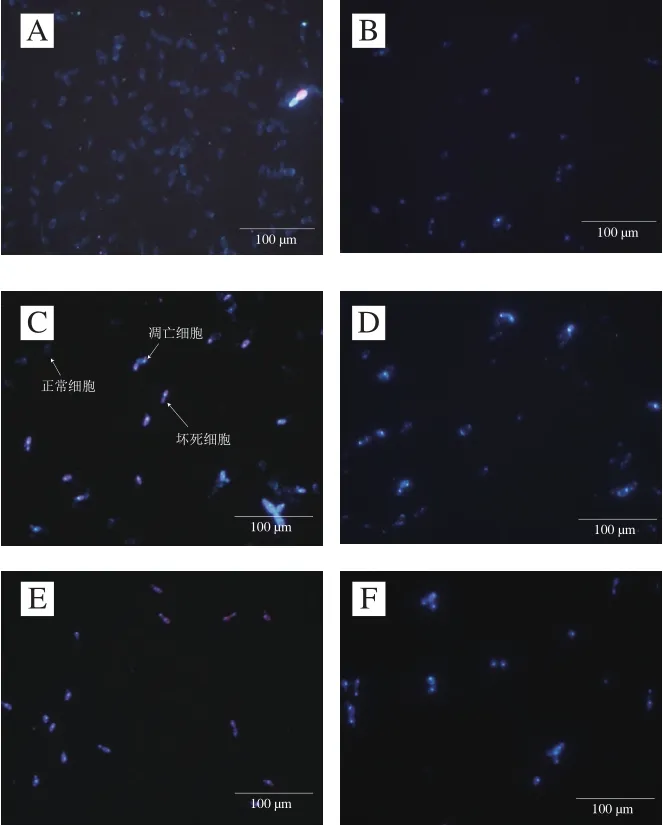
图6 ε-PL质量浓度对酿酒酵母染色质固缩的影响Fig. 6 Effect of ε-PL concentration on chromatin pyknosis of S. cerevisiae
2.3.4 线粒体膜电位检测结果
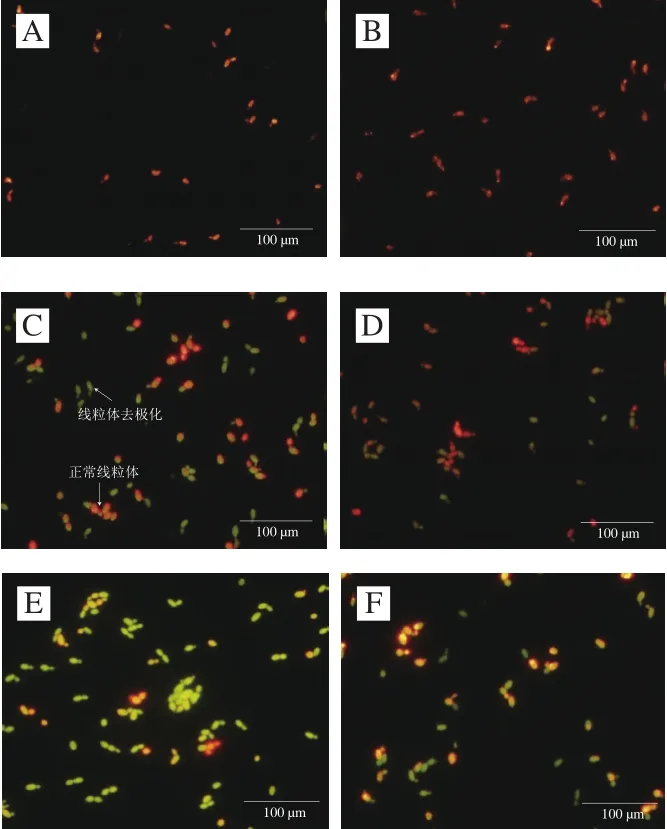
图7 ε-PL质量浓度对酿酒酵母线粒体膜电位的影响Fig. 7 Effect of ε-PL concentration on mitochondrial transmembrane potential of S. cerevisiae
通过JC-1探针对样品进行染色观察,图7结果显示,对照组中,A组和B组均为红色荧光细胞,说明线粒体膜电位较高,细胞生长状态良好。ε-PL处理组出现两种荧光细胞,一种是红色荧光细胞;另一种是绿色荧光细胞,说明线粒体膜电位较低,部分细胞处于凋亡或死亡阶段。其中,致死浓度E处理组绿色荧光细胞数量和强度最高,亚致死浓度C组次之,说明随着ε-PL质量浓度升高,线粒体膜电位耗散程度增强,细胞死亡,抑菌活性增强。与此同时,加入NAC后的处理组,绿色荧光强度均明显降低,线粒体膜电位耗散程度降低。
2.3.5 DNA损伤检测结果
通过TUNEL对样品进行染色观察,图8结果显示,对照组中,A组和B组均未出现绿色荧光细胞。ε-PL处理组中,亚致死浓度C组和致死浓度E组均出现绿色荧光细胞。加入NAC后,亚致死浓度D组未出现荧光细胞,致死浓度F组中荧光细胞相对减少,可以降低DNA损伤。

图8 ε-PL质量浓度对酿酒酵母DNA损伤的影响Fig. 8 Effect of ε-PL concentration on DNA damage in S. cerevisiae
3 讨 论
ε-PL作为一种天然绿色的防腐剂,其抑菌性能已经得到国内外研究者的广泛研究。Hyldgaard等[23]以大肠杆菌和李斯特菌为模式菌株,检测了二价阳离子对ε-PL抑菌活性的影响。周祺等[24]以肠球菌为研究对象,分析ε-PL对其的抑菌机制,结果发现ε-PL通过改变细胞膜通透性,进而改变膜内外电位,使得细胞大分子渗出并与DNA结合,从而实现抑菌作用。蔡瑞等[25]以不同质量浓度ε-PL研究了脂环酸芽孢杆菌最小抑菌浓度并将其应用在模拟苹果汁中,检测菌落数和愈创木酚变化趋势。孙链等[26]以不同贮藏温度和时间为单因素,研究了ε-PL对牛肉火腿切片的细菌总数、乳酸菌和大肠杆菌的抑制效果。陈晓青等[27]研究ε-PL质量浓度对金黄色葡萄球菌生长曲线和生物膜形成的影响,结果表明ε-PL质量浓度越高,对其抑制效果越好,并且生物膜形成能力下降。本课题研究了酿酒酵母菌细胞初始密度达到一定值后,添加不同质量浓度的ε-PL和抗氧化剂NAC,分析细胞生长密度的变化,结果显示亚致死浓度ε-PL的细胞生长密度与空白对照组相比降低了83.7%,致死浓度ε-PL的细胞密度基本不变,但是加入NAC后,其细胞生长密度升高了49.8%,表明加入NAC后可以有效控制细胞活性。同时,扫描电子显微镜观察细胞形态发现,亚致死浓度下细胞表面不光滑,部分细胞表面出现凹陷。致死浓度下细胞表面粗糙,出现明显的凹陷和细微凸起,细胞膜造成严重损伤,这一结果与薄涛等[10]研究结果一致。
真核酵母细胞ROS水平上升,与抗氧化作用失衡,造成蛋白质、核酸和膜脂等大分子物质氧化损伤,进而生理活动异常诱发细胞凋亡。王兴华等[28]研究了镉诱导对酵母细胞作用的死亡机制,结果表明镉处理可以降低细胞活性,ROS含量升高,诱导细胞死亡,但是外源添加抗氧化剂或Ca2+,细胞死亡数量明显降低。Madeo[29]研究了氧胁迫对酵母细胞凋亡的影响机制,结果表明,胞内谷胱甘肽的消耗或外源低剂量H2O2的加入,可以诱导酿酒酵母细胞凋亡。同时,酵母也可以通过基因CDC48的突变或哺乳动物Bax的表达触发细胞凋亡。在这两种情况下,结果显示胞内氧自由基积聚,而自由基耗尽或缺氧则阻止细胞凋亡。刘庆菊等[30]研究了D-氨基酸对酿酒酵母的氧化损伤机制,结果表明,D-氨基酸诱导胞内产生以H2O2为主要类型的ROS物质,细胞产生毒性并抑制其生长。本课题利用探针染色和荧光显微镜技术,研究了不同质量浓度ε-PL对酵母细胞活性的抑制机制,结果表明,ε-PL处理组的酿酒酵母细胞均出现磷酯酰丝氨酸外翻、染色质固缩、线粒体膜电位耗散和DNA损伤现象,其中,在亚致死浓度下,ROS荧光强度最高,说明ε-PL能够诱导酿酒酵母细胞ROS迸发,使细胞进入凋亡早期阶段。在致死浓度下,ROS含量相对减少,说明ε-PL浓度过高可使细胞直接进入凋亡后期阶段直至死亡。外源添加抗氧化剂NAC后,ROS荧光强度下降,细胞凋亡特征的荧光强度均降低,说明NAC能够清除胞内ROS,使ε-PL的抑菌活性降低。
4 结 论
ε-PL对酵母细胞活性有一定的抑制作用,不同质量浓度的ε-PL抑制效果不一致,其中亚致死浓度下诱导ROS迸发,使细胞进入凋亡早期阶段,致死浓度下能使细胞进入凋亡后期阶段直至死亡,同时外源添加抗氧化剂NAC可清除胞内ROS,有效抑制ε-PL的抑菌活性。

