定向进化转录调节基因提高漆酶异源表达
李 燕,杨建花,李宝库,朱蕾蕾*
(1.河北大学 药学院,河北 保定 071002;2.中国科学院天津工业生物技术研究所 工业酶国家工程实验室,天津 300308)
漆酶(Laccase, EC 1.10.3.2)是一种含有四个铜离子的多酚氧化酶,属于铜蓝氧化酶家族,能够催化多种酚类和非酚类的化合物[1-3],因此在造纸漂白[4-5]、染料脱色[6-7]、食品加工[8]、环境保护[9]等领域有广阔的应用前景。但是,自然界的野生菌漆酶存在酶活低、产量低、培养周期长、高温易失活等问题,导致其难以应用于工业生产。随着分子生物学和基因组学的迅猛发展,通过定向进化技术来提高漆酶表达量、催化能力、稳定性及底物特异性等;寻找合适的载体进行漆酶基因的异源表达来提高表达量,都是目前解决问题的有效方法[10-12]。
定向进化是一种在实验室模拟达尔文进化的过程,通过对基因进行突变或重组,建立突变库以筛选到性能更好的蛋白,是一种最有前途的提高漆酶表达和性能的方法[13]。酿酒酵母因其操作简单,生产成本低,分泌表达易于纯化,能对表达蛋白进行加工、修饰等诸多优点脱颖而出,成为目前最主要的外源蛋白表达宿主之一[14]。此外,酿酒酵母因不产生毒素,安全性好,成为一种与人类生活密切相关的酵母, 广泛应用于食品工业和生物医药领域[15]。作为真核生物的模式菌, 酿酒酵母全序列的测定已于1996年完成,是目前了解最完全的真核生物[16]。因此,本章通过对漆酶Lcc转录调节区域进行突变,并将pYES2-Lcc突变质粒转化酿酒酵母进行异源表达,构建酿酒酵母菌株突变库,利用以ABTS为底物的酶活检测筛选方法,筛选出高酶活、高表达量的突变菌株。
1 材料与方法
1.1 菌株和质粒
大肠杆菌(Escherichiacoli) BL21Gold(DE3)、酿酒酵母(Saccharomycescerevisiae) INVSc1菌株由本实验室保存,重组载体pYES2-Lcc由本实验室构建。
1.2 酶和试剂
Easy Taq®DNA Polymerase、10×Easy Taq®Buffer、2.5 mM dNTPs、基因Marker(Trans 15K DNA Marker)购自TransGen Biotech公司;质粒小提试剂盒购自天根生化科技有限公司;酵母质粒小提试剂盒、无氨基酵母氮源(YNB)购自Solarbio公司。胰蛋白胨Tryptone、酵母提取物Yeast Extract购自英国OXOID 公司;琼脂糖Agar购自Sigma公司;2,2'-联氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)购自Coolaber公司;其它试剂均为国产分析纯。
1.3 培养基
(1) YPAD培养基:1%酵母提取物,2%胰蛋白胨,2%葡萄糖,0.004%硫酸腺嘌呤,121℃灭菌15 min。
(2) SC-U培养基:0.67%无氨基酵母氮源,2%碳源(葡萄糖或棉子糖),0.01% (腺嘌呤,精氨酸,半胱氨酸,亮氨酸,赖氨酸,苏氨酸,色氨酸),0.005% (天冬氨酸,组氨酸,异亮氨酸,蛋氨酸,苯丙氨酸,脯氨酸,丝氨酸,酪氨酸,缬氨酸),固体培养基添加2% Agar,121℃灭菌20 min。
(3) HC预培养基:10% 10×YNB,10% 10×HC dropout solution,20% 200 g/L galactose,10% 1 mol/L pH值6.2 KH2PO4-KOH缓冲液,50%去离子水。
(4) HC表达培养基:10% 10×YNB,10% 10×HC dropout solution,20% 200 g/L galactose,10% 1 mol/L pH值6.2 KH2PO4-KOH缓冲液,0.2% 0.25 mol/L,59.8%去离子水,过滤除菌。
1.4 Lcc转录调节序列突变库构建
将实验室保藏的大肠杆菌BL21/pYES2-Lcc划线于LB (Amp)固体平板,挑取单克隆接种于LB (Amp)液体培养基,并于37℃、200 r/min的恒温摇床中过夜培养。利用质粒小提试剂盒提取pYES2-Lcc质粒,作为易错PCR的模板DNA,以fw-lcc-调节区域为上游引物,其碱基序列为5′-GTGGAAGCGGTATTCGCAATG-3′,rev-lcc-调节区域为下游引物,其碱基序列为5′-GAGCTCGGTACCAAGCTTAATATTCC-3′。反应体系:Template DNA (50 ng/μL) 2 μL,10 μM Forward Primer 2 μL,10 μM Reverse Primer 2 μL,10×EasyTaq®Buffer 10 μL,2.5 mM dNTPs 8 μL,EasyTaq®DNA Polymerase 2 μL,10 mM Mn2+,ddH2O 71 μL,total 100 μL。反应条件:94℃ 3 min;94℃ 30 s,58℃ 30 s,72℃ 2 min,共30个循环;72℃ 10 min。每个小离心管装25 μL,放入PCR仪,反应结束后,取2 μL产物利用1%核酸胶电泳检测验证,通过胶回收纯化回收目的条带,命名为Lcc-ep.并将其重组到质粒上,取1 μL重组质粒电转入大肠杆菌BL21Gold(DE3)感受态细胞,电击后加入1 mL LB液体培养基混匀,37℃、200 r/min摇床中孵育1 h,分别涂布于含有Amp的LB固体平板(Amp抗性筛选),37℃恒温培养箱倒置过夜培养。收集到的菌体用质粒小提试剂盒抽提质粒,按其说明书操作。
1.5 酿酒酵母的转化
用LiAc/SS载体DNA/PEG法高效转化冷冻活性酵母细胞,具体操作步骤如下:将配制好的ssDNA从-20℃冰箱取出,沸水中煮5 min,使其变性,取出后立即放入冰浴备用;将-80℃保藏的感受态细胞取出,放于37℃水中15~30 s,13000 r/min离心2 min,去除上清,依次加入下列:260 μL 50% (w/v) PEG 3350,36 μL1.0 mol/L LiAc,50 μL 2.0 mg/mL ssDNA,14 μL待转化的质粒(pYES2-Lcc-ep)及无菌水,360 μL总体积;用移液器充分混匀,放于42℃水浴20~60 min;13000 r/min离心30 s,去除上清;加入1 mL YPAD液体培养基重悬,放入30℃水浴2~3 h;取200 μL重悬液涂布于SC-U平板,30℃培养3~4天,即可长出转化子。
1.6 重组酿酒酵母的诱导表达及其筛选
表达:待SC-U平板长出转化子后,用无菌牙签随机挑取转化子接种到含150 μL的HC预培养基(含Amp,Kan)的96孔板(平底)中,封口,30℃,800 r/min摇床培养2天,并做空白、空质粒、野生型对照;用复制器复制到含180 μL的HC表达培养基(含Amp,Kan)的96孔板(尖底)中,20℃,800 r/min摇床培养3天;剩余菌液加入50 μL 50%甘油,-80℃冰箱保存。
96孔板筛选:从表达好的重组酿酒酵母96孔板中,取出20 μL菌液到新的96孔板,再加入180 μL去离子水,用酶标仪测波长600 nm下的吸光度;将96孔板剩余菌液4000 r/min,15 min离心,以ABTS为底物,以pH值3.0的柠檬酸为缓冲液,在420 nm下测定吸光度,按以下体系测酶活力:110 μL pH值3.0柠檬酸缓冲液,50 μL上清,40 μL ABTS (7 mM )。酶活力单位定义为:1 min内催化氧化1 μmol底物的酶量为1个酶活单位。筛选到的酶活高于野生型的突变菌株挑选出来,再从原母板用无菌牙签中蘸取菌液进行预培养基、表达培养,测OD600,测ABTS酶活力(步骤同上);
摇瓶复筛:复筛到的高活性突变菌株从原母板取50 μL菌液接种到3 mL HC预培养基,30℃,200 r/min培养2天后转接到HC表达培养基(50 mL摇瓶/25mL培养基/250 μL菌液),测OD600,收菌,测上清ABTS酶活力。
1.7 酿酒酵母高活性突变体序列测定
酿酒酵母高活性突变体抽提质粒,按酵母质粒提取试剂盒说明书操作;以提取的酿酒酵母高活性突变体质粒为模板做克隆PCR验证(T7 promoter、T7 terminator商业引物做正反向引物);验证正确的突变体将提取的重组酿酒酵母质粒电转到大肠杆菌BL21Gold(DE3)感受态细胞;当平板上生长出单菌落时,挑取单克隆并接种至LB (Amp)液体培养基中,在37℃、200 r/min条件下培养12 h;将培养的菌液用质粒小提试剂盒提取大肠质粒,测DNA浓度并进行质粒验证,然后送至公司进行测序,将测序正确的菌株甘油冻存管储存在-80℃冰箱中。
1.8 漆酶高表达突变株调节区域序列比对
将测序结果进行整理,与原始序列进行同源比对,该过程用SnapGene软件完成,统计碱基突变位点。
2 结果与讨论
2.1 重组质粒的构建
以pYES2-Lcc质粒为模板,fw-lcc-调节区域、rev-lcc-调节区域分别为上下游引物进行易错PCR,克隆得到的产物,结果如图1所示,epPCR产物条带约1000 bp,克隆产物条带约为7602 bp,符合预期。该重组质粒及其调节区域如图2所示。
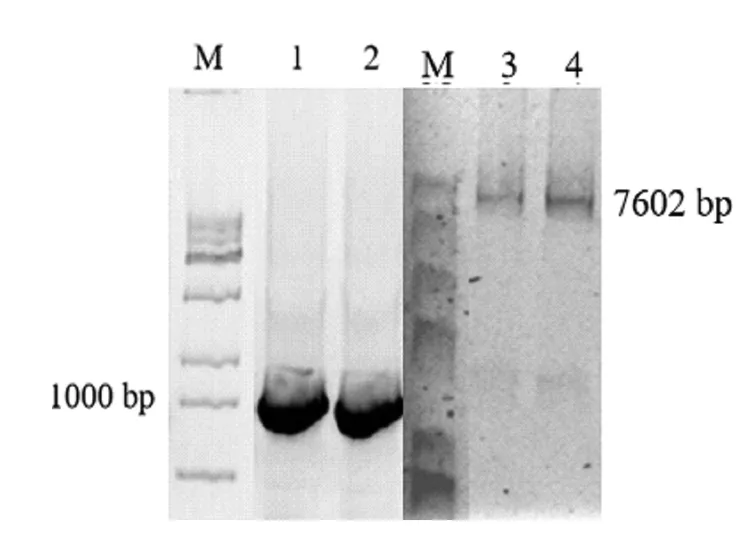
M代表Marker;1-2代表epPCR产物;3-4代表克隆产物

图2 重组质粒调节区域示意图Fig.2 Schematic diagram of the regulatory gene sequence of recombinant plasmid
2.2 重组酿酒酵母的筛选
对挑取的突变子利用ABTS检测方法进行初筛,以ABTS为底物测得酶活力高于野生型1.3倍的有46株。对46个优势菌株进行96孔板复筛,每个突变体设置4个平行样,获得13个优势突变体;最后对13个优势突变体进行摇瓶复筛,结果如图3所示。其中,酶活是野性型酶活1.5倍以上的突变株有3株,1.29~1.5倍的突变株有7株,1.04~1.2倍的突变株有3株。突变体M1酶活最高,可达35.4 U/L。
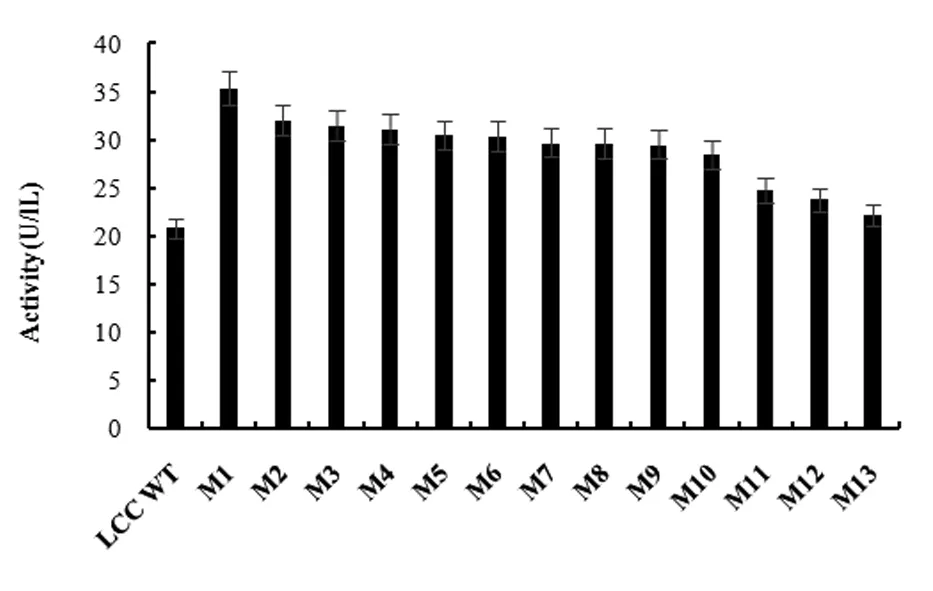
图3 野生型和13个优势突变体摇瓶复筛漆酶粗酶液酶活检测结果Fig.3 Activity detection results of crude enzymes from the flask cultivation of wild type and 13 dominant mutants
2.3 突变体序列测定及比对
为测定13个优势突变体中酶活最高的3株菌株的碱基序列,首先抽提酵母质粒,并对其进行克隆PCR,PCR产物验证电泳图如图4所示。从图中可以看到一条大小约为1500 bp的清晰条带,说明酵母质粒提取成功。之后将提取的重组酿酒酵母质粒电转到大肠杆菌BL21Gold(DE3)感受态细胞,接种单克隆培养,并抽提质粒,将质粒送公司测序,然后用SnapGene软件整理测序结果,与原序列比对后,发现活性最高的三个突变体在GAL1 promoter区域均有突变。因此推断,3个突变体上出现的4个突变加强了启动子与RNA聚合酶的结合,因此加速了漆酶基因的转录能力,从而引起漆酶表达量的提高。

M代表Marker,1-3代表M1、M2、M3突变体
3 结论与展望
本章通过对调节漆酶Lcc表达的调节区域进行突变,并将pYES2-Lcc突变质粒转化酿酒酵母进行异源表达,构建酿酒酵母菌株突变库,利用以ABTS为底物的高通量的筛选方法对突变库进行筛选,并对酶活高的突变体进行摇瓶复筛,最终获得了三株遗传稳定的高酶活突变体M1、M2、M3。它们的突变均在GAL1启动子区域,说明启动子上的突变引起了漆酶表达量的提高。通过定向进化转录调节区域,漆酶最高活性可达35.4 U/L。

