产黄曲霉毒素生物降解酶枯草芽孢杆菌菌株的筛选及发酵工艺研究
孙 标 白禄宏 韩立虎 母绍林*
(1.浙江大学动物科学学院,浙江杭州310058;2.浙江启润生物科技有限公司,浙江嘉兴314000)
黄曲霉毒素(Aflatoxin)是由黄曲霉、寄生曲霉浸染15%以上的小麦、玉米等农作物、饲料、食品等产生的有毒性的代谢产物[1],是一种强致癌物质,其毒性是氰化钾的10 倍,砒霜的68 倍,苯并芘的4 000 倍。迄今发现的各种真菌毒素中最稳定、毒性最强的一种为黄曲霉毒素B1(AFB1),因而世界卫生组织把AFB1定为IA类致癌物质[2]。
我国畜禽饲料的霉菌毒素污染现象较为严重,黄曲霉毒素在配合饲料中的检出率很高,不仅导致饲料原料蛋白、维生素成分发生改变,破坏饲料原料的适口性,还会导致畜牧业经济损失,最终随食物链进入人体,严重危害人类健康[3]。目前,黄曲霉毒素的脱毒方法主要有化学脱毒法、物理脱毒法、硅酸盐吸附法、甘露聚糖吸附法、活性炭吸附法等[4-8],生产中应用较为广泛的脱毒方法是通过添加吸附剂的方法对被污染的粮食和饲料作物进行脱毒处理,主要利用吸附剂与霉菌毒素的螯合吸附作用[9-10],但这种简单的吸附在吸附霉菌毒素的同时吸附剂还会吸附饲料中的某些微量成分影响其利用率[11]。因此采取更为有效和安全的方法对霉菌毒素进行脱毒处理便成为解决问题的关键。采用微生物降解霉菌毒素,由于其有效率高、无残留、成本低廉和操作简便等优点引起了研究人员的广泛关注,尤其是利用微生物或者其产生的酶将霉菌毒素降解为无毒产物更成为目前研究的热点。用生物学方法降解饲料中黄曲霉毒素的应用非常少,因此分离得到具有较高黄曲霉毒素降解效率的菌株是我们未来的研究发展方向。
本研究旨在筛选高效降解AFB1的枯草芽孢杆菌菌株,优化目标菌株的生长条件,对发酵培养基的营养成分、发酵培养条件进行单因素优化,最显著因素进行响应面试验,确定最优发酵条件,使菌株达到最佳降解能力。因此,筛选产AFB1 生物降解酶枯草芽孢杆菌菌株,并对其发酵工艺进行优化研究,对开发高效、广谱、保营养的霉菌毒素脱毒剂来提高畜禽饲料质量安全、保护人畜健康具有重要的意义。
1 材料与方法
1.1 主要试剂
酵母提取粉、蛋白陈、酵母浸膏、琼脂粉(BR,安琪酵母股份有限公司)、牛肉膏(BR,北京奥博星生物技术有限责任公司)、葡萄糖(AR,天津永最精细化工有限公司)、蔗糖、硫酸锰、氯化钠(AR,天津市风船化学试剂科技有限公司)、磷酸氢二钠(AR,北京精求化工有限责任公司)、磷酸二氢钾(AR,北京红星化工厂)、乙酸钠(AR,天津市北方天医化学试剂)、柠檬酸(BR,天津南开允公合成技术有限公司)、吐温-80、硫酸镁(AR,天津博迪化工股份有限公司)、碳酸钙(AR,天津市科盟化工工贸有限公司)、香豆素(北京庆盛达化工技术有限公司)、AFB1(上海佑隆生物科技有限公司)、甲醇(AR,南京德泽化工有限公司)。
1.2 主要仪器
分析天平(QANN10-2008)、超声波清洗器(KQSOODE)、电热恒温鼓风干燥箱(DHG-9243 85-III)、立式压力蒸汽灭菌锅(YXQ-LS-SOA)、数显恒温水浴锅(HH-4)、涡旋振荡器(VELPRS CIENTFICA)、苏洁净化超净工作台(CJ-2D)、恒温培养箱(SPX-250BF-2)、水浴恒温振荡器(SHA-B)、酸度计(PHS-3C)、赛智2200液相色谱仪、50L 发酵罐(上海广世生物工程设备有限公司)、酶标仪(RT6000)、超声波细胞破碎仪(JY96-IIN)、电热恒湿水槽(SG-4055,上海硕光电子科技有限公司)、紫外可见分光光度计(5500pc)、定量中速滤纸。
1.3 样品采集和培养基
样品主要来源于浙江中科院应用技术研究院土壤样品、浙江大学饲料所土壤样品,动物粪便,发酵食品,腐烂朽木,霉菌侵染小麦、玉米、麸皮等。种子培养基(1 L)为营养肉汤培养基添加20 g琼脂粉。
1.3.1 香豆素初筛培养基[2,12]
0.25 g KH2PO4、0.25 g MgSO4、0.5 g KNO3、0.5 g(NH4)2SO4、0.005 g CaCl2、0.003 g FeCl3、20 g 琼脂、pH值6.8、121 ℃灭菌30 min,灭菌结束加入除菌的香豆素,终溶液浓度为1 g/l。
1.3.2 复筛培养基
3 g 牛肉膏、5 g 蛋白胨、8 g 酵母浸粉、10 g 葡萄糖、12 g NaCl、pH值6.8、121 ℃灭菌30 min。
1.3.3 基础培养基
5 g 蛋 白 胨、葡 萄 糖20 g、12 g NaCl、0.25 g KH2PO4、0.25 g MgSO4、0.5 g (NH4)2SO4、0.5 g CaCl2、0.3 g FeCl3、pH值6.8、121 ℃灭菌30 min。
1.3.4 发酵培养基
75 g 酵母膏、250 g 豆粕、80 g 麸皮、50 g 酵母浸粉、10 g葡萄糖、15 g NaCl、0.5 g MgSO4、0.5 g KH2PO4、pH值6.8、通气2.5 m3/h、转速150 r/min。
1.4 菌株初步分离
分别称取样品10 g,粉碎后称取1 g,加入装有100 ml无菌水三角瓶中,置于恒温摇床,150 r/min,处理30 min,吸取上清液1 ml,梯度稀释10-3、10-4、10-5、10-6,分别吸取1 ml 各样品溶液,接种到种子培养基,37 ℃,150 r/min 恒温震荡培养32 h,然后在无菌条件下吸取5 ml 发酵液接种到香豆素初筛培养基中,37 ℃培养3 d,变浑浊的培养基,无菌条件下,在新的香豆素初筛培养基上划线,37 ℃培养,并分别编号保存。
1.5 菌株复筛
无菌条件下取1 环初筛菌株分别接种复筛培养基中,37 ℃、150 r/min 振荡培养,待发酵液浑浊后,无菌条件下,以5%接种量接于100 ml 发酵培养基中,37 ℃、150 r/min、培养42 h,取1 ml 菌体发酵液与50 μl AFB1 标准品,置于灭菌的1.5 ml 离心管中,使其毒素终浓度为50 μg/ml,以无菌的发酵培养基加AFB1 作为空白对照,25 ℃、150 r/min 于暗处振荡培养24 h,反应结束后,离心去除菌体,取其上清液利用酶标仪检测450 nm波长吸光值。
1.6 黄曲霉毒素B1(AFB1)提取及含量测定
1.6.1 样品处理方法
采用移液枪准确吸取样品10 ml,于100 ml 具塞三角瓶中,加入20 μg/kg 黄曲霉毒素B1 20 μl,25 ℃恒温振荡2 h,准确加入50.0 ml 甲醇水(7∶3)溶液,充分振荡提取15 min,静置分层,过滤收集样品滤液用于AFB1的检测。
1.6.2 样品检测
①加入50 μl 标品与提取的样品溶液,50 μl 酶标记物工作液,25 ℃反应10 min;
②洗板,加入100 μl 显色剂,25 ℃避光反应10 min;
③加入100 μl终止液,酶标仪450 nm读数。黄曲霉毒素B1含量计算:
X(μg/kg)=C×V×M×D
式中:X——黄曲霉毒素B1含量(μg/kg);
C——待测样液中黄曲霉毒素B1含量(μg/kg);
V——样品提取液体积(ml);
M——样品质量(g);
D——样品稀释倍数。

1.7 黄曲霉毒素B1(AFB1)标准曲线的测定[13-15]
利用ELISA法对AFB1绘制标准曲线,AFB1浓度分别为0、1.0、2.5、5、10、20 μg/kg,利用RIDAWIN 软件进行数据处理,绘制标准曲线(见图1)。

图1 黄曲霉毒素B1标准曲线
1.8 菌体浓度OD600吸光度值标准曲线
取稳定期菌液,测定发酵液活菌数,同时按不同的设定稀释倍数(5、10、20、30、40倍),依次进行稀释,以空白发酵培养基进行0 位测试,测定OD600吸光值,绘制标准曲线。
1.9 不同碳源对目标菌株QR-015 降解黄曲霉毒素B1(AFB1)发酵的影响
试验选用碳源为葡萄糖、蔗糖、果糖、淀粉、麦芽糖、乳糖、糖蜜分别为发酵培养基的碳源,加入20 g,代替基础培养基中的葡萄糖,以5%接种量接种到100 ml培养基中,pH值6.5,150 r/min,33 ℃发酵培养,以目标菌株菌体OD600吸光值和AFB1降解率为检测值。
1.10 不同氮源对目标菌株QR-015 降解AFB1 发酵的影响
试验所用氮源为牛肉膏、蛋白胨、酵母浸粉、豆粕、尿素、硝酸铵、硝酸钠,按照1%的添加量分别代替基础培养基中的蛋白胨,以5%接种量接种到100 ml培养基中,pH 值6.5,150 r/min,33 ℃发酵培养,以目标菌株菌体OD600吸光值和AFB1降解率为检测值。
1.11 不同发酵培养条件对目标菌株QR-015 降解AFB1发酵的影响
1.11.1 发酵温度对目标菌株QR-015 降解AFB1 发酵的影响
50 L 发酵罐中装入30 L 发酵培养基,调节pH 值6.5,火焰条件下,接入5%的种子液,分别在25、28、31、34、37、40 ℃下,150 r/min,通气量2.5 m3/h,培养36 h,测定菌液OD600吸光值,AFB1降解率为检测值。
1.11.2 通气量对目标菌株QR-015 降解AFB1 发酵的影响
50 L 发酵罐中装入30 L 发酵培养基,pH 值6.5,火焰条件下,接入5%的种子液,发酵温度34 ℃,通气量分别为1、1.5、2、2.5、3 m3/h,转速150 r/min,培养36 h,测定菌液OD600吸光值,AFB1降解率为检测值。
1.11.3 接种量对目标菌株QR-015 降解AFB1 发酵的影响
50 L 发酵罐中装入30 L 发酵培养基,pH 值6.5,火焰条件下,接种量分别按照3%、4%、5%、6%、7%、8%接种,发酵温度34 ℃,通气量2.5 m3/h,转速150 r/min,培养36 h,测定菌液OD600吸光值和AFB1降解率为检测值。
1.12 菌株QR-015生长曲线的测定
选取AFB1 降解效果显著的QR-015 进行发酵试验,将QR-015接种到经筛选的培养基中,按照优化的发酵条件进行培养,测定其发酵生产曲线,在火焰条件下,以5%接种量接种到含有30 L 发酵培养基的发酵罐中,33 ℃、150 r/min、pH 值6.5,通气2.5 m3/h 培养,按照编号每隔2 h测定菌体OD600吸光值和发酵液pH值变化。
2 结果与分析
2.1 可降解黄曲霉毒素B1(AFB1)目标菌株初筛
通过以香豆素为唯一碳源的培养基初筛,从浙江中科院应用技术研究院土壤样品、浙江大学饲料所土壤样品,动物粪便,发酵食品,腐烂朽木,霉菌浸染小麦、玉米、麸皮这些样品中分离获得20 株菌株,并分别编号为QR-001 至QR-020,其生长情况及AFB1 降解情况见表1。

表1 可降解黄曲霉毒素B1目标菌株初筛情况
2.2 可降解黄曲霉毒素B1(AFB1)目标菌株复筛
通过初筛获得QR-001、QR-012、QR-015、QR-016、QR-019五株可降解AFB1的菌株,所以选择这四株菌进行复筛试验,研究结果表明QR-015 AFB1 降解率可以达到85.96%,具体试验结果见表2,在后面的试验研究中选择AFB1 降解率最优的菌株QR-015进行发酵碳源、氮源、培养条件的优化。

表2 降解黄曲霉毒素B1菌株的复筛结果
2.3 菌体浓度OD600吸光度值标准曲线
取稳定期菌液,测定发酵液活菌数,设定稀释倍数5、10、20、30、40 倍5 个梯度进行稀释,以空白发酵培养基进行0 位测试,以OD600吸光值为横坐标,以相应的菌体浓度107cfu/ml 为纵坐标,绘制标准曲线,QR-015菌体标准曲线见图2,相关系数0.999 3。

图2 QR-015菌体OD600标准曲线
2.4 不同碳源对目标菌株QR-015 降解黄曲霉毒素B1(AFB1)发酵的影响(见图3)
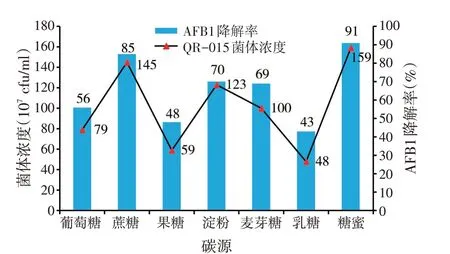
图3 不同碳源对目标菌株QR-015降解黄曲霉毒素B1发酵的影响
从图3 可以看出,QR-015 在以糖蜜为碳源时其菌体浓度以及AFB1降解率明显高于其他碳源,其菌体浓度为1.59×109cfu/ml,AFB1降解率最高,达到91%,依次为蔗糖、淀粉、麦芽糖、葡萄糖、果糖、乳糖。最终确定糖蜜为QR-015发酵降解AFB1的最适碳源。
2.5 不同氮源对目标菌株QR-015 降解黄曲霉毒素B1(AFB1)发酵的影响(见图4)
试验选取牛肉膏、蛋白胨、酵母浸粉、豆粕、尿素、硝酸铵、硝酸钠进行试验,从图4 可以看出,QR-015在以豆粕为氮源时其菌体浓度以及AFB1降解率明显高于其他碳源,其菌体浓度为1.53×109cfu/ml,AFB1降解率达到93%,依次为酵母浸粉、蛋白胨、牛肉膏、尿素、硝酸铵、硝酸钠,最终确定豆粕为QR-015 发酵降解AFB1最适氮源。
2.6 发酵温度对目标菌株QR-015 降解黄曲霉毒素B1(AFB1)发酵的影响(见图5)
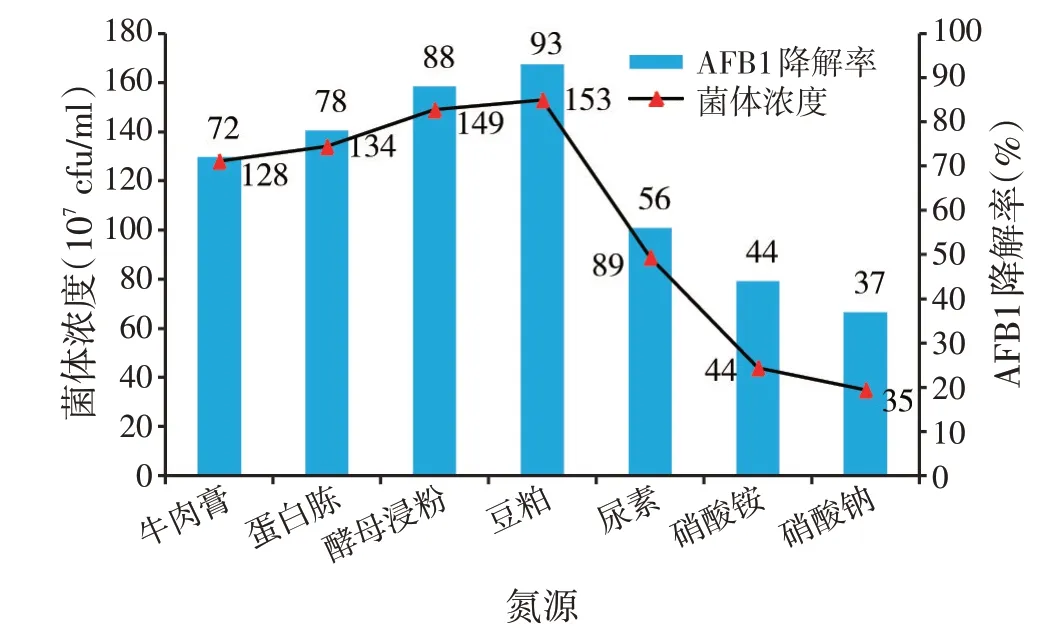
图4 不同氮源对目标菌株QR-015降解黄曲霉毒素B1发酵的影响
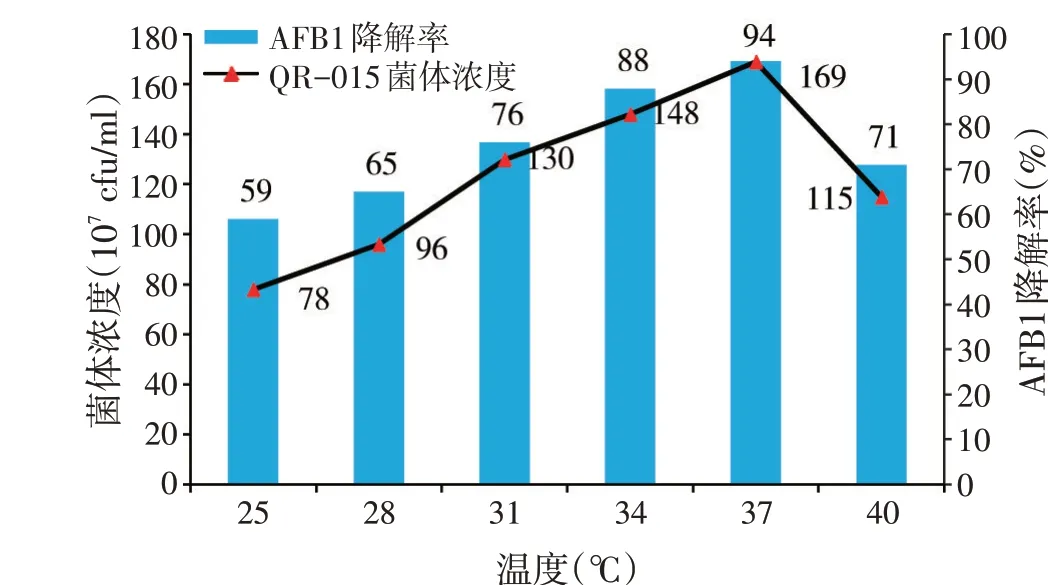
图5 不同发酵温度对目标菌株QR-015降解黄曲霉毒素B1发酵的影响
由图5 可知,发酵温度在25~37 ℃时,目标菌株QR-015菌体浓度和AFB1降解率和温度正相关,发酵温度在37 ℃时,菌体浓度和AFB1 降解率达到最大值,分别为1.69×109cfu/ml、94%,当发酵温度超过37 ℃时,菌体浓度和AFB1 降解率呈现下降趋势,由于发酵温度已超过其最适发酵温度,使菌体增殖以及AFB1降解酶产生受阻。
2.7 通气量对目标菌株QR-015 降解黄曲霉毒素B1(AFB1)发酵的影响(见图6)
由图6 可知,通气量在1~2.5 m3/h,菌体浓度和AFB1 降解率随通气量的增加而增长,但是增长趋势逐渐变缓,2.5 m3/h 时,菌体浓度和AFB1 降解率达到最大值,分别为1.59×109cfu/ml、90%,这是由于随着通气量的增大发酵液中的溶氧逐渐达到饱和,溶氧已经不是目标菌株增殖的限制因子。
2.8 接种量对目标菌株QR-015 降解黄曲霉毒素B1(AFB1)发酵的影响(见图7)
由图7可知,目标菌株QR-015在接种量3%~4%时,菌体浓度和AFB1降解率呈现上升趋势,接种量在4%时达到最大值,分别为1.62×109cfu/ml、84%,当接种量超过4%时,菌体浓度和AFB1降解率呈现下降趋势,接种量大,菌体发酵基数大,在发酵初期加速了营养物质和溶氧的消耗,随着发酵的进行,不足以提供菌株发酵所需的营养需求。

图6 不同通气量对目标菌株QR-015降解黄曲霉毒素B1发酵的影响

图7 不同接种量对目标菌株QR-015降解黄曲霉毒素B1发酵的影响
2.9 响应面优化目标菌株QR-015 降解黄曲霉毒素B1(AFB1)发酵工艺
根据单因素试验结果,运用Box-Behnken 设计原理,以发酵温度(A)、通气量(B)和接种量(C)设计三因素三水平响应面试验,并用-1、0、1代表编码水平,试验过程中发现菌体浓度同AFB1降解率在图表中发展变化趋势相近,确定以AFB1降解率(Y)为响应值,各因素水平及试验结果见表3、表4。

表3 响应面设计的因素与水平
利用Design-Expert8.0 软件对目标菌株QR-015发酵工艺进行最优化,结果见表5。

表4 Box-Behnken试验设计及结果
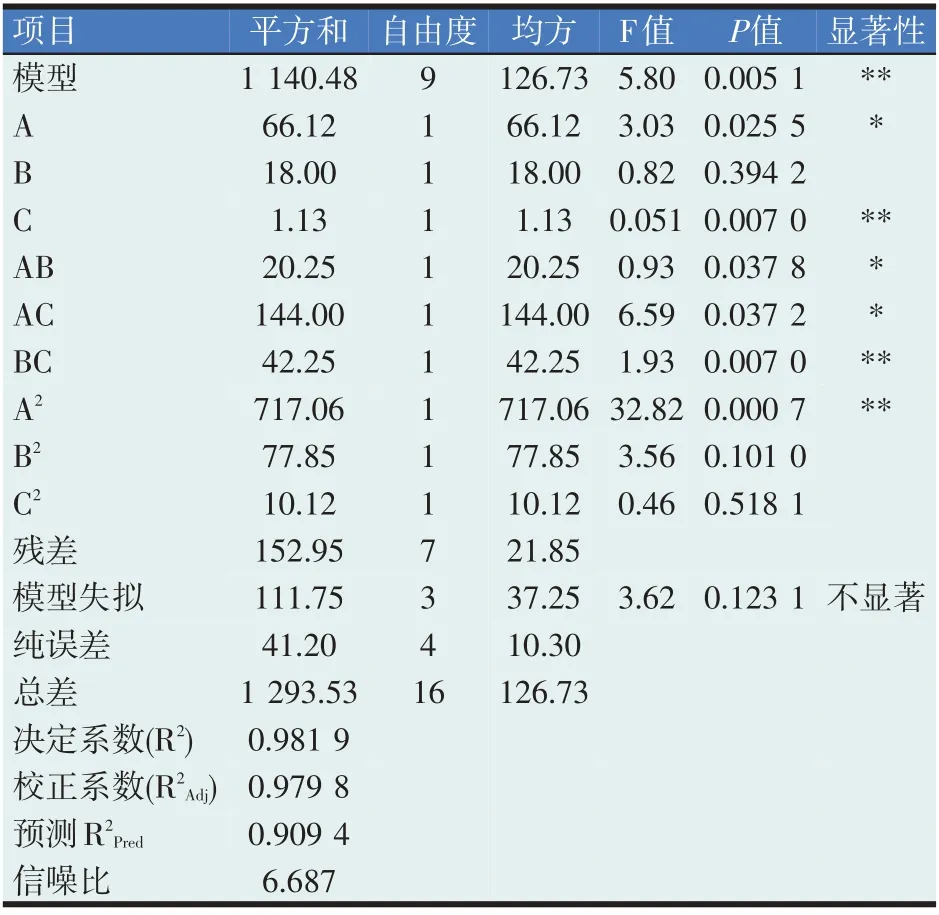
表5 回归模型方差分析
数学模型经二次回归拟合,得回归方程预测模型:
Y=93.6-2.87A-1.5B-0.38C-2.25AB+6AC-3.25BC-13.05A2-4.3B2-1.55C2
拟合方程的二次项系数为负值,抛物线开口朝下,这说明拟合得到的方程有极大值点。
拟合方程方差分析见表5,模型的决定系数R2值为98.19%,说明回归方程可以很好地反映发酵条件对目标菌株QR-015 发酵产酶降解AFB1 的影响,可以用回归方程来代替真实试验点来对液体发酵进行分析和预测。校正系数R2Adj值为97.98%,说明模型只有2.02%的概率不能解释响应面值的变化。失拟项P值0.123 1 不显著,说明所得方程与实际拟合中的非正常误差所占的比例小,另外模型各项A、B、C、AB、AC、BC、A2、B2、C2中除B、B2、C2不显著外,其余项都显著。说明拟合方程对液体发酵提供了一个很好分析预测模型。
利用Design-Expert 8.0 软件对二次回归模型进行分析,得到发酵温度、通气量、接种量3个因素之间的立体分析图。图8~图10 分别代表发酵温度、通气量、接种量3个因素之间的响应面图。结合图8~图10及Design-Expert 8.0 软件综合分析得到目标菌株QR-015 液体发酵降解AFB1 最大值点:发酵温度36.5 ℃、通气量2.16 m3/h、接种量3.58%,此时降解率达到最大98%(预测值)。
为了验证所建立模型预测值与实际值之间的拟合度,对发酵温度36.5 ℃、通气量2.16 m3/h、接种量3.58%进行3组平行发酵试验验证,实测AFB1降解率均值97.5%,与预测结果相近,说明预测值与实际值有着良好的拟合性,优化方案符合实际。
3 讨论
全价配合饲料、饲料加工原料、田间粮食等普遍存在多种霉菌毒素,多种霉菌毒素的复合协同作用给我们日常的生产活动带来一系列的影响。为了降低霉菌毒素带来的经济损失,减少并消除霉菌毒素在动物体内的蓄积,本项目建立可降解霉菌毒素的枯草芽孢杆菌筛选方法,通过试验筛选出5株可降解黄曲霉毒素B1(AFB1)的枯草芽孢杆菌菌株。
随着科研人员对降解AFB1菌株的广泛而深入的研究,越来越多的高效降解AFB1菌株被发现,如枯草芽孢杆菌、乳酸菌、地衣芽孢杆菌、黑曲霉菌等。Peltonen等[16]研究乳酸菌对AFB1的降解作用,结果表明,二株噬淀粉乳杆菌和1株鼠李糖乳杆菌对AFB1的有效降解率均在一半以上。Moyne[17]从自然界分离筛选出一株对AFB1 降解效果明显的枯草芽孢杆菌,并将其命名为AU195,通过不断地试验分离从该菌发酵液中获得一种新的活性物质bacillomycin D。朱新贵等[18]研究多种益生菌对AFB1 的去除效果,结果证实在这些益生菌中以枯草芽孢杆菌去除AFB1的作用最强。孙玲玉等[19]从泰山土壤中分离出高效降解AFB1的泰山枯草芽孢杆菌。动物消化道内的微生物具有降低毒素的吸收、降解毒素的能力,因此选取肠道、粪便筛选AFB1降解菌株。雷元培等[20]从动物肠道分离株中筛选出的枯草芽孢杆菌可高效降解黄曲霉毒素B1、G1和M1。

图8 发酵温度和通气量对QR-015发酵降解黄曲霉毒素B1响应面图

图9 接种量和发酵温度对QR-015发酵降解黄曲霉毒素B1响应面图

图10 接种量和通气量对QR-015发酵降解黄曲霉毒素B1响应面图
本研究通过从土壤样品、动物粪便、发酵食品、腐烂朽木、霉菌侵染小麦、玉米、麸皮等中纯化的枯草芽孢杆菌菌种QR-001 至QR-020,进行培养和分离,目的是找到能高效、安全降解AFB1 的菌株。自然界里存在各种各样的细菌,有其存在的天然优势,是筛选优良菌株的天然来源。
香豆素作为唯一碳源和能源的培养基,利用其AFB1 的结构相似性,用毒性较小的香豆素替代剧毒的AFB1,作为初筛降解菌的底物,是安全可行的选择[21]。徐海军等[22]利用该种方法筛选得到一株对AFB1 降解率达95.6%的高效菌株。本研究经过初筛获得QR-001、QR-012、QR-015、QR-016、QR-019 五株菌株,在只有香豆素作为碳源的培养基中生长良好,继续接种到复筛培养基中培养,发现QR-015菌株对AFB1 的降解率可以达到85.96%。试验选用的ELISA 方法检测AFB1 的含量,对于样品的前处理操作简便,安全性高,可控性强。
在对培养基进行筛选时,优选糖蜜及豆粕为QR-015 发酵最适碳氮源,AFB1 降解率可分别达到91%、93%,较王威等[23]研究采用玉米芯粉和胰蛋白胨为碳氮源时AFB1 降解率79.64%、80.65%有所提高,较关心等[24]研究的利用香豆素筛选出的降解AFB1 的菌株,降解率83%有所提高。
本项目研究从试验方案建立、目标菌株QR-015培养基组分筛选、培养条件优化等方面展开研究,最终优化得到QR-015 最佳降解AFB1 发酵工艺,此时降解率可达到97.5%,较目前研究报道AFB1 生物降解率有了一个较大的提升,同时本研究筛选得到的QR-015 目前已经开展了相关产品开发试验,本项目研究也为其产业化应用打下基础。
4 结论
①对筛选得到QR-015 可降解AFB1 菌株,通过对QR-015 碳源及氮源试验,确定糖蜜为其发酵最适碳源,菌体浓度为1.59×109cfu/ml,AFB1 降解率达到91%,确定豆粕为其发酵最适氮源,菌体浓度为1.53×109cfu/ml,AFB1降解率达到93%。
②在对QR-015发酵条件优化时,在单因素试验基础上对QR-015 发酵条件进行中心复合试验设计,确定了QR-015 发酵最适发酵条件:发酵温度36.5 ℃、通气量2.16 m3/h、接种量3.58%,AFB1降解率达到97.5%,比优化前有所提高。

