PDMS-玻璃微流控芯片上HepG2 细胞培养条件研究
王 彪, 周新丽
(上海理工大学 医疗器械与食品学院,上海 200093)
微流控芯片技术通常指的是在几平方厘米的载体上实现微纳水平流体的操控与反应的科学技术[1]。在生物医学领域,该技术已在核酸、蛋白、细胞以及类组织、器官等多个层次的研究与应用方面取得了突破性进展[2-3]。尤其是芯片上基于细胞的实验,在细胞分析、体外组织与器官的模拟、药物筛选等方面具有应用潜力[4]。芯片上的细胞实验前提之一是有效的芯片上细胞培养。然而,与采用培养皿、培养瓶等传统宏观状态下的细胞培养相比,微流控芯片上的细胞培养在载体的形式与材料特性、培养体系的比表面积等方面存在显著差异[5-6]。长期的体外细胞培养表明,对于黏附型生长细胞,附着表面的理化特性对细胞的黏附、增殖、分化等过程具有重要影响,亲水性表面更易于细胞的黏附增殖[7];此外,培养体系的比表面积显著作用于细胞的生长微环境,随着体系比表面积的增大,细胞与微环境间质能交换活动加强,基质中营养物质消耗加快、代谢废物更易积累[6];培养基组分及更换频率同样是细胞培养过程中的关键因素,提高基质中血清、生长因子浓度往往能够促进细胞更快地生长。上述微流控芯片上细胞培养与传统细胞培养之间的差异导致芯片上细胞的生长行为发生改变[8]。因此,实现芯片上细胞的有效培养必须在参考传统细胞培养方案的基础上进行相应调整。
目前,用于细胞培养的微流控芯片材质主要有聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)、聚苯乙烯、玻璃等,结构设计主要有微通道、微腔室及两者的组合等多种形式,并实现了鼠成纤维细胞(Ng3T3)、人肺癌细胞(PLETCs)以及诱导多能干细胞(iPSC)等多型细胞的芯片上二维(2D)或三维(3D)、静态或灌注等方式的培养[9-12]。PDMS、玻璃由于易加工成型、价格低廉、透光等优点通常被用于细胞培养芯片的制作,然而,PDMS 存在未聚合单体渗漏、非特异性分子吸附等缺点,玻璃表面不易于细胞的长期黏附生长,因此,PDMS、玻璃等材料在用于芯片上细胞培养之前必须进行相应的表面处理[9]。文献[13-14]通过化学接枝的方式对PDMS 进行表面改性,促进了细胞的黏附与增殖,但这些方法涉及多步化学反应,增加了方案的复杂性。Jastrzebska 等[15]通过表面包被聚赖氨酸(poly-L-lysine,PLL)、纤连蛋白(Fibronectin,FN)、胶原蛋白(Collagen)的方式促进了Balb 3T3/c,HMEC-1,HT-29 细胞在PDMS 表面的黏附与增殖能力;Yoshimitsu 等[16]采用纤连蛋白(FN)、层粘连蛋白(Laminin)、胶原蛋白(Collagen)、明胶(gelatin)对PDMS 表面进行包被,证明了纤连蛋白、层粘连蛋白比胶原蛋白、明胶具有更强的促进人诱导多能干细胞201B7 hiPSCs 附着、增殖以及自我更新能力。处于芯片微通道/腔室中的培养体系具有较大的比表面积,单位体积基质具有更高的细胞密度,这使得细胞微环境中的营养物质消耗加快、代谢废物易于积累,因此,必须形成适当的细胞接种密度、培养基组分及更换频率以实现芯片上细胞微环境的稳定。文献[6,17]发现微观培养状态下鼠乳腺成纤维细胞对葡萄糖的消耗率是宏观培养状态下的3~4 倍,并通过模型分析指出,培养基液体层厚度为200 μm 时换液频率应当为常规培养条件下的6 倍;然而,文献[18-19]提出过高的基质更换频率不利于微通道中细胞的生长。通过实验与模型分析,Giulitti 等[20]考察了基质的连续灌注与间隔更换两种方式对PDMS 芯片微通道中鼠成肌细胞(C2C12)、人成纤维细胞(HFF)生长的影响,结果发现,快速、间隔式换液比慢速、连续灌注更有利于细胞的生长。综上,微流控芯片上细胞的培养条件需要根据具体实验进行确定。
肝癌是目前人类主要的致死疾病之一,对体外肝癌细胞的研究有利于揭示肝癌疾病的发生发展机理,同时有助于相关药物的开发筛选。已有报道进行了微流控芯片上肝癌细胞的培养与分析[21-22],但关于芯片材料、换液频率等因素对芯片上肝癌细胞培养的影响缺乏分析。本文设计制作了一种简单高通量的PDMS-玻璃微流控芯片,并进行了芯片上人肝癌细胞(HepG2)的培养,主要考察芯片材料的表面包被、细胞接种密度、培养基血清浓度以及更换频率4 个因素对芯片上细胞培养的影响,以期为微流控芯片上肝癌细胞的培养提供参考。
1 材料与方法
1.1 主要试剂、耗材与设备
人肝癌细胞株HepG2(购于上海赛百慷生物技术股份有限公司);DMEM 高糖培养基;胎牛血清(FBS);无菌PBS 液;D-Hanks 缓冲液;青链霉素(双抗);0.25%胰酶(含0.02%乙二胺四乙酸(EDTA));人层纤连蛋白(Fibronectin,200 μg/ml);聚赖氨酸(Polylysine,0.5 mg/ml);胶原蛋白粉(Collagen,来源于鱼鳞皮肤);丫啶橙(AO)染料;Sylgard184 型聚二甲基硅氧烷(美国Dow Corning 公司);HQ6100 感光干膜(长兴化工);紫外曝光灯;FM-360 覆膜机(杭州新彩办公设备有限公司);Harrick 等离子体清洗机;荧光显微镜(Nikon);细胞培养箱。
1.2 微流控芯片的设计与制作
微流控芯片由PDMS 与载玻片键合而成,上层PDMS 中含有6 条平行直通道(长×宽×高:10 mm×0.5 mm×0.1 mm),通道两端分别连接一个直径5 mm、深5 mm 的柱状储液池用于存储培养基,结构如图1 所示。芯片采用感光干膜软光刻法加工制成,具体参见文献[23],主要流程如下:首先在基板上层压100 μm 厚的感光干膜层,并通过打印机将图案在透明胶片上制成光掩膜。紫外线透过光掩膜对感光干膜照射70 s,之后用1%碳酸钠显影制成微通道阳模,再将PDMS 基质与固化剂以质量比为10∶1 混合浇铸于微通道阳模上,真空60 ℃下固化3 h。剥离固化后的PDMS 基片,利用平头打孔器在微通道两端打孔形成储液池,氧等离子体表面处理后与载玻片进行不可逆键合即制成PDMS-玻璃微流控芯片。
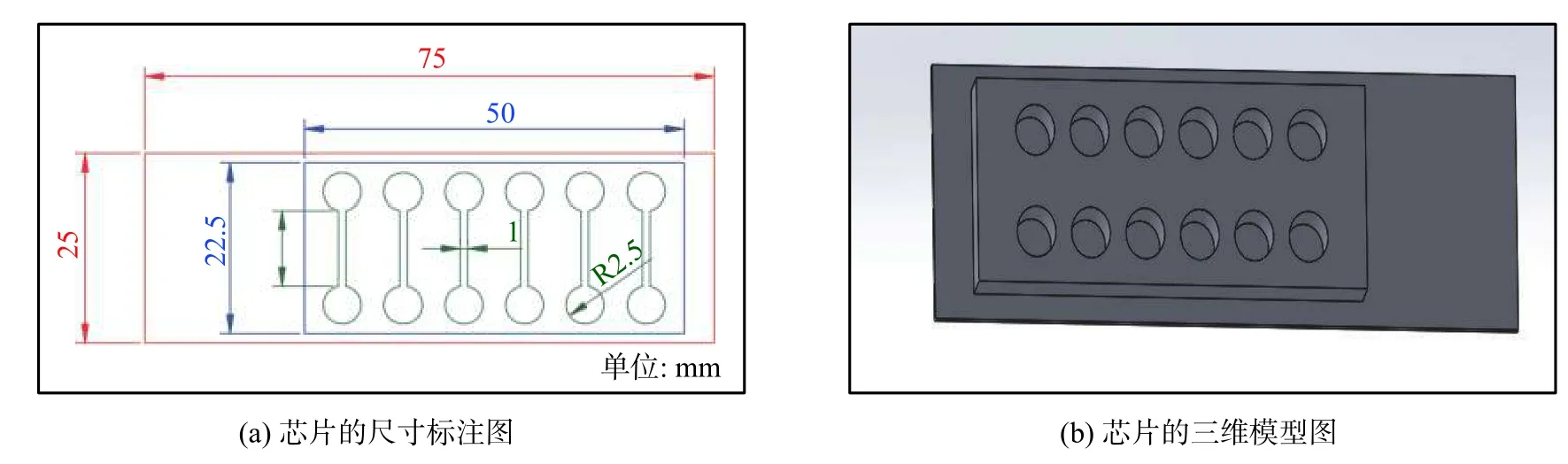
图1 PDMS-玻璃微流控芯片示意图Fig.1 Schematic of PDMS-glass microfluidic chip
1.3 HepG2 细胞的培养
对人肝癌细胞株HepG2 进行实验室常规培养,待细胞生长到80%~90%汇合度时进行胰酶处理,收集后置于离心机中1 000 r/min 离心4 min,去除上清液,加入1 ml 包含体积分数为10%的FBS 的DMEM 高糖培养基重悬细胞,将细胞悬液转入T25 培养瓶中,补加5 ml 包含体积分数为10%的FBS 的DMEM 高糖培养基后晃动培养瓶使细胞均匀分布于瓶底,后转入37 ℃,5%CO2培养箱中进行培养,用于后续传代培养或实验。
1.4 微流控芯片上HepG2 细胞生长的影响因素分析
1.4.1 包被物对芯片上HepG2 细胞生长的影响
选用纤连蛋白(FN)、聚赖氨酸(PLL)、胶原蛋白(Collagen)进行微通道底部的玻璃表面修饰,考察不同包被物促细胞生长的效果。分别配制纤连蛋白(10 μg/ml)、聚赖氨酸(0.1 mg/ml)、胶原蛋白(0.1 mg/ml)包被液。取经过灭菌烘干的芯片置于无菌培养皿内,先用无菌水冲洗一遍通道,再用移液枪吸取10 μl 包被液从通道一端注入微通道内对通道底部的玻璃表面进行包被,将含有包被液的芯片于超净台内孵育1 h 并吸出剩余包被液,后自然干燥1 h 备用。HepG2 细胞通过常规胰酶消化处理,收集离心后用培养基调整细胞密度到1.0×106个/ml。用移液枪取5 μl 细胞悬液注入芯片通道内,再将加载细胞的芯片置于培养皿内,在皿内加入适量无菌水,最后将培养皿放置于细胞培养箱中培养。待细胞于微通道内贴壁后,在通道一侧的储液池内加满培养基后继续培养,每12 h 进行换液,并于24,48 h 时对细胞形态与活性进行记录与分析。
1.4.2 细胞接种密度对芯片上HepG2 细胞生长的影响
在确定微通道表面包被物的基础上,考察不同的细胞接种密度对芯片上HepG2 细胞生长的影响。采用优化后的包被物进行通道表面包被。HepG2 细胞生长至对数期后进行常规胰酶消化处理,离心收集后用包含10%FBS 的DMEM 高糖培养基重悬并制备0.5×106,1.0×106,2.0×106个/ml这3 种细胞密度悬液。将3 种细胞悬液导入微通道进行芯片上细胞培养,待细胞生长到24,48 h时对细胞形态与活性进行记录与分析。
1.4.3 培养基血清浓度对芯片上HepG2 细胞生长的影响
考察基质中血清浓度对芯片上细胞生长的影响。以DMEM 培养基为基础液,分别配制含FBS体积分数为5%,10%,20%的完全细胞培养液。取灭菌后的芯片,芯片的包被以及细胞接种分别在上述优化的实验条件下进行,待细胞在微通道内附着后分组加入上述3 种血清浓度的培养基进行培养,每12 h 换液,待细胞生长到24,48 h时对细胞形态与活性进行记录与分析。
1.4.4 培养基更换时间对芯片上HepG2 细胞生长的影响
进一步考察培养基更换的时间间隔对芯片上细胞生长的影响。在上述优化条件的基础上进行芯片上HepG2 细胞的培养,分别设置8,16,24 h这3 种培养基更换时间间隔并进行分组实验,待培养48 h 后对细胞形态与活性进行记录与分析。
1.5 微流控芯片上与传统6 孔板中HepG2 细胞生长曲线对比
在上述4 种培养条件优化的基础上进行微流控芯片上HepG2 细胞的培养,并与传统的6 孔板上细胞培养进行对比,考察两种培养方式下细胞生长结果的异同。取对数生长期的HepG2 细胞进行胰酶消化处理,离心收集后重悬。为了增加两种方案的可比性,通过调整接种细胞悬液的细胞密度来控制两种培养方式的起始细胞面密度相近,约为100 个/mm2。芯片上细胞培养在上述优化后的条件下进行,孔板中的细胞采用传统的细胞培养方式进行培养。分别于第2 h,1,2,3,4 d 对细胞形态与活性进行记录与分析。
1.6 细胞形态及活性分析
细胞生长形态采用倒置显微镜明场拍照,观察芯片以及孔板中的细胞形态、汇合度等。细胞活性采用丫啶橙荧光染色法确定,荧光染料丫啶橙具有细胞膜透过性,能透过细胞膜并与细胞核DNA 结合,在激发光波长488 nm 下正常细胞发绿色均匀荧光,而凋亡细胞中细胞核染色质发生固缩或断裂,与染料结合后发强荧光。根据产品说明配置0.2 μg/ml 的丫啶橙染液,待芯片上与孔板中的细胞生长到特定时间点后将培养基更换为丫啶橙染液,避光作用3 min 后于荧光显微镜下拍照记录。使用Image pro plus 软件粒子计数与分析模块对丫啶橙荧光染色图片进行细胞数目的统计分析。细胞增殖率(24 h)定义为(N2-N1)/N1,其中,N1为第一天细胞数,N2为第二天细胞数。
2 结果与讨论
2.1 通道表面不同包被物处理对HepG2 细胞附着生长的影响
对附着细胞而言,附着基质材料及其表面特性对细胞的黏附、增殖、分化等具有显著影响[7]。传统的聚苯乙烯(PS)细胞培养瓶/皿表面经过包被或等离子体处理等提高其亲水性,从而有利于细胞的黏附生长。采用纤连蛋白(FN)、聚赖氨酸(PLL)、胶原蛋白(Collagen)对芯片微通道进行表面包被,考察不同包被物的促细胞黏附生长能力。图2 为不同包被物条件下HepG2 细胞在不同时间点的明场形态图,图3 为通过细胞荧光染色分析获得的细胞增值曲线以及增殖率图。G,G/F,G/P,G/C 分别表示通道底部玻璃表面未包被、纤连蛋白(FN)、聚赖氨酸(PLL)、胶原蛋白(Collagen)包被处理。

图2 不同包被物作用下微通道中HepG2 细胞12,24,48 h 明场形态图Fig.2 Bright field morphology of HepG2 cells in microchannels at 12, 24, and 48 h under the action of different coatings
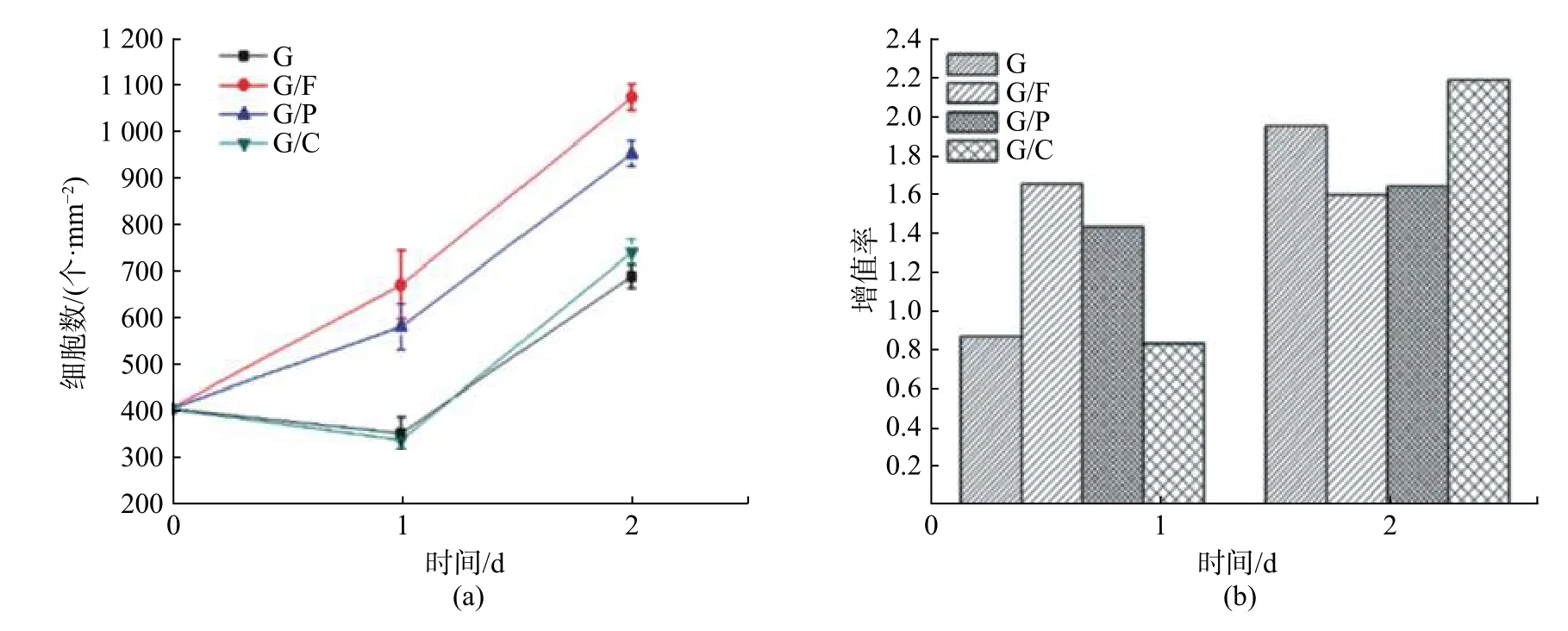
图3 不同包被物处理下HepG2 细胞的增殖曲线以及增殖率图Fig.3 Proliferation curve and proliferation rate of HepG2 cells under different coating treatments
从图2 中可以看出,随着培养时间的延长,各组细胞在微通道中均逐渐铺展开来,纤连蛋白包被组较聚赖氨酸、胶原蛋白包被以及未包被组具有更充分的细胞铺展形态以及更高的汇合度。图3 显示了不同包被物质作用下HepG2 细胞的增值曲线以及增殖率。第一天,纤连蛋白包被下的HepG2 细胞具有最高的增殖率,高于聚赖氨酸、胶原蛋白组;胶原蛋白与未包被组相似,在第一天时细胞数有所降低,可能是由于一些未贴壁细胞凋亡坏死后在通道内随着换液而流失。第二天,各组细胞数均呈现增加,但是,纤连蛋白、聚赖氨酸两组细胞的增殖率较胶原蛋白与未包被组低,这是由于前两组在第一天细胞已增加到一定密度,第二天细胞增殖会较早地达到接触抑制的状态,进而降低了增殖率。实验结果显示,纤连蛋白具有比聚赖氨酸以及胶原蛋白更好的促细胞贴壁生长能力,这与Jastrzebska 等[15]和Yoshimitsu等[16]对PDMS 表面包被以促进芯片上细胞生长的研究结果一致。
2.2 细胞接种密度对HepG2 细胞芯片上生长的影响
长期的体外细胞培养实践表明,细胞起始接种密度会对细胞群体的黏附增殖产生明显的影响,较高的细胞接种密度有利于细胞群体的黏附增殖,而较低的细胞起始密度下细胞生长相对缓慢。为考察不同细胞接种密度对微流控芯片上细胞培养的影响,实验设置了0.5×106,1.0×106,2.0×106个/ml 这3 种细胞加载密度,并获得了各细胞加载密度下芯片上细胞的增值曲线以及增殖率,如图4 所示。
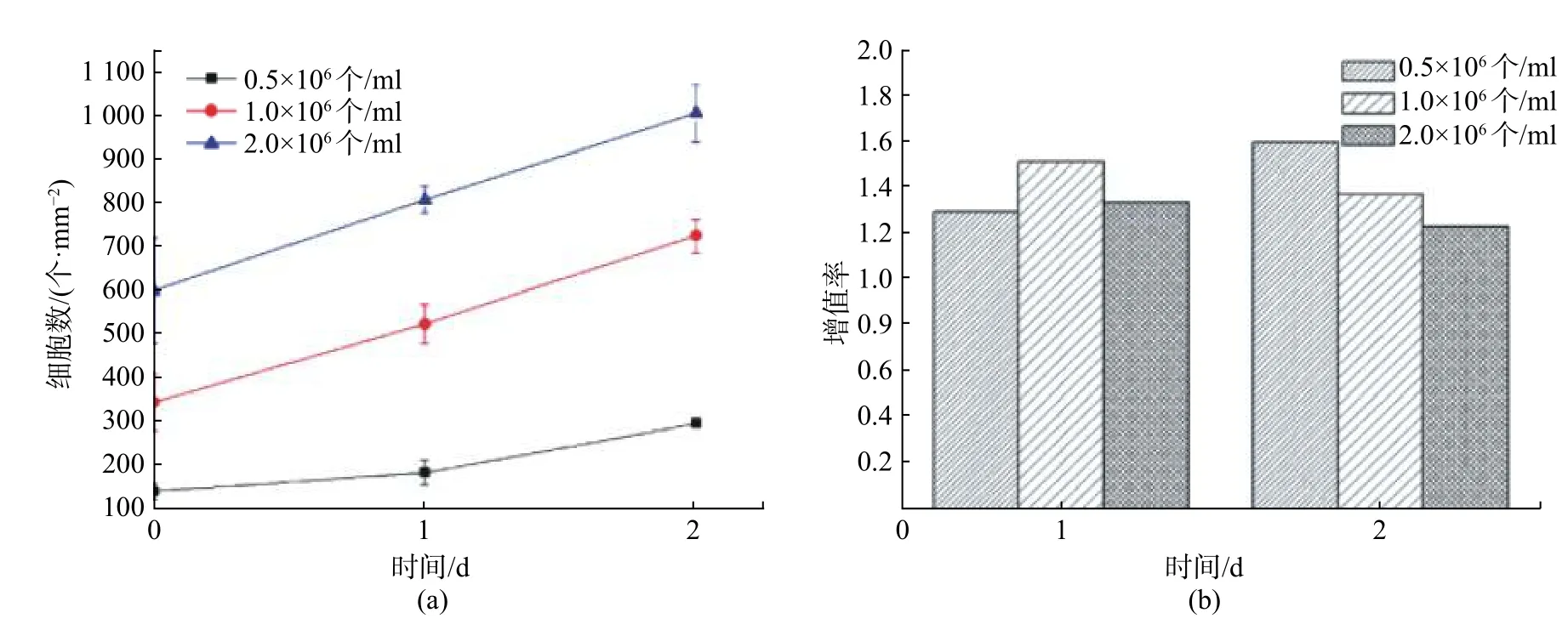
图4 不同细胞接种密度条件下HepG2 细胞的增值曲线与增殖率图Fig.4 Proliferation curve and proliferation rate of HepG2 cells under different cell seeding density
从图4 中可以看出,第一天1.0×106个/ml 组细胞具有最高增殖率,这是由于0.5×106个/ml 组细胞密度过低,细胞间相互促进生长的作用不够强,而2.0×106个/ml 组细胞可能由于过高的细胞密度导致微环境中的营养物质消耗过快,限制了细胞的进一步生长;第二天各组细胞增殖率均发生了变化,0.5×106个/ml 组细胞增殖率相对第一天升高,并明显高于其他两组,而1.0×106个/ml 与2.0×106个/ml 组细胞增殖率均出现降低,这是由于0.5×106个/ml 组细胞经过一天的培养已在通道中稳定下来并且细胞数有所增加,这为第二天的快速生长奠定了基础,而1.0×106个/ml 与2.0×106个/ml组细胞经过第一天的培养细胞数已有较大提升,在第二天的生长过程中,由于空间受限、接触抑制等因素出现生长速率放缓,并且这一趋势随着细胞密度的增加而更加明显。上述结果与Yu 等[24]对不同起始密度条件下微通道中粘虫卵巢细胞(Sf9)生长行为的观察具有相似性。
2.3 血清浓度对芯片上HepG2 细胞生长的影响
体外动物细胞培养过程中一般在培养基质中添加体积分数为10%~20%的血清(常见的有牛血清、马血清等)以促进细胞的黏附与增殖。培养基的组分比较复杂,并且其品质随着产地及工艺而不同,但关键成分都包括血清、氨基酸、维生素等几类物质。为了考察培养基质中不同体积分数血清(胎牛血清FBS)对芯片上HepG2 细胞生长的影响,以DMEM 高糖培养基为基础液分别配制含FBS 体积分数为5%,10%,20%的完全培养基进行芯片上HepG2 细胞的培养,细胞在微流控芯片上的增值曲线以及增殖率如图5 所示。
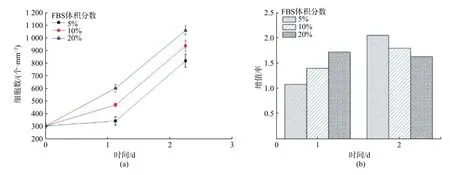
图5 不同基质血清浓度条件下HepG2 细胞增殖曲线与增殖率图Fig.5 Proliferation curve and proliferation rate of HepG2 cells under different matrix serum concentration
从图5 中看到,随着血清体积分数的增加,单位面积上的活细胞数逐渐增加。第一天,随着血清浓度的提高,细胞增殖率增加,第二天则呈相反趋势,但只有FBS 体积分数为20%的实验组细胞第二天细胞增殖率低于第一天,这是由于经过一天的生长,FBS 体积分数为20%的实验组细胞已具有较高的细胞密度,在第二天的培养过程中较早产生了竞争以及接触抑制效应,抵消了较高血清浓度带来的生长优势,进而使细胞增殖率降低。这表明提高基质血清体积分数有利于微通道中细胞的生长,这与Su 等[18]对微通道中人胚肾细胞的研究结果一致。
2.4 不同换液频率对HepG2 细胞芯片上生长的影响
传统的细胞培养模式中培养皿/瓶内预留足量的培养基提供细胞生长所需的营养物质,一般经过2~4 d 进行培养基更换。微通道中的培养体系具有较大的比表面积,单位体积培养基质内细胞密度相对较高,营养物质消耗较快,代谢废物易于积累,因此,必须明确芯片上培养基更换时间间隔以维持细胞微环境的稳定。本实验采用微通道内静态培养的方式,培养基间歇式更换,设置了8,16,24 h 这3 个换液时间间隔,细胞在微流控芯片上的增值曲线以及增殖率如图6 所示。
在不同的换液频率条件下,细胞经过24 h 培养后附着铺展于通道内,但仍未铺满整个通道,继续培养至48 h 各组细胞均覆盖整个通道底面,并且可以看出,随着换液频率的增高,细胞密度略微升高。从图6 中可以看出,经过48 h 培养后,每8 h换液组的细胞数显著高于每16,24 h 换液组的细胞数,而后两组无显著差异,这是因为较高的换液频率能够为通道内的细胞及时提供充足的营养物质,并及时清除微环境中积累的代谢废物,进而有利于细胞增殖,但换液时间间隔超过一定限度后,由于代谢废物积累产生的不利因素平衡了基质更换带来的促进因素,故后两组无显著差异。这一结果验证了Young 等[6]通过模型分析芯片上换液时间所得出的结论。
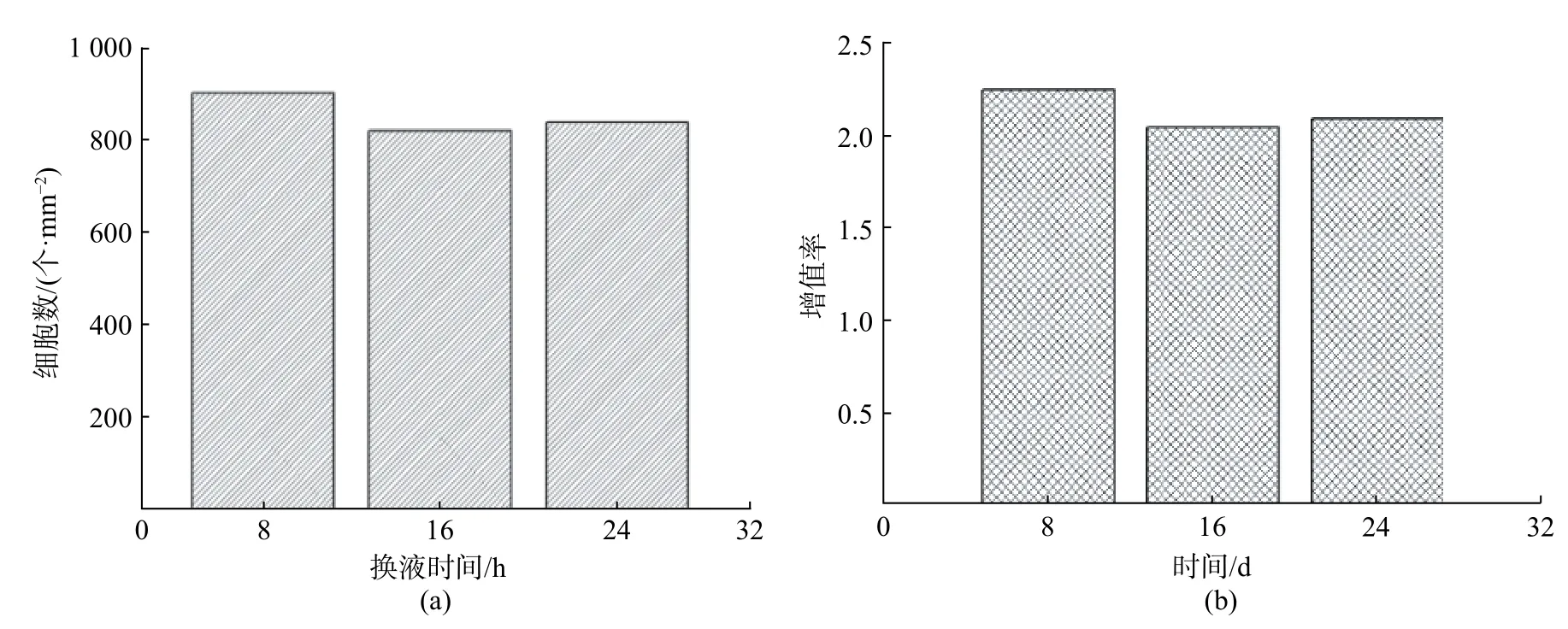
图6 不同换液时间间隔条件下的细胞数与增殖率图Fig.6 Number of cells and proliferation rate under different medium exchange interval
2.5 微流控芯片与传统孔板上HepG2 细胞生长的比较
在上述实验条件优化的基础上,进行芯片上HepG2 细胞的培养,并与传统的6 孔板细胞培养进行比较。芯片采用纤连蛋白包被、基质血清的体积分数为20%、换液时间为8 h;孔板细胞培养在常规条件下进行。两组细胞分别在第2 h,1,2,3,4 d 时进行明场/荧光拍照记录,细胞明场形态如图7 所示。
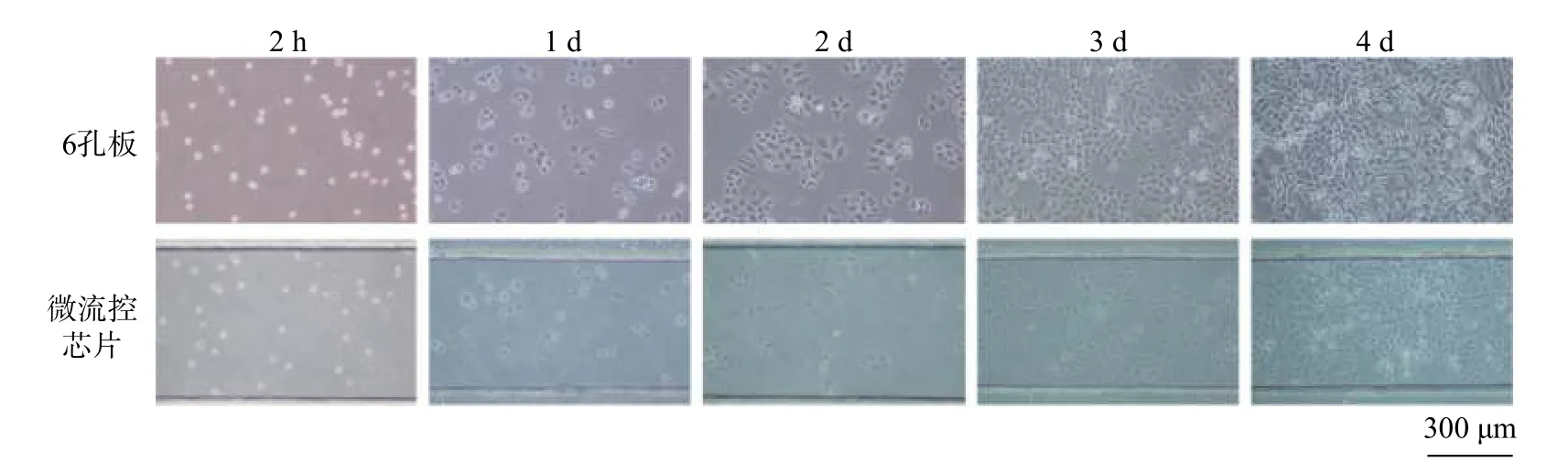
图7 6 孔板/微流控芯片上HepG2 细胞不同时间点(2 h,1,2,3,4 d)的明场形态图Fig.7 Brightfield morphology of HepG2 cells on 6-well plates and microfluidic chip at different time point(2 h, 1, 2, 3, 4 d)
根据细胞荧光染色获得孔板/芯片细胞增值曲线与增殖率如图8 所示,芯片上细胞增值曲线位于孔板细胞增值曲线之下,表明在培养起始阶段芯片上细胞的生长速率较孔板为低,但两曲线在第4 天时近乎相交,即两种培养方式最终产生相近的细胞密度,这一现象与细胞明场形态相吻合。第一天芯片上细胞密度下降是由于较小细胞密度下部分细胞凋亡坏死并在基质更换时被流体带走所致。从两种培养方式下每天的细胞增殖率可以看出,孔板中的细胞增殖率先增大后降低,这与经典的细胞增殖曲线相吻合;芯片上的细胞增殖率则不断增加,这是由于实验观测时间较短,细胞对数生长期还未完全结束所致,预计后期增殖率会回落。Yu 等[24]将芯片上与传统细胞培养瓶中的Sf9 细胞生长行为进行了对比,观察到了与本文相似的结果。
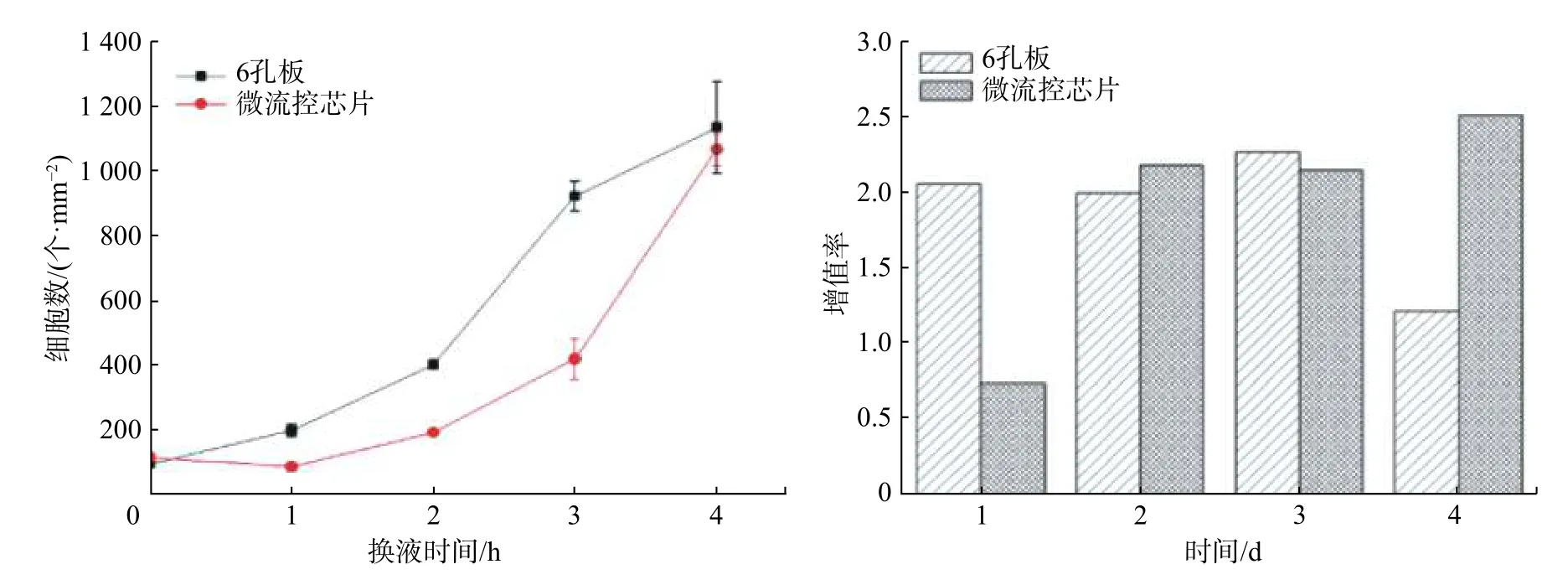
图8 6 孔板和微流控芯片上细胞的增殖曲线与增殖率图Fig.8 Proliferation curve and proliferation rate of cells on 6-well plates and microfluidic chip
3 结 论
微流控芯片上细胞的培养是芯片上细胞实验的前提之一。本文设计制作了一种简单高通量的PDMS-玻璃微流控芯片,并进行了芯片上人肝癌细胞HepG2 培养条件的研究,主要考察了芯片材料的表面包被、细胞接种密度、培养基血清浓度与更换频率这4 个因素对芯片上HepG2 细胞培养的影响。结果发现,采用纤连蛋白(FN)进行通道表面包被,调整细胞接种密度在1.0×106~2.0×106个/ml 之间,提高培养基中血清体积分数到20%,并控制培养基更换时间在8~16 h 之内,能够形成优化的芯片上HepG2 细胞培养方案,且该方案与传统孔板中的HepG2 细胞培养具有相同的增殖趋势、增殖率。与其他芯片上肝癌细胞培养与分析的报道相比,本研究采用的芯片结构简单,能进行多通道平行实验,并且能够更全面地对影响芯片上细胞培养的因素进行分析,为芯片上肝癌细胞以及其他类型细胞的培养提供了参考,对芯片上肝癌细胞实验的开展具有潜在促进作用。

