钆塞酸二钠增强MRI与多期动态增强MSCT对诊断结直肠癌肝转移的比较研究
汤彪,李宏芸,朱凡,熊敏超
结直肠癌是消化系统最常见的肿瘤之一,该肿瘤位居全球肿瘤发病率的第三位,死亡率的第二位[1]。肝脏是结直肠癌最主要的转移器官,35%~55%的结直肠癌患者在疾病进程中会发生肝转移,此乃造成结直肠癌患者死亡的主要原因之一[2]。相关研究表明,完整的切除肝转移灶或彻底的消融治疗是治愈结直肠癌肝转移患者唯一有效的手段,能明显提高患者的生存率[3]。因此,术前精确诊断肝脏转移灶非常重要。
MSCT是一种可用于肿瘤分期和检测的诊断工具[4],MRI是一种能够评估病灶特别是小病灶(≤1 cm)形态和功能特征的诊断技术[5-6],尤其是肝细胞特异性对比剂钆塞酸二钠(gadolinium ethoxybenzyl diethylenetria-mine pentaacetic acid,Gd-EOB-DTPA)的应用有助于肝转移瘤的诊断[7]。本研究以病理诊断结果为金标准,比较Gd-EOB-DTPA 增强MRI与多期动态增强MSCT对结直肠癌肝转移的检出能力,并进一步分析两种检查方法对不同大小、不同位置转移瘤的显示差异,旨在为术前评估影像学方法的选择提供依据。
材料与方法
1.研究对象
搜集2016年1月-2019年1月在我院行结直肠癌根治性切除及肝转移瘤切除术的患者,术前同时行肝脏Gd-EOB-DTPA 增强MRI扫描和多期动态增强MSCT扫描。排除图像不全及质量不佳者,共入组结直肠癌肝转移患者64例,其中男28例,女36例,50岁以上者48例(75%),年龄中位数为57.2岁(范围34~79岁)。原发病灶为结肠癌30例,直肠癌34例;64例患者中52例于术前行新辅助化疗。
2.检查方法
Gd-EOB-DTPA增强MRI:Gd-EOB-DTPA增强MRI检查采用GE Signa HD MRI 1.5T扫描仪,8通道相控阵线圈。检查前患者空腹4~6 h,训练患者呼吸运动。扫描时患者取仰卧位,行常规FSPGR-T1WI、T2WI扫描,范围从膈顶至肝下缘,扫描参数:层厚6.0 mm,层间距1~2 mm,视野33 cm×33 cm~38 cm×38 cm。FSPGR-T1WI序列扫描参数:TR 120.00 ms,TE 2.46 ms,翻转角70°,扫描时间0.33 min,矩阵320×224。T2WI序列扫描参数:TR 3000 ms,TE 110 ms,翻转角170°,扫描时间0.38 min,矩阵260×320。DWI检查采用SE-EPI序列,扫描参数:加速因子R=2,b 值取0、500 s/mm2,TR 6700 ms,TE 91 ms,层厚4.0 mm,层间距1 mm,扫描时间0.11 min,矩阵112×128,视野33 cm×33 cm~38 cm×38 cm。采用磁共振专用压力注射器将对比剂Gd-EOB-DTPA(剂量0.025 mg/kg,注射流率2.5 mL/s)注入静脉内后30 s、60 s、90 s、20 min分别行动脉期、门脉期、平衡期及肝细胞特异期扫描。增强扫描采用三维屏气容积内插法(volume interpolated breathhold examination,3D-VIBE),扫描参数:TR 3.47 ms,TE 1.36 ms,翻转角10°,矩阵195×320,视野(38~40)cm×(30~32)cm,信号采集次数为1次,层厚3.0 mm。
多期动态增强MSCT:MSCT扫描采用GE 64排螺旋CT机。患者取仰卧位,先行平扫,再行增强扫描。扫描范围为膈顶至盆底,扫描参数:管电压120 kV,管电流250 mA,层厚5 mm,视野14 cm×14 cm~16 cm×16 cm。增强扫描采用碘对比剂碘海醇,流率3.0 mL/s,总剂量90 mL,采用高压注射器经左肘正中静脉团注入体内后30 s、60 s 和120 s行动脉期、静脉期及平衡期扫描。
3.图像分析
由两位有15年工作经验的放射科医师采用盲法共同分析患者的Gd-EOB-DTPA增强MRI和多期动态增强MSCT图像,阅片者对患者的病史和病理结果均不知情。为了减少回忆偏倚,阅片者评估每例患者的Gd-EOB-DTPA增强MRI和多期动态增强MSCT图像的间隔时间大于2周。根据转移瘤的位置将病灶分为肝被膜下、胆管旁和肝实质病灶;病灶直径取横轴面最大层面的病变长径、短径平均值。阅片者全面阅片后详细记录转移瘤的位置、直径及所在图像的图层号。
4.统计学分析
采用SPSS 19.0 软件进行统计学分析。以病理结果为金标准,将放射科医生阅片所记录结果与病理结果进行对照。计算两种影像学检查方法对肝转移瘤的检出率,并对两种影像学检查方法对不同位置、不同直径转移瘤的检出率采用计数资料的卡方检验进行统计学分析。以P<0.05为差异有统计学意义。
结 果
本组64例结直肠癌患者经病理证实共发现224个肝转移灶,患者的一般临床资料及肝转移灶特征见表1。

表1 64例患者的一般临床资料及肝转移灶特征
224个肝转移病灶中,Gd-EOB-DTPA增强MRI共检出217个病灶(图1),检出率为96.88 %;多期动态增强MSCT共检出188个病灶,检出率为83.93%,两者检出率差异有统计学意义(P<0.001)。
Gd-EOB-DTPA增强MRI和多期动态增强MSCT对肝被膜下、胆管旁和肝实质内转移灶的检出情况见表2。Gd-EOB-DTPA增强MRI对胆管旁病灶的检出率为100%(4例病灶均被检出),明显高于多期动态增强MSCT(4例病灶均未被检出),差异有统计学意义(P=0.029);2例患者的8个肝被膜下病灶Gd-EOB-DTPA增强MRI只检出1个,略高于多期动态增强MSCT(8个均未被检出),但差异无统计学意义(P=1.000)。Gd-EOB-DTPA增强MRI对于肝实质内转移灶的检出率(100%)明显高于多期动态增强MSCT(88.68%),差异有统计学意义(P<0.001)。
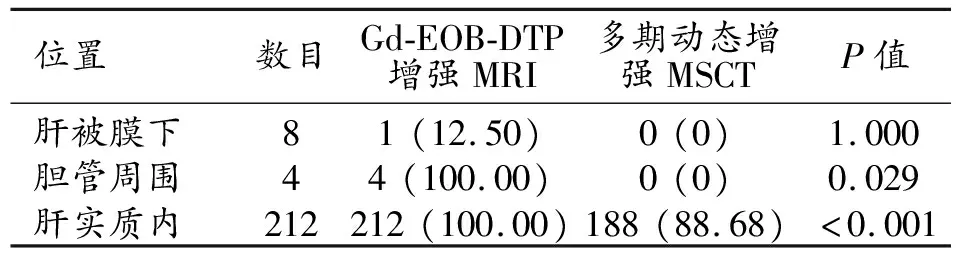
表2 两种检查方法对不同位置肝转移瘤的检出情况比较 (n,%)
Gd-EOB-DTPA增强MRI和多期动态增强MSCT对不同直径转移瘤的检出情况见表3,两者对直径≤0.5 cm和0.6~1.0 cm病灶的检出率差异有统计学意义(P值分别为0.018和0.007)。
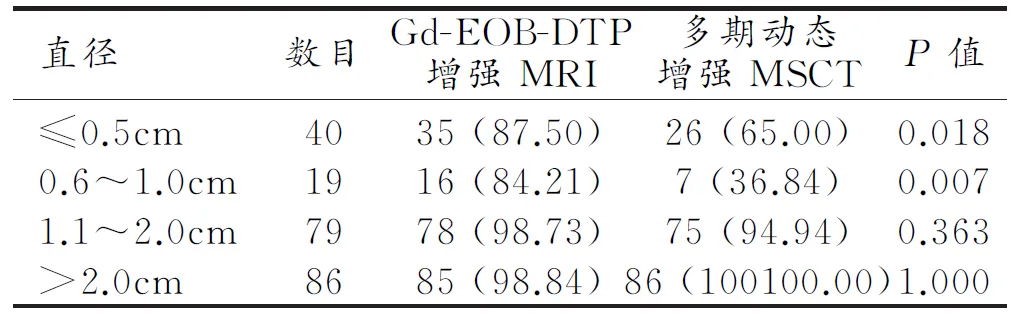
表3 两种检查方法对不同直径肝转移瘤的检出情况比较 (n,%)
Gd-EOB-DTPA增强MRI和多期动态增强MSCT对患者是否行新辅助化疗的肝转移灶的检出情况见表4,无论患者是否行新辅助化疗,Gd-EOB-DTPA增强MRI对于结直肠癌肝转移灶的检出率均显著高于多期动态增强MSCT,差异有统计学意义(P值分别为0.001和0.002);而Gd-EOB-DTPA增强MRI对于行新辅助化疗与未行新辅助化疗患者肝转移灶的检出率差异无统计学差异(P=0.424),多期动态增强MSCT对于行新辅助化疗与未行新辅助化疗患者肝转移灶的检出率差异亦无统计学差异(P=0.560)。

表4 两种检查方法对是否行新辅助化疗患者肝转移灶的检出情况 (例)
讨 论
结直肠癌肝转移患者的病情评估依赖于影像学检查,主要包括超声、CT、MR、PET/CT及PET/MR等检查。由于病灶数量、大小及位置分布等差异,各种方法均有其相对优势和不足,其中CT及MRI增强扫描是目前临床最常用的肝转移瘤检查方法。近年来,肝特异性对比剂钆塞酸二钠(Gd-EOB-DTPA)逐渐应用于临床,该对比剂具有细胞外对比剂和肝胆特异性对比剂的双重特征,能特异性与正常肝细胞结合,通过增加组织的微黏滞度来提高T1率,缩短组织T1,从而使正常肝组织在T1上呈明显高信号;而肿瘤组织不能与Gd-EOB-DTP结合,与呈明显高信号的正常肝组织相比呈低信号表现,因而可以清晰显示肿瘤。相关研究表明,Gd-EOB-DTPA肝细胞吸收率高达50.0%[8],在肝细胞特异期更利于病灶的检出,尤其是对于直径≤1.0 cm病灶[9]。本研究通过比较Gd-EOB-DTPA增强MRI与多期动态增强MSCT对肝转移瘤病灶的检出率,发现Gd-EOB-DTPA增强MRI对结直肠癌肝转移病灶的检出率明显高于多期动态增强MSCT,与既往文献报道一致[10]。
图1 直肠癌伴肝内多发转移患者,男,73岁。a)CT平扫横轴面重组图像,肝右叶隐约可见数个团片状稍低密度病灶;b)CT增强扫描动脉期示病
尽管结直肠癌胆管周围转移的发生率很低[11-12],但当病变涉及胆道系统时对患者的治疗方案如能否进行根治性手术等都不同于肝转移患者。与Gd-EOB-DTPA 增强MRI相比,多期动态增强MSCT对胆管周围转移瘤的诊断效能较低。本组4例患者的4个胆管周围转移病灶,多期动态增强MSCT均未检出,而Gd-EOB-DTPA增强MRI全部检出,分析可能与其代谢有关。相关研究表明Gd-EOB-DTPA在体内不参与生物转化,43.1%~53.2%经胆道系统排泄[11],因此Gd-EOB-DTPA增强MRI肝胆期不仅可以评价肝脏病变,也可以行胆道功能性成像,是胆道成像的基础。在评估胆道周围病变时,T2WI和DWI可以检测到较MSCT更多的病变。因此笔者认为Gd-EOB-DTPA增强MRI较MSCT能够更清楚地显示出病灶的边界、分布和数量,在MRI动态增强肝扫描中更有助于检出结直肠癌肝和胆管转移患者,值得进一步推广应用。
本研究发现Gd-EOB-DTPA增强MRI对于包膜下病灶的检出率较低,2例患者的7个包膜下病灶(直径8~15 mm,平均13 mm)未被检出,笔者认为Gd-EOB-DTPA增强MRI对包膜下病灶检出率较低的原因是病灶位于肝实性病变旁,不能通过增加病变与肝脏的对比度梯度来提高对病变的检出率;另外,这些转移病灶都很小。相反采用高软组织分辨率的序列如T2WI和DWI可提高肿瘤的检出率。Gd-EOB-DTPA增强MRI检出1个包膜下病灶,而MSCT对8个包膜下病灶(直径10~24 mm,平均15 mm)均未检出,因此笔者认为不同部位的病变以及病灶大小影响病灶对肝脏对比剂的吸收程度。同样,在这种情况下Gd-EOB-DTPA增强MRI也不能提高诊断性能,因为病变位于实质外。
本研究结果显示,Gd-EOB-DTPA增强MRI与多期动态增强MSCT对直径较大病灶(直径>1.0 cm)的检出率差异无统计学意义。但当病灶直径≤1.0 cm时,Gd-EOB-DTPA增强MRI的检出率较多期动态增强MSCT更高,笔者认为可能与以下两方面原因有关:一方面由于MRI的软组织对比度更高,更有利于微小病变的检出;另一方面Gd-EOB-DTPA能增加肝胆期病变与正常肝组织的对比度,更有利于微小病变的显示。Sano等[12]分析了108例肝脏内直径<2.0 cm的肝脏结节病变的Gd-EOB-DTPA增强MR图像,并与术后病理结果进行对照,认为Gd-EOB-DTPA增强MRI是诊断肝癌小病灶最有价值的影像检查方法。佟景明[13]通过比较Gd-EOB-DTAP增强MRI与MSCT增强扫描对结直肠癌肝转移病灶的检出率,也得出对于直径≤1.0 cm的病灶,Gd-EOB-DTPA增强MRI优于MSCT增强扫描的结论。
本研究中52例患者接受过新辅助化疗,其中20例患者的实质性转移病灶(直径8~35 mm,平均13 mm)未被多期动态增强MSCT检出。尽管新辅助化疗具有一定优势,但仍有一些与化疗相关的并发症应通过影像学检查进行评估,因为化疗会影响手术的适应症;如与化疗有关的脂肪变性、脂肪性肝炎和窦房结阻塞综合征等可能会损害肝脏,从而影响患者预后。此外,肝脂肪变性降低了肝实质与转移灶之间的对比,影响了肝病变的检出[14-15]。相关学者比较了增强MSCT与Gd-EOB-DTPA增强MRI对有脂肪变性和无脂肪变性的结直肠癌肝转移的诊断效能,结果表明在肝脂肪变性患者中,对于直径较小的结直肠癌肝转移病变,Gd-EOB-DTPA增强MRI的诊断效能高于增强CT[16]。另外,对包括906个肝脏病灶的11项研究的荟萃分析结果显示新辅助化疗之后,MRI是结直肠癌肝转移患者术前评估最合适的影像学检查方法[17]。虽然,由于MSCT应用的广泛性及标准性,大多数临床试验建议将MSCT作为新辅助治疗后评估的影像学检查方法,然而考虑到新辅助治疗后肝脂肪变性降低了肝实质与病变之间的对比差异,从而降低了MSCT的诊断效能,MSCT或许不应作为首选或唯一的诊断方法。本研究结果显示,无论患者是否行新辅助化疗,Gd-EOB-DTPA增强MRI对于结直肠癌肝转移病灶的检出率均明显高于MSCT,而MRI和CT对于行新辅助化疗与未行新辅助化疗患者肝转移灶的检出率差异均无统计学差异,与上述文献报道的由于新辅助化疗损害肝脏,影响MR 或 CT 成像特点的结论不符,分析原因可能是由于本研究采用的是1.5T MR扫描仪,获得图像的分辨率及信噪比均低于相关文献所采用的3.0T MR扫描仪,另外本研究样本量较少(64例224个病灶),存在样本来源偏倚,因而在后续研究中需加大样本量,并且从新辅助化疗是否影响肝脏损伤及影像学是否改变等方面进行探讨。新辅助化疗会使肿瘤细胞的数量减少,体积缩小,病灶变小或消失,Gd-EOB-DTPA增强MRI在结直肠癌肝转移的检测中,对于小病灶的检出率明显高于增强MSCT,而且对于胆管转移的检出率明显更高。因此,笔者认为对于结直肠癌肝转移患者新辅助化疗后的评估,Gd-EOB-DTPA增强MRI优于增强MSCT。
综上所述,Gd-EOB-DTPA增强MRI能够提高结直肠癌肝转移病灶的检出率,能更准确地对患者进行综合评估,特别是对于微小病灶、胆管旁病灶及化疗后病灶的评估,更有利于辅助制定合理的临床治疗方案。

