靶向能量代谢的抗肿瘤金属配合物
金素星,郭子建,王晓勇
(1.南京大学化学化工学院 配位化学国家重点实验室,江苏 南京210023;2.南京大学生命科学学院 医药生物技术国家重点实验室,江苏 南京210023)
癌症是造成人类非正常死亡的重要原因之一,也是影响人类预期寿命的主要因素[1]。在癌症治疗中,可以通过单独使用化学治疗剂或化疗制剂与其他药物联用来阻断癌细胞增殖。近年来,随着分子肿瘤学的不断发展以及人们对肿瘤细胞周期、凋亡等生物过程的深入研究,针对靶点的药物设计成为研发抗癌药物的主要手段。能量代谢是肿瘤细胞抵抗凋亡、发生组织侵袭和转移等的关键环节,因此是抗癌药物潜在的作用靶标。通过调控肿瘤能量代谢可以改变肿瘤生长的微环境,切断能量供应途径,抑制肿瘤细胞增殖并促进其凋亡。
金属抗肿瘤药物是化疗药物的重要成员,其主要优点是化学结构和生物性能的多样性,这是有机药物难以企及的[2-4]。金属配合物的中心金属离子可以具有多种配位数和几何构型,包括平面四方形、四方锥、四面体、三角双锥、八面体等,甚至还有体积更大的几何构型,这些构型赋予其广泛的生物活性;而金属离子独特的性质又赋予配合物特有的理化性质[5];此外,配合物中的配体还能以协同作用方式发挥重要的药理作用。考虑到配体对配合物热力学和动力学的影响,对配体进行修饰可以微调金属药物的生物性质。金属配合物的结构多样性和可调性为设计金属药物提供了方便。
金属抗癌药物顺铂(cisplatin)具有平面四方形结构,可以单独或与其他药物联合用于治疗不同类型的癌症,在结肠直肠癌、非小细胞肺癌等多种实体肿瘤治疗中发挥着主导作用[6-8]。但是由于顺铂细胞毒性较大,无选择性,患者会出现严重的不良反应。为了克服此缺点,药物研究人员相继开发了第2代(卡铂、奈达铂)和第3 代(奥沙利铂、乐铂及庚铂)铂类抗肿瘤药物。目前普遍认为经典铂类药物是通过损伤细胞核DNA 诱导肿瘤细胞凋亡,从而实现抗肿瘤的目的[9]。
除了铂类抗癌药物,钌配合物也具有较好的应用前景,其优势是对多种肿瘤及转移性肿瘤细胞具有较好的抑制作用;NAMI-A 是首个进入临床试验的钌配合物,此后又有若干钌配合物进入临床试验[10](见图1)。
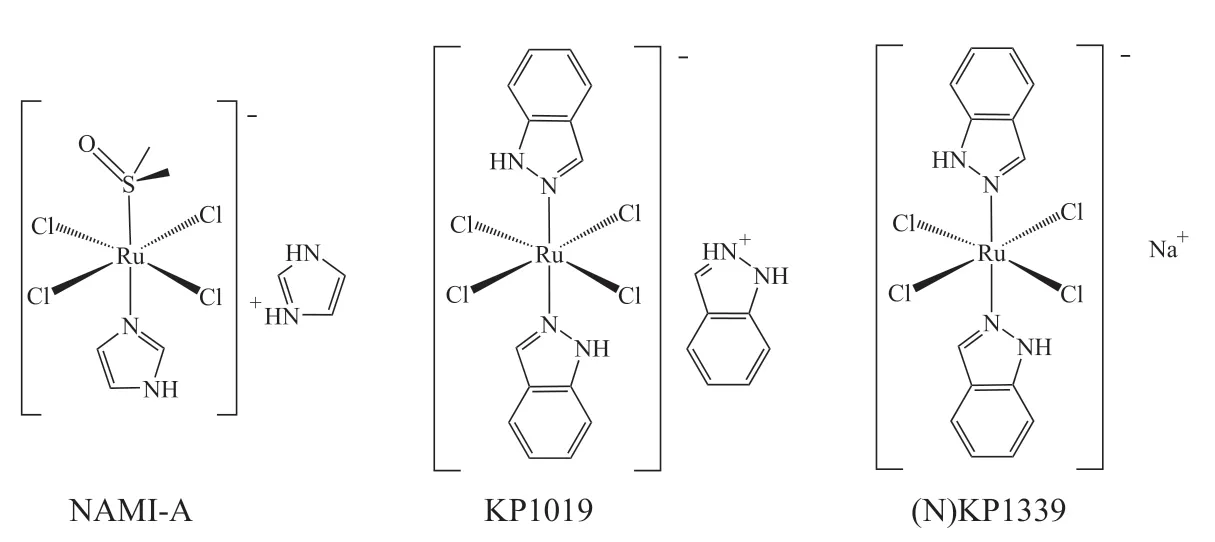
图1 一些正在进行临床试验的抗肿瘤钌配合物Figure1 Some anticancer ruthenium complexes under clinical trials
金属抗癌药物存在系统毒性较高、容易诱发细胞耐药性、对肿瘤组织的选择性低以及生物利用度低等缺点[11-13],由于第2、3代铂类药物都是顺铂的类似物,所以这些问题并未得到根本解决。例如铂类药物与血液中的蛋白质结合,会导致大部分药物在到达病变部位前失活[14],不仅引起一些毒副作用,而且使生物利用度降低。另一方面,传统铂类药物主要以DNA 为作用靶点,而肿瘤细胞对DNA 损伤具有修复能力,因此容易出现耐药性。为了降低药物的系统毒性,克服肿瘤细胞的耐药性,需要研制新一代铂类配合物,同时发现新的作用靶点或途径。
前药是一种很有应用前景的药物类型,它能在体内特定部位通过生物转化释放活性物质,避免药物分子在到达靶标前失活[15],有可能帮助铂类药物克服上述缺点[16]。目前前药策略已经成为提高药物潜在靶向性和生物利用度、改善其理化性质、药理活性和药动学特性的主要手段[17]。四价铂配合物是二价铂类药物的前药(见图2),相比于4配位的二价铂,处于配位饱和状态、动力学更为惰性的四价铂配位中心对配体取代反应抵抗力更强,因此可以减少药物在与DNA 结合前同其他生物分子发生副反应,从而降低毒副作用[18]。四价铂中心的两个轴向配体为修饰配合物结构提供了极大便利,可以通过直接修饰或微调配体改变配合物的还原速率(Ep)、亲脂性(logP)、氧化还原稳定性、分子靶向性和微环境靶向性,以及提高细胞摄取等。由于四价铂配合物较为稳定,所以可以延长在体内的循环时间,有利于药物到达靶标部位,甚至可能实现口服给药。
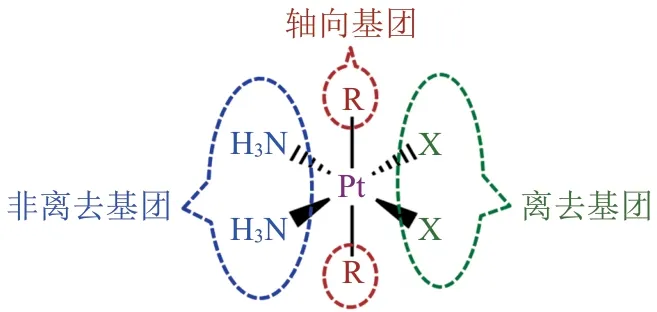
图2 四价铂类配合物的结构模式Figure2 Structural motif of PtIVcomplexes
1 能量代谢
1.1 肿瘤细胞的能量代谢特点
肿瘤细胞与正常细胞的区分是基于Hannahan等[19]所描述的癌症特征,即持续的增殖信号、逃避生长抑制、逃避细胞凋亡、无限的复制潜能、诱导血管生成、组织侵袭和转移、逃避免疫损伤和能量代谢重新编程。其中,能量代谢重新编程是指修改或重新调整细胞代谢途径,以便更有力地支持肿瘤细胞增殖。虽然关于癌症起源的研究大多数都指向驱动基因病变的识别与表征,但近年来对其认识出现了重大突破,即癌症中发生了重要的生化或代谢改变。最为重要的是,这些变化不仅与细胞适应微环境的需要相关,而且还与细胞癌变及转移过程相关[20-21]。
碳水化合物或葡萄糖代谢是人体提供三磷酸腺苷(ATP)的最重要途径。当葡萄糖转运到细胞后,在氧气存在下非增殖组织首先通过糖酵解将葡萄糖代谢成丙酮酸,然后丙酮酸在线粒体中经氧化磷酸化(OXPHOS)被完全氧化为CO2。由于氧是葡萄糖完全氧化所需要的最终电子受体,所以在此过程中必不可少。当氧气受到限制时,细胞可以通过厌氧糖酵解产生乳酸,将糖酵解产生的丙酮酸从线粒体氧化磷酸化方向转移。在厌氧糖酵解过程中产生的乳酸允许糖酵解继续进行,通过循环还原态烟酰胺腺嘌呤二核苷酸(NADH)回到氧化态烟酰胺腺嘌呤二核苷酸(NAD+),但与氧化磷酸化相比,无氧糖酵解产生的ATP最少[22]。然而,大多数癌细胞即使在有足够氧气的情况下依然会将丙酮酸转化为细胞质中的乳酸,而不经历氧化磷酸化过程,这种现象即为“Warburg效应”,又称为有氧糖酵解,是正常细胞和肿瘤细胞之间最显著的代谢差异,也是恶性肿瘤的主要特征之一;同时肿瘤细胞中谷氨酰胺的吸收和利用也有所增加。正常细胞每分子葡萄糖完全氧化产生36个ATP,而异常增殖的癌细胞每分子葡萄糖最多产生4个ATP(见图3)[23]。近年来,靶向癌细胞异常能量代谢途径正在成为设计新型抗癌药物的策略之一。
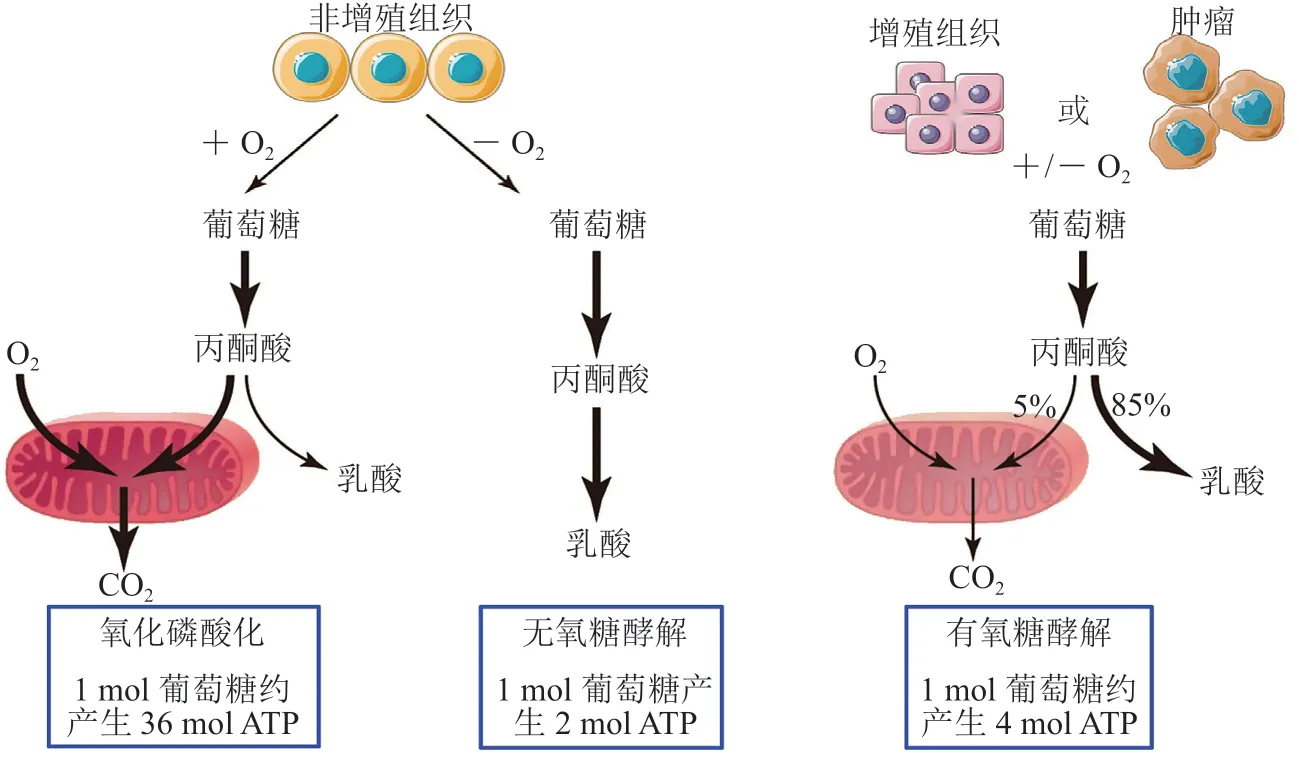
图3 氧化磷酸化、无氧糖酵解和有氧糖酵解间的差异Figure 3 Differences among oxidative phosphorylation, anaerobic glycolysis, and aerobic glycolysis (Warburgeffect)
1.2 线粒体在能量代谢中的作用
线粒体是细胞内微小的细胞器,它通过产生ATP为细胞运转提供几乎全部所需的能量。线粒体广泛参与信号传导、能量代谢、自噬和凋亡等细胞过程[24-25],对维持生物体正常生理功能至关重要;同时,其功能损伤也与癌症、老年痴呆等多种疾病的发生发展密切相关。线粒体功能需要在多种蛋白质和无机物共同参与下才能完成,所以可利用金属配合物的独特理化性质来干预或调控,从而实现预防或治疗疾病的目的。
线粒体膜电位(ΔΨm)是线粒体的重要特征之一。正常细胞的线粒体膜电位约为180~200mV,外正内负,可以维持线粒体进行氧化磷酸化并产生ATP,因此带离域正电荷的亲脂性药物分子易被线粒体内膜吸引并选择性地聚集在线粒体基质中。肿瘤细胞线粒体因代谢差异其膜电位比正常细胞线粒体膜电位高60mV 左右[26],而且亲脂性阳离子进入细胞也是由外正内负的30~60mV 细胞膜电位(ΔΨp)所驱动。受这两个因素影响,带离域正电荷的亲脂性化合物在肿瘤细胞线粒体中的积聚量比在正常线粒体中大100~500倍,从而实现靶向线粒体的目的(见图4)。
1.3 能量代谢的检测
细胞主要通过线粒体有氧呼吸作用消耗氧气来产生ATP,线粒体的呼吸能力一般用Seahorse XFe24细胞生物分析仪来评估,即通过测试线粒体在有氧条件下氧化底物产生ATP时的耗氧速率(oxygen comsumption rate,OCR)来衡量线粒体的有氧呼吸能力。该测试可以给出以下几个指标:基础呼吸值(basal respiration)、ATP生成量(ATP production)、质子渗漏(proton leak)、最大呼吸能力(maximal respiratory capacity)以及备用呼吸量(reserve respiratory capacity)。这些指标的变化可以从多方面反映线粒体有氧呼吸功能的强弱[27]。
除了检测线粒体中进行的有氧呼吸外,在细胞质中进行的糖酵解也可以用SeahorseXFe24分析仪来评估。在缺少氧化磷酸化的肿瘤细胞中糖酵解会导致乳酸含量增加,氢离子会被泵出胞外,从而引起pH值变化。细胞外氢离子浓度的变化率(extracellular acidification rate,ECAR)间接反映了细胞的糖酵解能力。ECAR 越大,即培养基中pH的变化速率越大,表示细胞的糖酵解反应越快。
此外,利用一些生物试剂盒对代谢中的小分子如ATP、葡萄糖、过氧化氢(H2O2)等进行间接检测也可以反映出药物对细胞代谢程度的影响。
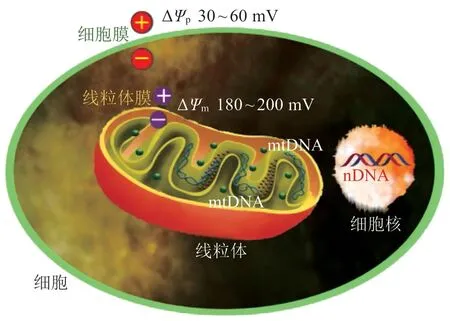
图4 正常细胞膜电位和线粒体膜电位示意图Figure 4 Schematic diagram of normal cellular and mitochondrial membrane potentials
2 金属配合物对能量代谢的影响
2.1 二价铂类配合物对能量代谢的影响
癌细胞具有在氧化磷酸化和糖酵解两种能量代谢方式之间进行切换的能力,即代谢适应性,从而对化疗药物产生耐药性。此外,癌细胞对糖酵解的依赖不仅源于缺氧,部分也源于其不能根据线粒体膜电位梯度合成ATP。癌细胞这种独特的葡萄糖代谢途径可成为癌症治疗的靶标,通过对线粒体功能的调控改变癌细胞的能量代谢模式,进而促进细胞凋亡。例如以8-取代喹啉衍生物为配体的单功能铂配合物1与A549细胞作用后ATP浓度呈药物剂量依赖性下降,细胞与12 μmol · L-1的配合物1 作用8 h后,ATP水平下降了76%(见图5),表明该配合物可以有效抑制细胞的线粒体能量代谢,并证实细胞死亡与线粒体功能障碍有关[28]。
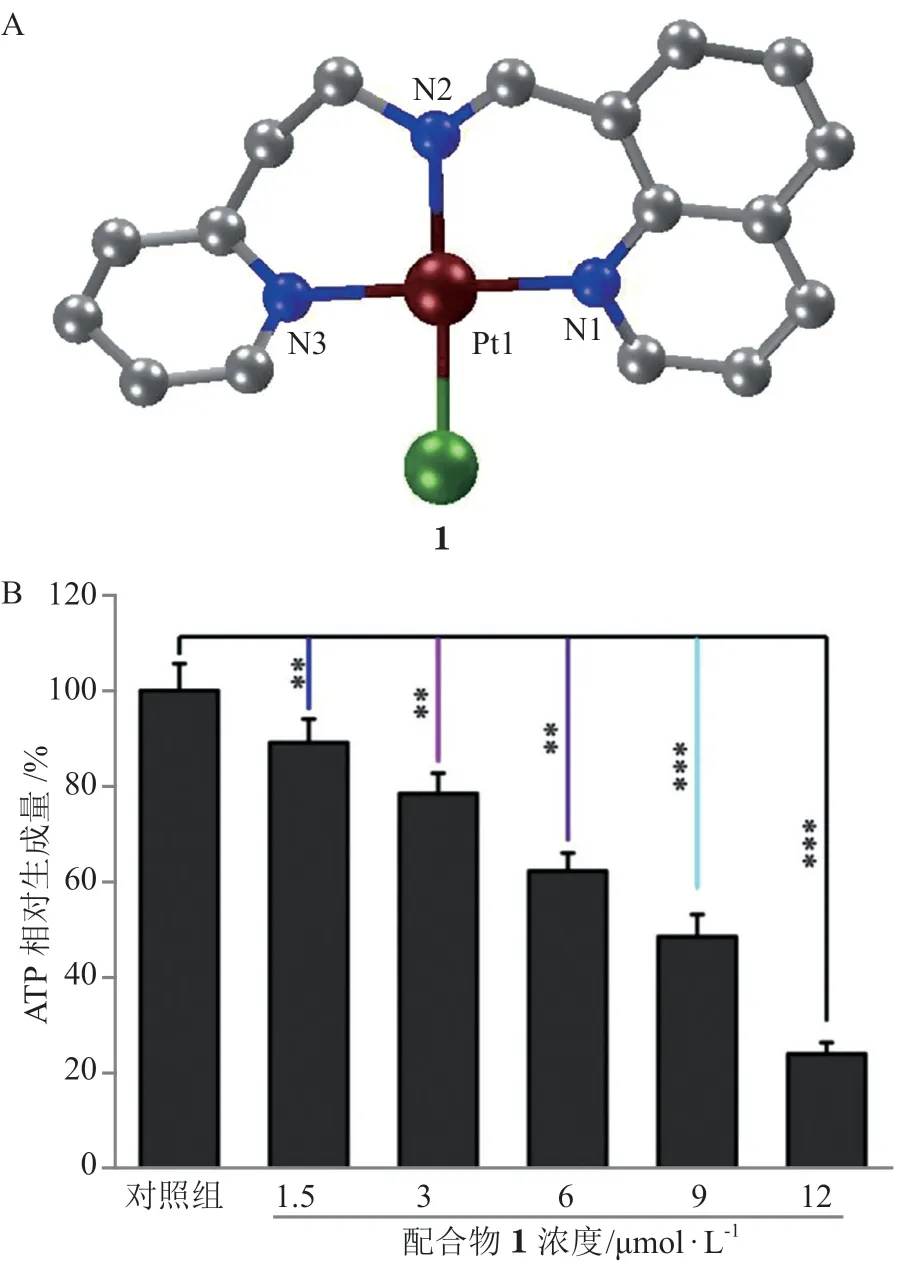
图5 配合物1的晶体结构(A)及其对A549细胞ATP的影响(B)Figure 5 Crystal structure of complex 1(A)and its impacton the level of ATP in A549cells (B)
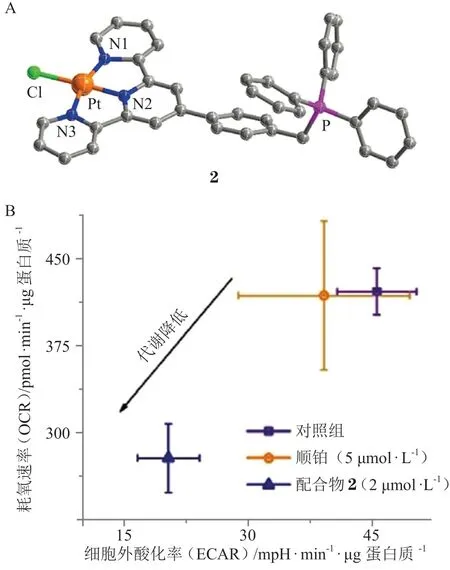
图6 配合物2 的晶体结构(A)及其对Caov3细胞能量代谢指数的影响(B)Figure 6 Crystal structure of complex 2 (A)and its impact on the indices of energy metabolism of Caov3 cells (B)
传统观点认为,细胞核DNA(nDNA)是铂类抗肿瘤药物的主要作用靶点。由于细胞内存在nDNA 损伤修复机制,铂类药物对nDNA 的损伤容易被修复,使肿瘤细胞易产生耐药性。线粒体中含有环状线粒体DNA(mtDNA),是动物细胞内除了nDNA 外唯一的遗传物质。mtDNA 由于缺乏组蛋白保护和相对较弱的损伤修复能力,更容易受到损伤,可以成为铂类药物潜在的作用靶点。因此将铂类配合物靶向mtDNA 可能会影响肿瘤细胞的能量代谢和生存能力,克服传统铂类抗肿瘤药物的耐药性。
将线粒体穿透肽(MPP)修饰到铂药效基团上得到的配合物3可以选择性地聚集在线粒体中,通过对比nDNA 和mtDNA 的损伤程度发现配合物3可以损伤mtDNA,而不损伤nDNA,经配合物3作用24h 后A2780细胞中线粒体超氧化物歧化酶含量显著增加,导致肿瘤细胞线粒体功能障碍,进而促进细胞凋亡[30]。最近笔者课题组设计了一系列具有线粒体靶向功能的吡啶衍生物铂配合物4~6[31],并从DNA 损伤、能量代谢和构效关系等角度研究了它们的抗肿瘤作用机制。N-邻位取代的配合物4对A549肺癌细胞作用48h 的IC50为8.7μmol · L-1,而配合物5、6、顺铂和吡啶铂的IC50分别为47.58、23.50、12.60和125.50μmol · L-1,因此配合物4 比其他配合物表现出更强的抑制活性,且其对人肺癌裸鼠移植模型也表现出显著的治疗效果,对正常肝细胞HL-7702则毒性较低(IC50=64.5μmol · L-1)。配合物4 一方面与nDNA 和mtDNA 结合形成Pt-DNA 单加合物,使DNA 构象发生改变,不能正常复制,并损伤mtDNA 控制区基因;另一方面抑制肿瘤细胞糖酵解,影响线粒体结构和功能,致使线粒体氧化磷酸化和三羧酸(TCA)循环过程不能正常进行(见图7)。这种同时干预DNA 复制和能量代谢途径的作用机制与现有铂类药物的作用机制完全不同。

图7 配合物4 的作用机制Figure 7Proposed mechanism of action for complex 4
异双核配合物7是一种能够克服顺铂耐药性的新型配合物,引入铱(Ⅲ)可以使配合物快速穿透细胞膜并在细胞中高度积聚,而且能同时靶向线粒体[32]。研究发现,配合物7对A549R 耐药细胞的基础呼吸、最大呼吸、质子泄漏、ATP产生及备用呼吸能力均能产生抑制作用;糖酵解的补偿性增加表明肿瘤细胞代谢从葡萄糖氧化磷酸化转变为糖酵解模式(见图8)。
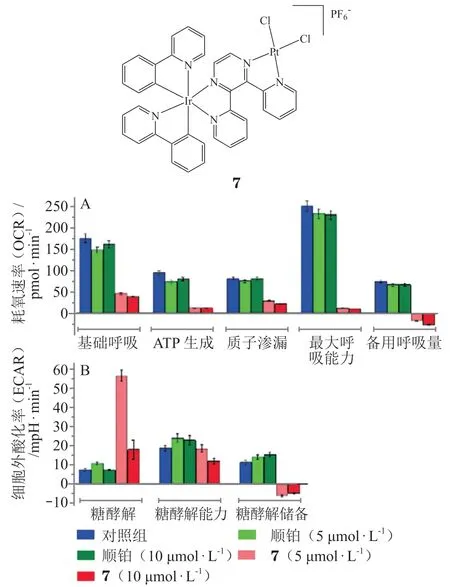
图8 配合物7对A549R细胞有氧呼吸(A)和糖酵解功能(B)的影响Figure 8Effects of complex 7on the aerobic respiration(A)and glycolysis(B)of A549R cells
2.2 四价铂类配合物对能量代谢的影响
葡萄糖是产生能量的主要营养物质,癌细胞优先选择有氧糖酵解作为葡萄糖代谢的途径,这种异常的能量代谢过程涉及众多蛋白质和酶,从而为设计抗癌药物提供了潜在靶点。丙酮酸脱氢酶激酶(PDK)是葡萄糖代谢途径中的关键酶,它可以通过磷酸化丙酮酸脱氢酶复合物(PDC)并保留底物丙酮酸、乳酸和丙氨酸用于糖异生作用,使PDC失活。过表达PDK 可阻断丙酮酸的氧化脱羧作用以满足癌细胞的高氧需求;而抑制PDK 可上调PDC、调节氧气供需平衡,最终导致癌细胞死亡[33]。丙酮酸的结构类似物二氯乙酸(DCA)是一种口服小分子PDK 抑制剂[34],通过抑制PDK 激活PDC,导致丙酮酸流入线粒体,减少肿瘤细胞内乳酸的生成,促进葡萄糖氧化而非糖酵解[35]。经DCA 修饰的配合物8 和9 均能使肿瘤细胞产生大量活性氧(ROS),经其处理的胰腺癌细胞BxPC3内H2O2含量比经线粒体呼吸链复合物Ⅲ抑制剂抗霉素A(antimycin A)处理的细胞高出3.5 倍,表现出较强的抑制细胞OXPHOS能力,并减少了胞内耗氧量。与此同时,OXPHOS的阻滞和ROS增加进一步导致线粒体膜去极化,并引起线粒体肿胀[36]。
与奥沙利铂相比,含DCA 轴向配体的奥沙利铂衍生物10和11具有独特的生物学特性[37]。它们不仅能有效克服肿瘤细胞对奥沙利铂和顺铂的耐药性,而且其作用机制与线粒体、葡萄糖代谢和自噬相关。口服药DCA 的摄取和生物利用度较低,且线粒体靶向能力有限,而配合物11可以改变细胞代谢,减少细胞内葡萄糖的积蓄,因此可作为代谢调节剂,帮助降低癌细胞的能量消耗。
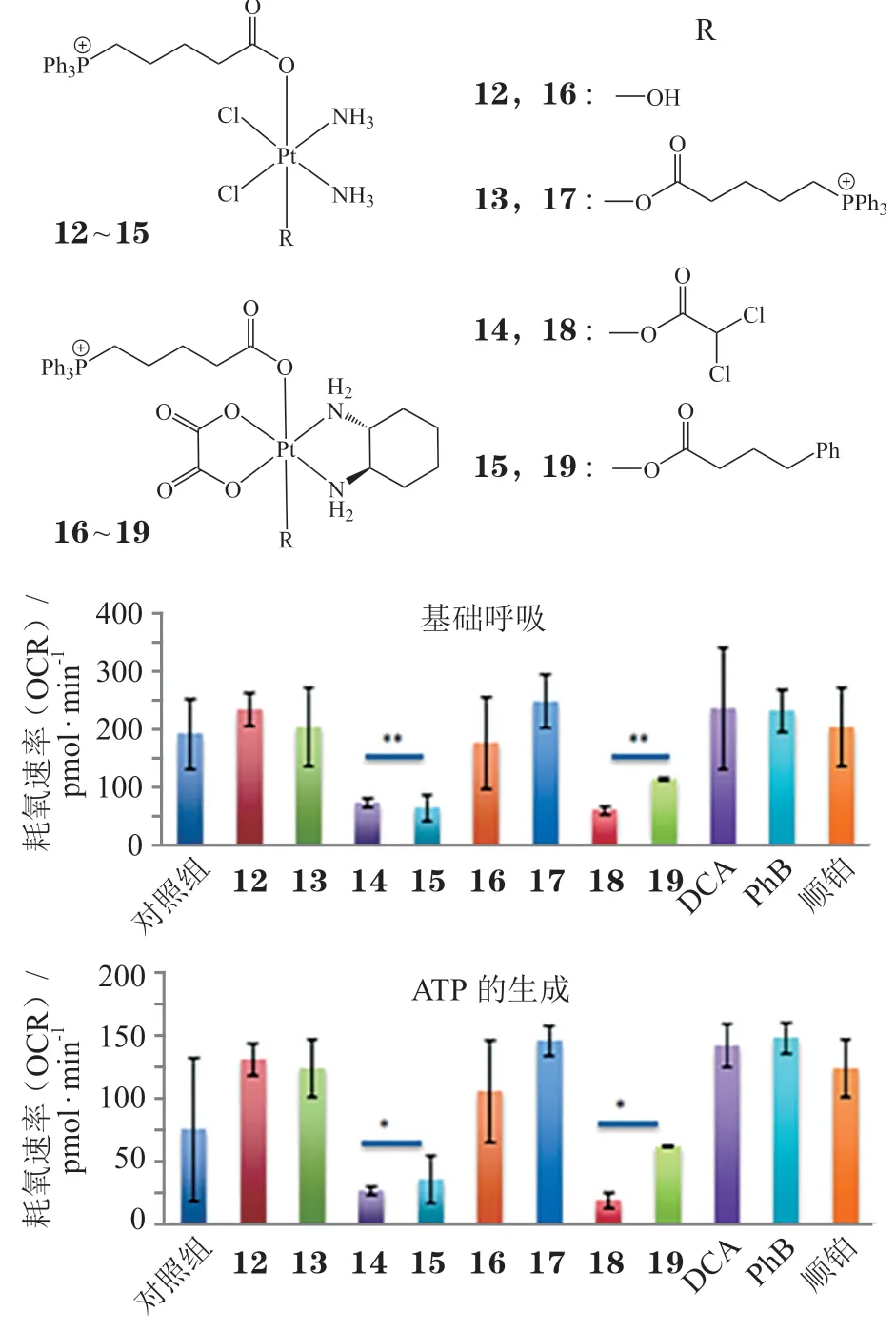
图9 配合物12~19对A2780 细胞OCR 值和生物能量学特征的影响Figure 9Impact of complexes 12~19 on the OCRs and bioenergetics of A2780 cancer cells
为了降低肿瘤治疗过程中的脱靶效应,使正常细胞免受损伤,笔者课题组曾尝试将肿瘤靶向基团生物素连接到四价铂轴向位置,发现它可以显著增加肿瘤细胞对铂的摄取并增强顺铂在乳腺癌治疗中的优势[39]。为了同时干预肿瘤细胞的能量代谢,最近课题组设计了一种多功能四价铂前药20[40],其中仍保留生物素以避免药物的脱靶效应,同时引入DCA 以干预肿瘤细胞的糖酵解。结果表明配合物20可以抑制肿瘤细胞的能量代谢效率,使氧化磷酸化和糖酵解过程都进入低代谢状态(见图10),从而诱导细胞发生DNA 损伤途径以外的线粒体途径死亡。研究还发现配合物20具有激活丙酮酸脱氢酶、降低线粒体膜电位、升高ROS、改变线粒体形貌、抑制OXPHOS和糖酵解等功能。这些功能均可显著干扰肿瘤细胞的能量代谢,“饿死”细胞,并降低药物对正常细胞的损伤,提高治疗效果。
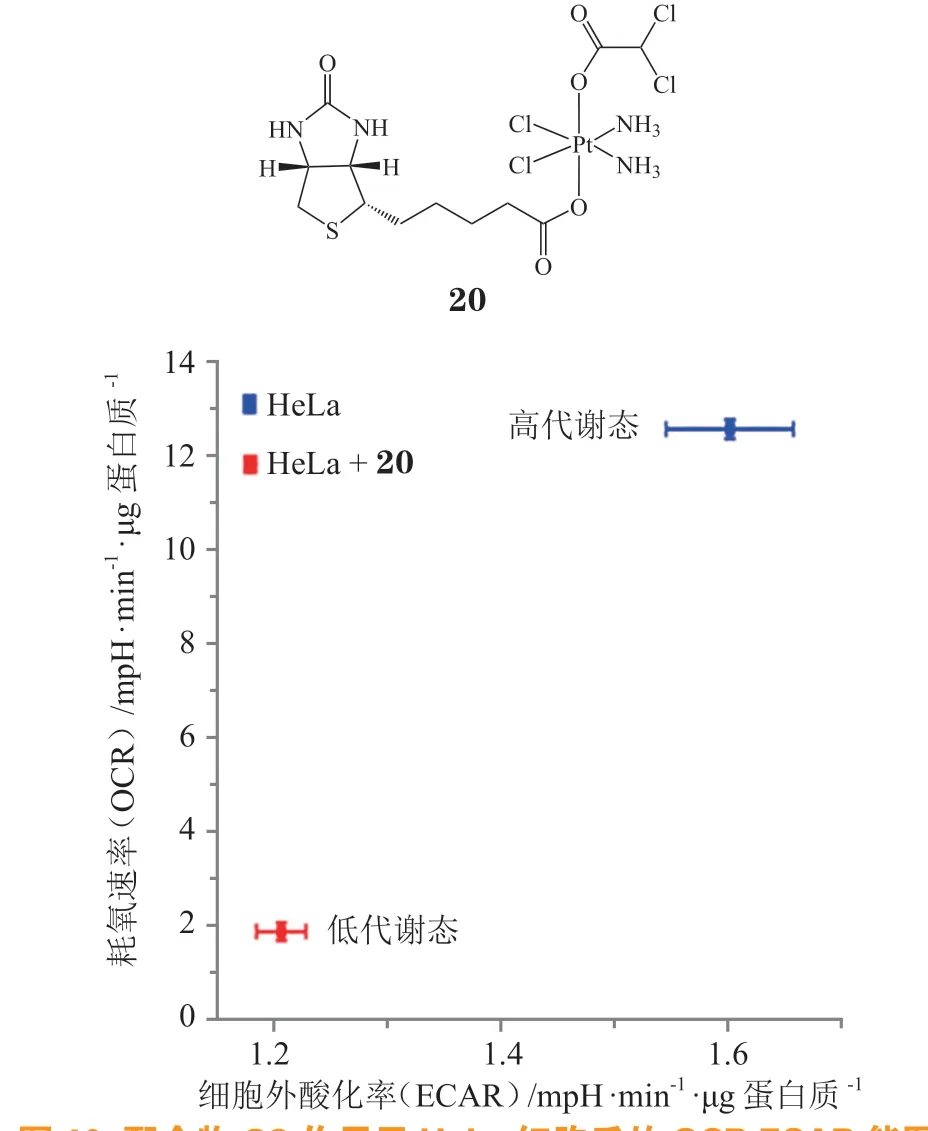
图10 配合物20 作用于HeLa细胞后的OCR-ECAR 能图Figure 10 OCR-ECAR map of HeLa cells treated with or without complex 20
配合物21是用具有线粒体靶向功能的亲脂性TPP+离域阳离子构建的线粒体靶向性顺铂前药,进而将其包裹进末端修饰了TPP+的聚合物PLGA-b-PEG-TPP 中,形成纳米载药系统[41]。该化合物可被精确输送到线粒体中,被还原后与mtDNA 结合,破坏其结构,并对顺铂耐药的卵巢癌细胞A2780/CP70 表现出很强的细胞毒活性(IC50=0.74μmol · L-1,72h);线粒体生物能量学数据也支持这一结论(见图11)。最近笔者课题组研究了两种具有线粒体靶向功能的四价铂配合物22和23,二者在72h时对肺癌细胞A549的IC50分别为34.40和12.20 μmol· L-1,虽然它们对肿瘤细胞的抑制作用明显弱于顺铂(IC50=7.58μmol · L-1),但具有较强的线粒体损伤能力。靶向基团的引入增强了配合物的脂溶性并降低了与DNA 的反应活性;尤其是配合物23,不仅可以抑制线粒体产生ATP,而且还能抑制有氧糖酵解,切断肿瘤生长的能量供应,从而为四价铂配合物抑制肿瘤细胞增殖提供了一条新途径[42]。

图11 配合物21对SH-SY5Y细胞能量代谢的影响Figure 1 1Effect of complex 21 onenergy metabolism of SH-SY5Y cells
2.3 其他金属配合物对能量代谢的影响
钌类配合物作为铂类药物的替代品同样具有显著的抗癌活性。许多聚吡啶钌(Ⅱ)配合物因在可见光照射下能产生ROS而被认为是一类高效光敏剂。与铂类药物的平面结构相比,钌配合物多为八面体结构,其中较大的平面配体为载药提供了疏水空腔。钌(Ⅱ)配合物因其较高的量子产率、较大的斯托克斯位移、发光寿命长及良好的光稳定性而被广泛应用于生物成像。如前所述,肿瘤细胞mtDNA 缺乏损伤修复机制,突变易于积聚,从而引起细胞线粒体功能异常。最近发现,一些具有取代惰性的八面体钌配合物(24~27)具有选择性DNA结合能力,与有机小分子相比,这些配合物具有丰富的光物理和电化学性质,可作为荧光标记物、DNA 印迹试剂和电化学探针[43]。其中配合物24通过靶向mtDNA 优先对胶质瘤细胞产生细胞毒性,当该配合物与mtDNA 调控区结合后,会阻断线粒体RNA 转录,进而抑制蛋白质的生物合成,干扰能量产生,从而阻止细胞增殖,延长胶质瘤小鼠的生存时间,说明它是潜在的神经胶质瘤诊断剂或治疗剂。
异核配合物28是一种靶向mtDNA 的光动力(PDT)治疗剂[44],该配合物可以与DNA 发生共价和非共价相互作用,因此比单核钌配合物29具有更高的DNA 结合效率;光照下配合物28可引起mtDNA 损伤,影响其扩增和转录,进而导致线粒体功能障碍(见图12),包括线粒体膜电位坍塌、ATP消耗、线粒体能量状态衰减以及产生大量ROS,并可消除实体瘤。可见通过合理分子设计靶向mtDNA 是设计金属光动力治疗剂的有效策略。
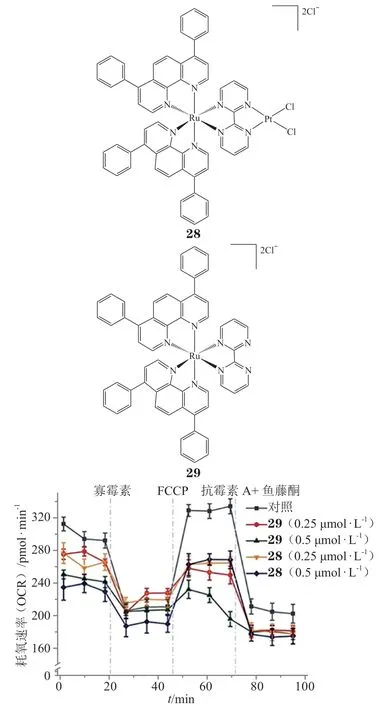
图12 配合物28 和29 与A549细胞作用后引起的能量代谢变化(37℃,12h,光照强度450 nm, 5 J·cm-2)Figure 1 2Effects of complexes 28 and29 on energy metabolism of A549 cells after treatment at 37℃ for 12 h before irradiation(450 nm, 5 J·cm-2)
除了钌配合物,铱配合物,特别是金属有机铱配合物,也受到了人们的广泛关注,这类配合物有许多表现出优异的发光特性和产生单线态氧(1O2)的能力,其中环金属化铱(Ⅲ)配合物是很好的PDT试剂。此外,与其他亲脂性阳离子类似,亲脂性阳离子铱(Ⅲ)配合物也对线粒体具有高亲和力[45]。已经证实,在多种癌症中mtDNA 近端暴露于ROS会导致其较高的突变率[46],为了维持癌细胞的代谢需求,这些异常的线粒体基因组会导致线粒体功能发生改变。最近报道,环金属化铱配合物30~35能抑制肿瘤细胞代谢并从不同方面促进肿瘤细胞凋亡[47-50]。又如一系列含有延伸平面配体的环金属化铱(Ⅲ)配合物36~41对不同肿瘤细胞如A549、HepG2、HeLa、PC3和顺铂耐药的肿瘤细胞A549R 作用48h 的IC50均小于5μmol · L-1,比顺铂(IC50均大于10μmol · L-1)具有更高的细胞毒性,并能有效定位于线粒体,其中配合物38和39在体外可与DNA 紧密结合,在原位插入mtDNA,造成mtDNA 损伤。同时,这两个配合物还能损伤线粒体,使线粒体膜电位下降、阻碍ATP生成、中断线粒体能量代谢(见图13),继而引起保护性的线粒体吞噬和G0/G1期细胞周期阻滞,导致肿瘤细胞凋亡。体内试验也表明配合物39能有效抑制异种移植肿瘤的生长[51]。这些研究表明铱配合物是一类具有发展潜力的新型非铂类抗肿瘤配合物,靶向线粒体基因组是一种抑制肿瘤细胞能量代谢的有效策略。
近年来,能够同时治疗和追踪癌症的荧光诊断治疗剂引起了人们的极大兴趣。含磷的铼(Ⅰ)配合物Re(CO)3是一种有前景的新型抗癌剂,其抗肿瘤活性与顺铂相当甚至优于顺铂,通过调节配体和亲脂性,它们可以迅速进入细胞并选择性地积聚在线粒体中。同时,铼(Ⅰ)配合物具有量子产率高、斯托克斯位移大、磷光寿命长、光稳定性好等特点,而且其O2敏感性磷光寿命适宜于监测细胞耗氧量,这些特性使它们能够被用来监测细胞摄取、细胞器分布、细胞器形态变化及治疗过程中线粒体呼吸的变化情况[52-53]。作为干预肿瘤细胞代谢的多功能治疗剂,Re(Ⅰ)-DCA 配合物42和43对PDK 活性有很强的抑制作用,但只有配合物43可以选择性地积聚在A549细胞及PDK 高表达的NCI-H1229细胞线粒体中,因此它能有效诱导肿瘤细胞从糖酵解逆转到葡萄糖氧化磷酸化(见图14),进而导致线粒体膜电位去极化、细胞内活性氧水平升高以及引发Caspase 依赖的肿瘤细胞凋亡。研究表明:配合物43能选择性杀伤与正常细胞共培养的恶性肿瘤细胞,显著抑制细胞的转移和侵袭,并在斑马鱼胚胎中显示出良好的抗血管生成活性。相比之下,在相同条件下,未经DCA 修饰的配合物44不能诱导癌细胞发生代谢逆转,其对NCI-H1229细胞作用24h 的IC50为2.9μmol · L-1,活性远低于配合物43(IC50=0.8μmol · L-1),推测配合物43的优良抗癌特性是细胞毒性中心铼(Ⅰ)与代谢调节剂DCA联合作用的结果[54]。
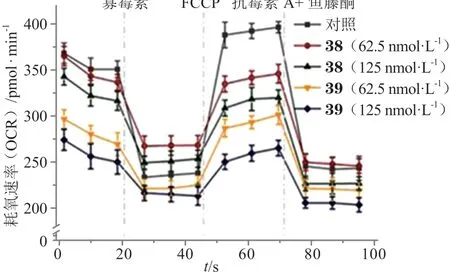
图13 A549细胞与配合物38 和39 作用后的氧化呼吸图Figure 13Respiratory profiles of A549 cells after treatment with complex 38 or 39

图14 NCI-H1229 细胞与配合物43、44 或二氯乙酸钠作用后的糖酵解图(A)及氧化呼吸图(B)Figure 1 4 Glycolysis profiles (A)and respiratory profiles (B)of NCI-H1229 cells after treatment with complex 43, 44 or Na-DCA at indicated concentrations
3 结语与展望
本文综述了近年来出现的一类靶向肿瘤细胞能量代谢的金属配合物的研究进展,以期为金属抗肿瘤药物的设计与研发提供新的思路和方向。肿瘤的发生与发展是一个多信号网络交叉的复杂过程,线粒体参与或主导了多种肿瘤细胞生物功能的改变,其中生物能量学起着重要作用。能量代谢异常是癌细胞普遍存在的特征,除了线粒体氧化磷酸化,糖酵解也是癌细胞获取养分和能量的重要途径,为癌细胞的形成、生长和转移提供动力。因此,调控肿瘤细胞的能量代谢可以改变肿瘤细胞微环境,促进癌细胞凋亡。
靶向线粒体或能量代谢的策略已经得到广泛的尝试和重视,本文仅对近年来出现的靶向肿瘤细胞能量代谢的金属配合物做了简要介绍,其他类型的分子或纳米药物并未涉及。目前,金属抗肿瘤配合物在此方面的研究已取得初步成效,但是多数研究主要关注线粒体介导的凋亡通路,对肿瘤细胞能量代谢的具体机制研究尚不深入,而针对代谢途径中相关蛋白或生物酶的分子作用机制及作用效果的研究尚未涉及,这对于从分子层面了解金属配合物干预肿瘤细胞代谢的途径具有重要意义。此外,肿瘤具有异质性,不同肿瘤细胞都有其独特的代谢模式,即使在同一种肿瘤内不同细胞间仍存在代谢方式的差异,而且代谢方式会因环境的变化而改变,因此在特定细胞中取得的结果未必具有普适性。肿瘤细胞除了特有的糖代谢异常外,还有异常的脂肪酸代谢、无需线粒体呼吸链的谷氨酸代谢等其他代谢旁路,这些途径对癌细胞获取能量和养分也很重要,可以通过金属配合物干预或阻断这些异常能量代谢过程来实现癌症的分子靶向治疗。最后需要指出,深入了解和阐释肿瘤细胞不同能量代谢表型的内在分子机制将有助于揭示肿瘤细胞代谢改变与生物学行为之间的关系,为设计有效的金属配合物提供理论基础和实践依据,这是未来发展新型靶向能量代谢的抗肿瘤金属药物不应忽视的重要内容。

