AP1000核电厂闭式冷却水系统复配缓蚀剂方案设计
鲍一晨, 石秀强, 刘晓强
(上海核工程研究设计院有限公司,上海200233)
AP1000核电厂闭式冷却水(CCW)系统正常运行工况下通常处于低温含氧水介质环境中。CCW主要结构材料中的碳钢和铜合金在该环境下均有明显的腐蚀倾向,如果腐蚀不能得到有效控制则可能导致设备提前失效;腐蚀产物的迁移沉积也可能影响热交换器的换热效率,甚至引起管道堵塞从而停机;铜的腐蚀产物一旦迁移沉积在不锈钢换热器表面还可能引起不锈钢换热管的应力腐蚀破裂[1]。实践中通常采用操作简单、见效快的添加缓蚀剂的方法缓解腐蚀问题,亚硝酸盐、钼酸盐、磷酸盐、重铬酸盐等均是核电站常用的缓蚀剂[2],然而这些缓蚀剂在单独使用时可能会引起环境排放限制、毒性/致癌性、富养微生物、高浓度导致的高昂维护费用等问题。为了达到良好的缓蚀效果,同时兼顾环保和卫生要求,高效、低毒的复配缓蚀剂是发展趋势。根据EPRI闭式冷却水导则[1],其中一种适用于铁基管系的复配缓蚀剂即亚硝酸盐/钼酸盐组合:亚硝酸钠作为氧化剂能够为钼酸盐成膜提供所需的氧化环境,促进Fe-MoO4-Fe2O3的形成[3,4]。组合使用亚硝酸盐和钼酸盐还能够产生一定的协同效应[5],从而两种复配物的浓度相比单独使用时都有所降低,因此更易满足排放和生物效应方面的要求。另一方面,由于常用的如钼酸盐、亚硝酸盐等阳极缓蚀剂对铜及铜合金不具缓蚀效果抑或效果不佳,因此还需要同时添加铜合金缓蚀剂,如苯唑类型缓蚀剂[6],甲基苯并三氮唑钠(TTA-Na)等。TTA作为一种环境友好缓蚀剂,不仅能够有效抑制碳钢的腐蚀,也能够与铜原子之间形成极强的配位键从而形成牢固的保护膜,苯环上的非极性甲基基团也能够增加成膜后表面的疏水性[7],这些效果都使唑类化合物成为了极佳的铜缓蚀剂。为了确定适用于AP1000核电站闭式冷却水系统的NaNO2、Na2MoO4和TTA-Na复配缓蚀剂方案,针对缓蚀剂各组分相应的浓度进行配比试验以获得兼顾缓蚀效率和经济性的复配方案。这不但能够为核电站辅助系统水化学设计提供技术支撑,也能够获得系统材料腐蚀及缓蚀效率的真实数据,有利于指导电厂运行实践。
1 试验
试验材料分别为碳钢SA106GrB(成分详见ASTMA106/A106M)和黄铜,黄铜成分为:wZn38.81%,wCr0.030%,wP0.031%,wNi0.031%,wSi0.042%,wFe0.120%,余量为Cu。分别加工成电化学试验试样:试验端面为10 mm×10 mm;和挂片浸泡试验试样:50 mm×20 mm×2 mm。所有试样均打磨至2 000目砂纸并用除盐水清洗、乙醇脱脂。电化学试样用树脂封装在PPR管中,露出试验端面。试验用NaNO2,Na2MoO4和TTA-Na试剂浓度均归化为名义浓度,在本文中仅给出相应的归化浓度比,即10-6NO2-∶10-6MoO42-∶10-6TTA。NO2-试验浓度分别为:1,10,20,30;MoO42-试验浓度分别为:3.2,9.3,14,20;TTA试验浓度分别为:0.1,0.7,2。试验介质为除盐水,加热并维持在35 ℃,溶液分别以NaOH调至pH9.5、10、10.5以评估pH对缓蚀剂使用效率的影响。氯离子影响试验组中加入NaCl,维持Cl-处于10×10-6左右。
电化学测试试验中使用上海辰华仪器的CHI660D电化学工作站进行电化学动电位极化曲线的测定;使用Princeton Instruments的PAR VersaStat3F电化学工作站进行电化学阻抗谱(EIS)的测定。挂片浸泡试验试样称重使用Sartorius Intec的CPA225D电子天平,精度0.01 mg。动电位极化曲线测定扫描范围为Ecorr±0.25VSCE或最高至Ecorr+1.25VSCE,扫描速率为0.6 V/h;EIS测定振幅为10 mV,频率从0.1 Hz至10 000 Hz。电化学测试前,试样先进行阴极极化处理以去除空气中表面成膜的影响,随后浸泡约8 h,待开路电位稳定后进行后续测试。对于浸没试验,相应的腐蚀取样周期分别为24 h、72 h、120 h、168 h以及336 h。
2 结果
首先分别对NaNO2和Na2MoO4进行SA106GrB钢缓蚀的单组分试验,极化曲线如图1所示。由图可见两种缓蚀剂均表现为阳极钝化型缓蚀剂,当添加浓度达到一定程度后,均表现出较好的缓蚀效率(IE),IE值均超过了90%,继续提高浓度,IE值提升不显著。从阳极极化曲线部分可看出,相对而言,MoO42-能够降低维钝电流密度,而NO2-能够降低临界钝化电流密度。

图2 SA106GrB在不同浓度MoO42-与NO2-配比下的极化曲线Fig.2 Polarization curves of SA106GrB in solutions with various concentrations of MoO42- and NO2-
对两种缓蚀剂进行浓度配比试验,各浓度配比下的极化曲线如图2所示。当Na2MoO4处于较低浓度时,加入较小浓度的NaNO2,自腐蚀电位就显著升高,自腐蚀电流也相应减小,协同效应明显。对于给定的MoO42-浓度,持续升高NO2-的浓度不一定能获得更高的IE,如3.2_1组的IE为98.4%而3.2_20的IE则跌至97.9%(自腐蚀电流密度约增加30%);9.3_10组的IE为98.1%而9.3_30的IE则跌至97.1%(自腐蚀电流密度约增加50%)。添加NO2-后临界钝化电流密度均大幅降低,表明NO2-能为含MoO42-的钝化膜提供了氧化性环境从而为成膜提供了便利,但是过多的NO2-似乎会降低MoO42-的缓蚀性能。
对每一组配比均进行EIS测量,从每个MoO42-浓度水平下挑选IE(以Rp进行计算)最大的配比组进行比较,如图3所示。由图可见,所有配比组下高频部分均出现了一小段容抗弧,中频部分则表现为压缩半圆环的形貌,低频部分则表现为线性发展的Warburg阻抗形貌。以等效电路R(Q(R(Q(RW))))进行拟合,这些配比下的IE值分别为:20_1(99.4%)、3.2_1(99.2%)、14_30(98.3%)和9.3_20(98.2%),而拟合所得两个常相位角元件的n值均接近0.9,也表明容抗弧特征并不显著。当MoO42-浓度处于最小和最大值时,获得的IE均高于其他配比组。结合极化曲线的结果,综合考虑剂量经济性,选定3.2_1组为SA106GrB缓蚀剂最佳配比组。
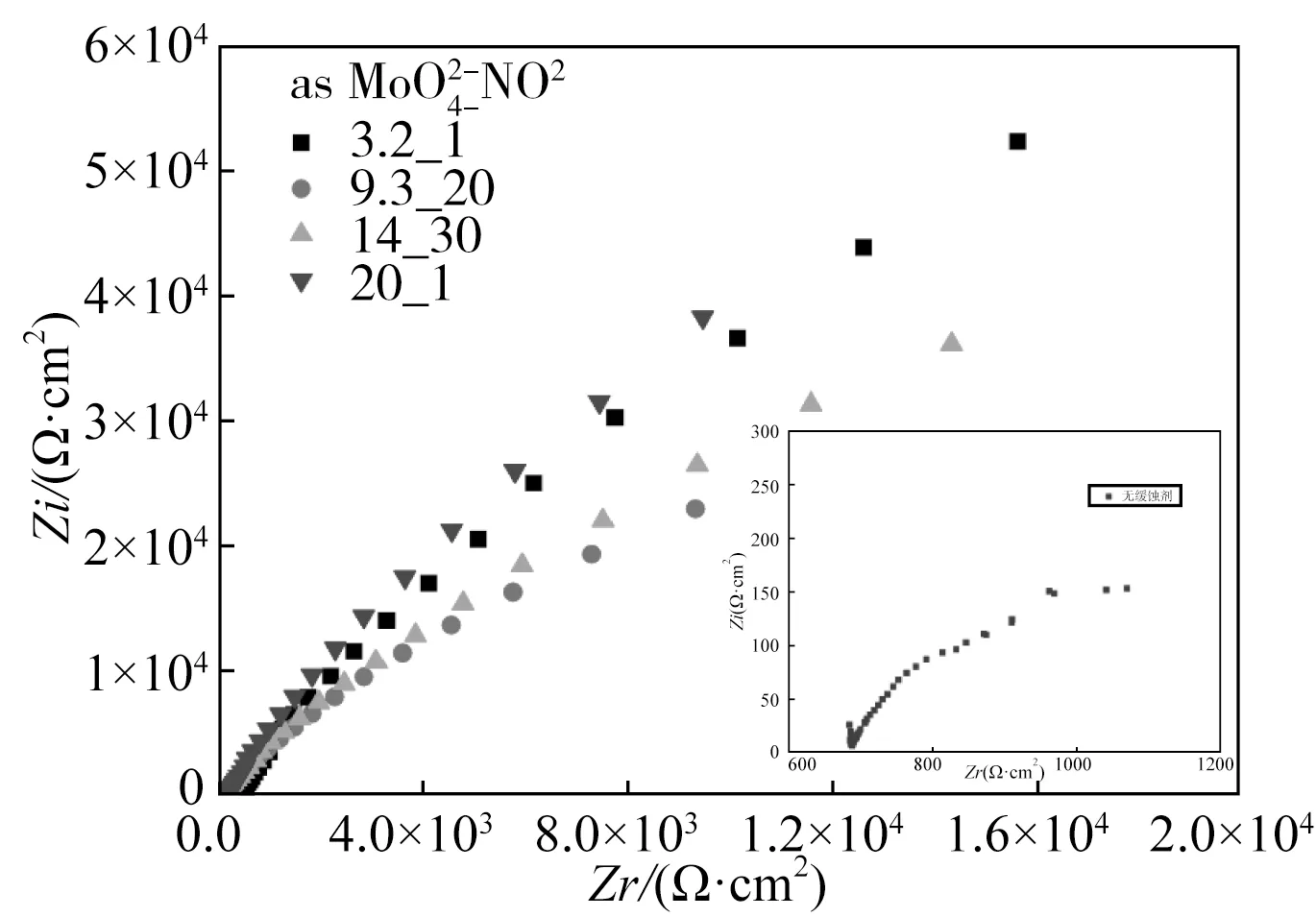
图3 SA106GrB在不同浓度MoO42-与NO2-配比下的Nyquist图Fig.3 EIS nyquist plots of SA106GrB in solutions with various concentrations of MoO42- and NO2-
随后对选定的复配方案进行pH影响分析,结果如图4所示。pH10和pH10.5的自腐蚀电流密度均小于<130 nA/cm2,而pH9.5的自腐蚀电流密度则超过了300 nA/cm2。EIS的结果则表明三种pH情况下没有显著差异。

图4 SA106GrB在3.2_1复配方案下不同pH的影响Fig.4 Polarization curves and nyquist plots of SA106GrB in(3.2_1) inhibitor solutions with different pH levels
针对三种不同pH还进行了浸没试验(图5),腐蚀失重结果表明pH9.5和pH10.5的腐蚀速率接近,pH10的腐蚀速率略高,但有可能是脱膜操作带来的误差所导致(从pH9.5失重数据点前几个点可以看出后期脱膜可能未脱尽),因此综合以上结果,最终选定pH10为缓蚀剂适用pH。
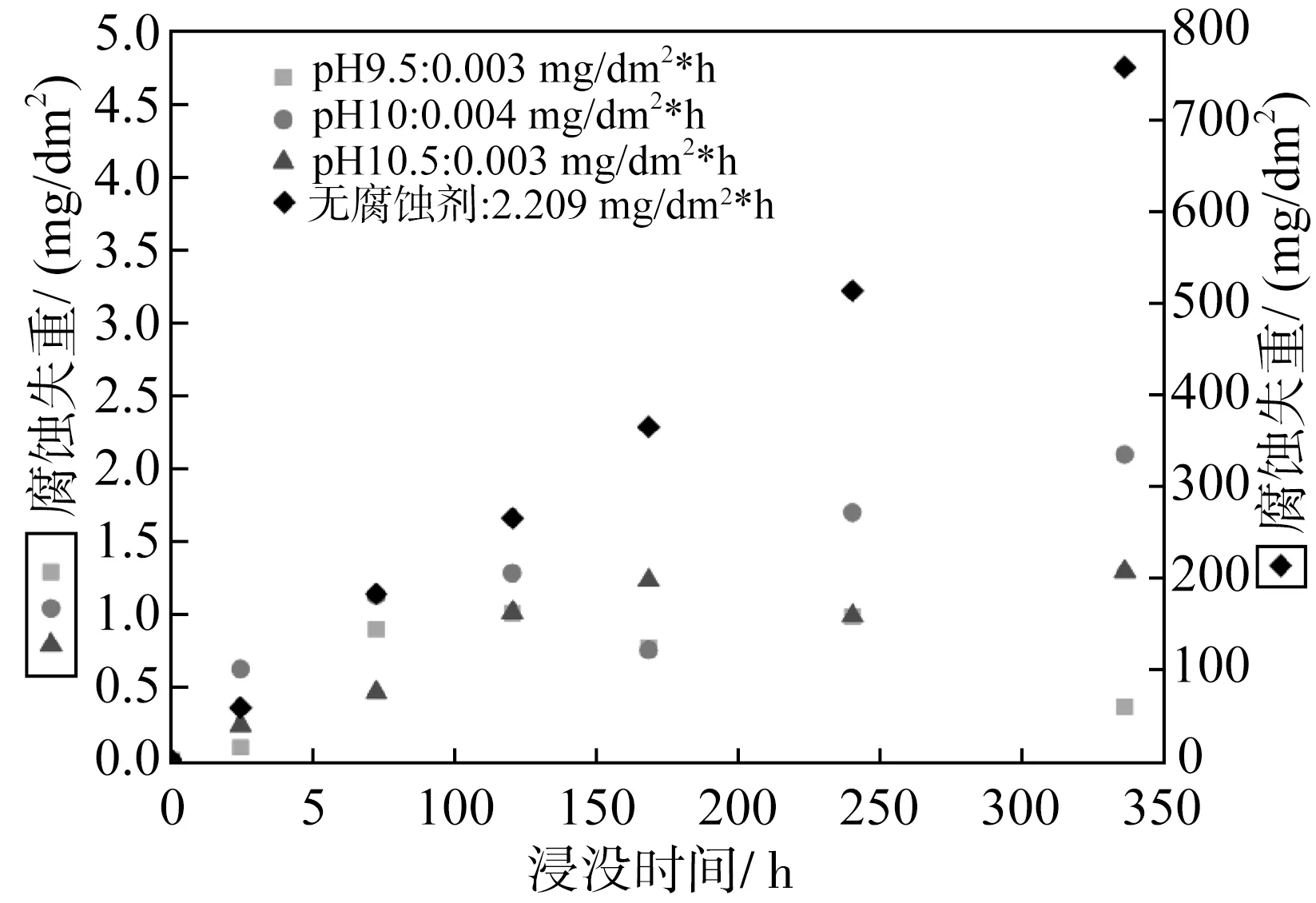
图5 SA106GrB在不同pH的3.2_1复配方案下的腐蚀失重结果Fig.5 Weight loss of SA106GrB exposed in different pH solutions with 3.2_1MoO42-_NO2-
对于黄铜,通常认为无机缓蚀剂的效果较差而有机唑类缓蚀剂效果极佳,这主要是因为其包含的氮原子上的自由电子对能够与铜原子紧密结合[7]。从图6中也可看出,当向MoO42-_ NO2-的复配物中添加微量(0.1)的TTA后自腐蚀电流就显著减小,当浓度达到0.7后,继续添加直至浓度为2时自腐蚀电流也未明显减小;而无论添加TTA的浓度为多少,其自腐蚀电位都没有显著变化,阳极和阴极极化部分曲线形式也未有显著变化,这表明TTA的作用机理与MoO42-_ NO2-复配物的阳极钝化型机理不同,其更能同时阻碍阳极和阴极过程。从EIS的Nyquist图中可以看出,相比SA106GrB,黄铜的缓蚀测定结果在高中频段容抗弧的特征更为显著。
同样以等效电路R(Q(R(Q(RW))))进行拟合,发现常相位角元件的n值随着TTA浓度的增加从0.6逐渐增加至1,这表明随着TTA浓度的提升,黄铜表面的保护膜也覆盖得更为充分,对传荷的阻碍效果更佳。针对TTA复配方案,也进行了黄铜的腐蚀浸没试验,从浸没试验的腐蚀失重结果(见图7)也可以看出0.7_TTA对于黄铜的缓蚀已较充足,某些时间点下的失重情况甚至略优于TTA_2时的腐蚀失重。考虑到脱膜称重带来的误差,可以认为TTA浓度0.7和2对于黄铜的缓蚀性提高没有显著区别。

图6 黄铜在3.2_1复配方案下不同TTA浓度的影响Fig.6 Polarization curves and nyquist plots of brass in inhibitor solutions with different TTA levels

图7 黄铜在3.2_1复配方案下不同TTA浓度对腐蚀失重的影响Fig.7 Weight loss of brass exposed in different TTA level solutions with 3.2_1MoO42-_NO2-
在确定MoO42-∶NO2-∶TTA最佳配方为3.2∶1∶0.7后,对氯离子的影响(尤其在点蚀进行了相容性研究。在10×10-6Cl-添加下,SA106GrB的极化曲线和Nyquist点图如图8所示。MoO42-_ NO2-的加入使得破钝电位从-581 mVSCE提升至747 mVSCE,TTA的加入也未对缓蚀性能造成显著的负面效应,两条极化曲线几乎重合。EIS的测量结果则表明在含Cl-的溶液中未添加TTA的复配物阻值更大,添加TTA后,溶液中未加入氯离子和加入氯离子情况下的阻值变化趋势与极化曲线一致,TTA的加入未改变表面钝化机制,但使缓蚀效率略有下降,这有可能是由于TTA对金属表面的覆盖在一定程度上阻碍了两种缓蚀阴离子在新鲜金属表面的吸附,从宏观腐蚀行为而言,这一影响是极其微弱的,因此不应认为TTA的加入对于碳钢的腐蚀有显著的不利影响。
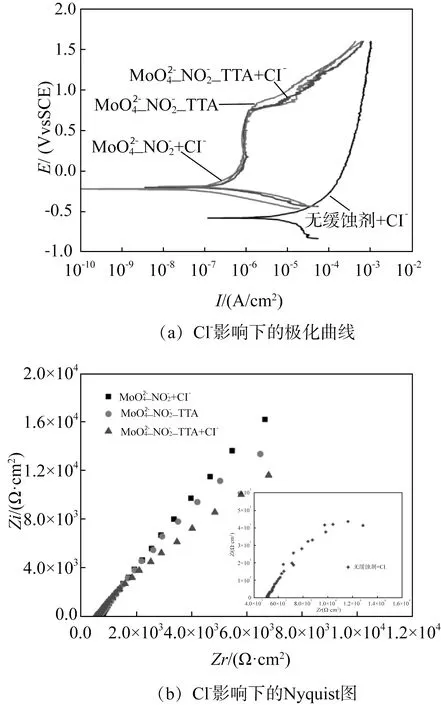
图8 Cl-对SA106GrB在含缓蚀剂溶液中腐蚀性能的影响Fig.8 Polarization curves and nyquist plots of SA106GrB in inhibitor solutions with Cl-

图9 Cl-对黄铜在含缓蚀剂溶液中腐蚀性能的影响Fig.9 Polarization curves,nyquist plots and Bode plots of brass in inhibitor solutions with Cl-
黄铜缓蚀工况中添加氯离子的影响分析如图9所示。氯离子的加入并未显著影响自腐蚀电流密度,反而使电流密度从295.4 nA/cm2减小至183.1 nA/cm2,这表明Cl-的加入可能促进了TTA保护膜的覆盖。而其破钝电位也从约0.0 mVSCE提升至1 208 mVSCE,甚至略高于未添加氯离子时候的破钝电位(1 144 mVSCE),虽然后者的维钝电流密度更低一些。从Nyquist图中发现加入氯离子后阻值大幅下降,这与极化曲线中阴极极化和阳极极化下电流密度增加一致,这些数据点分布特征发生了显著变化:在低频部分出现了显著的容抗弧而偏离了原先更接近的Warburg阻抗部分,表明氯离子的加入影响了TTA在Cu表面的吸附,缓蚀效率不但受到TTA的影响,也受到了氯离子在Cu表面分布的影响。从相位角Bode图上可以看出,添加缓蚀剂后,特征峰明显往高频端移动,当加入Cl-后,特征峰也略向右偏移,且相比未添加Cl-的数据点在低频部分的相位角更小,表明受传质控制的影响更小,且在0.2 Hz附近可观测到有略凸起的小特征峰,这与Nyquist图中低频部分出现的容抗弧特征是对应的,也表明Cl-的加入综合极化曲线的结果,推测Cl-在Cu表面的吸附在破坏表面钝化的同时反而更有利于TTA的吸附。
3 讨论
NaNO2和Na2MoO4对于碳钢管系而言都是良好的阳极钝化型缓蚀剂,在中性或碱性环境中缓蚀效率更好[8-10],尤其当介质中含有Cl-时,碱性环境将有利于缓蚀离子与金属表面的钝化结合[11]。当联合添加MoO42-_ NO2-后,这类缓蚀剂复配方案往往能呈现显著的协同效应[3]。MoO42-呈弱氧化性,因此通常需要添加足量或配合其他强氧化剂使用以助其形成并维持牢固的钝化膜[8]。NO2-作为强氧化剂不但能够帮助形成难溶钝化膜同时也能够修复膜损伤[3,12]。Al-Refaie等学者曾报道Mo和N均是优先附着于钝化膜的最上层,MoO42-会与受保护金属相互络合而NO2-则易被还原为N2[9]。这可能是单独使用这两种缓蚀剂时,MoO42-的阳极极化电流要高于NO2-下阳极极化电流的原因。需要注意的是在本研究中,高浓度的MoO42-_ NO2-组合不一定能带来高缓蚀率,考虑经济因素,最佳配比为3.2∶1(MoO42-∶NO2-),推测过多地增加NO2-浓度,其还原产物N2可能会通过π键与碳钢表面形成N-Fe膜从而与MoO42-竞争吸附由此降低缓蚀效率[9]。Zhou Y.等[5]也指出NO2-相比MoO42-更能抑制点蚀的形成,然而若在NO2-溶液中已形成了点蚀,则相比MoO42-溶液,NO2-不能有效阻碍点蚀的发展(再钝化)。各类复配方案下EIS测试结果中低频端Warburg阻抗特征较为显著,表明缓蚀性能受到浓差极化控制的影响。TTA的加入对于碳钢的缓蚀机制没有显著影响,虽然其在碳钢表面的全面覆盖可能会阻碍NO2-和MoO42-与基体表面Fe的反应,尤其当溶液中存在Cl-时,可能会给缓蚀性能带来轻微的不利影响。
对于黄铜缓蚀剂TTA,杂环原子(N)的存在有利于改善有机分子的缓蚀性能[4,7,13],这主要是由于Cu原子的空d轨道能够与提供电子的杂质原子形成配位键,而唑环上的N1和N3原子能够与2个Cu+成键而平行吸附于铜表面,从而形成了牢固的化学吸附膜。从试验结果来看,对于黄铜缓蚀TTA浓度似存在一个阈值(接近0.7归化浓度),超过该限值继续添加TTA甚至达3倍时对于缓蚀率的增长并无显著帮助。根据Mahbuboor等人的研究[15],相比铜表面,TTA更易于吸附于Cu+表面并且能够同时抑制阳极和阴极反应,由此亦可推测试验中获得的TTA浓度阈值可能与表面初始Cu2O的生成量有关。这一现象在添加Cl-后尤为显著,相关研究也表明卤素杂质添加能够通过促进有机分子与金属表面吸附而提升缓蚀率[16]。Tromans等[17]比较了含Cl-溶液中BTA和TTA的缓蚀性能,指出Cl-对增强TTA的吸附更为显著,其使微观溶解机制从传质控制过程向传荷控制过程改变。图9(b)、(c)也表明,Cl-加入后低频端容抗弧形貌更显著,原先低频段传质控制过程特征也几乎消失,传荷控制特征显著,两个容抗弧/时间常数也表明电极表面除电极电位以外还有一个状态变量与法拉第电流密度有关,很可能就是表面生成的Cu+分布。Cl-的加入为CuTTA的化学吸附提供了新的通道,其促使表面Cu的氧化,形成CuCl2,间接促进了Cu+与TTA的结合,从而使宏观缓蚀率有所提升。
4 结论
(1)NaNO2和Na2MoO4对SA106GrB钢的缓蚀性有显著的协同效应,低浓度组分配比即可获得极佳的缓蚀率,两种配方均为阳极钝化型缓蚀剂,但是当提高组分浓度后,并不一定能够获得更高的缓蚀率。
(2)TTA-Na是黄铜的绝佳缓蚀剂,其复配入NaNO2和Na2MoO4组分并不会对碳钢的缓蚀产生负面影响。TTA的加入量存在一个阈值,该阈值与黄 铜初始表面氧化状态有关。
(3)复配组分最佳配比为3.2∶1∶0.7(MoO42-∶NO2-∶TTA),最佳使用pH环境为pH10。复配缓蚀剂对Cl-有较好的相容性,且Cl-的加入能够促进黄铜表面TTA的吸附。

