BMSC 细胞外基质对脂肪间充质干细胞生物学活性的影响*
原芳芳 王 丽 刘 伟 吴松芳 郭红延
成体干细胞是一类位于各种分化组织中的未分化干细胞,在维持组织的生长和修复方面具有重要作用。成体干细胞主要包括造血干细胞(Hematopoietic stem cells,HSC)和间充质干细胞(Mesenchymal stem cells,MSCs)两大类[1]。脂肪来源的间充质干细胞(ADSCs)在脂肪组织中含量丰富且易于获取,已成为基于干细胞疗法(包括骨组织再生)的最具吸引力的干细胞来源之一[2]。ADSCs 除具有免疫抑制性[3,4],还具有向成骨、成软骨以及成脂等多种细胞谱系的分化潜能。然而,与成骨效果相比,ADSCs 可能更倾向于脂肪形成[5,6],因此,需要一种新颖的方法引导ADSCs 向成骨谱系分化。
有研究显示,不同微环境对干细胞分化具有不同的调节作用[7-9]。近年来研究表明细胞外基质对干细胞粘附、增殖、分化等多种细胞活动具有显著调节作用[10]。细胞外基质是细胞周围多种大分子组成的复杂三维网络结构,富含的各种活性分子可以模拟体内细胞生长的微环境,为细胞生存及活动提供空间。已有文献证明BM-dECM 材料对BMSCs 的增殖、成骨以及成软骨分化具有重要作用[11],但是该材料对ADSCs 的生物学影响还未见报道。本实验拟通过制备BMSCs 衍生的ECM 材料,探究BM-dECM 对ADSCs 增殖和分化能力的影响。
1.材料和方法
1.1 实验动物及材料 实验动物由军事医学科学院实验动物中心提供的SPF 级SD 大鼠[3 周,(300±350)g]、HD-DMEM 培养基、α-MEM 培养基、胎牛血清(Gibco,美国)、0.25%胰蛋白酶、磷酸盐缓冲液(PBS)、油红O 染液、茜素红染液、细胞计数试剂盒(CCK-8) (Dojindo,日本)、TIANamp Genomic DNA Kit(TIANGEN,中国)、脱氧核糖核酸酶(DNase)(Sigma,美国)、Fibronectin(ab2413)、Collagen I (ab34710)、Collagen IV(ab6586)抗体(Abcam,英国)、CY3 标记羊抗兔IgG(中杉金桥,中国)、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(中杉金桥,中国)。
1.2 方法
1.2.1 大鼠BMSCs 培养及ECM 的制备 取3 周龄SD 大鼠,颈椎脱臼法处死,无菌分离股骨及胫骨,暴露骨髓腔,使用10ml 注射器及23G针头吸取培养基将骨髓冲出,反复吹打数次后1000r/min 离心5 min,弃上清,用培养基重悬细胞并接种于培养皿中,置于细胞培养箱中培养14天,每两天更换一次培养基。
1.2.2 BM-dECM 的制备 (1)预处理:将高压灭菌后的清洁玻璃片放入向培养皿中,加入适量0.1%明胶,37℃静置1h,吸除明胶,PBS 清洗三次,将BMSCs 接种于培养皿中;
(2)配置溶液:使用PBS 配置50ml 含0.5%Triton X-100、20mM NH4OH 溶液,灭菌后37℃放置备用;
(3)脱细胞:BMSCs 细胞培养至第14 天时去除原培养基,加入适量脱细胞液覆盖细胞,作用1~3min,高倍显微镜下密切观察,确认脱细胞核后去除脱细胞液,加入100U/ml 脱氧核糖核酸酶(DNase),37℃放置1 小时;吸除脱氧核糖核酸酶,PBS 清洗三次,所得BM-dECM 用PBS 浸泡,置于4℃条件下储存备用。
1.2.3 H&E 染色 选取BM-dECM 样品,使用4%多聚甲醛固定30min,PBS 清洗3 遍,苏木素染液染色5min,蒸馏水漂洗;1%氨水作用1s,蒸馏水漂洗;1%盐酸作用5~10s,蒸馏水漂洗;伊红溶液染色3min,蒸馏水漂洗;样品经梯度酒精(70%~80%~90%~100%)脱水干燥;二甲苯透明10min;封片后光学显微镜下观察染色效果并拍照。
1.2.4 免疫荧光染色 选取BM-dECM 样品,使用4%多聚甲醛固定30min,PBS 清洗3 遍,羊血清封闭1h,加入 Fibronectin、Collagen I、Collagen IV 抗体(1∶200 比例稀释)孵育过夜;随后,PBS 清洗,滴加CY3 标记的羊抗兔IgG(1∶200 比例稀释),37℃避光条件下孵育2h,PBS清洗;最后,使用DAPI 复染,置于共聚焦显微镜下观察并拍照。
1.2.5 DNA 含量检测 (1)DNA 的提取:取接种于6 孔板中未进行脱细胞处理的BMSCs 以及制备完成的BM-dECM 样品,每组6 个样本按照TIANamp Genomic DNA Kit 说明操作,所得DNA产物-20℃条件下保存待用;
(2)测试各样品DNA 含量:调试Nanodrop 2000 微量紫外分光光度计(Thermo,美国),依次检测各样品DNA 含量;根据仪器数据记录所得DNA 浓度值以及A260/280 比值。实验重复3 次。
1.2.6 ADSCs 的分离及培养 取3 周龄SD 大鼠,取腹股沟处脂肪组织,将脂肪组织剪碎,加入1ml Ⅳ型胶原酶、1ml dispase 酶、4ml 0.25%胰酶、4ml α-MEM,消化15min 后使用细胞筛过滤,1000rpm/min 离心5min,用培养基重悬计数,接种于培养皿,置于细胞培养箱中孵育。
1.2.7 CCK-8 法检测ADSCs 细胞增殖 将P3 代ADSCs 按3×103个/孔的密度接种于ECM材料包被的96 孔板(BM-dECM 组)以及普通96 孔板(对照组)中,每组都设5 复孔。检测时每孔加入10μl CCK-8 溶液,作用3 小时后使用酶标仪立即测定450nm 处的吸光度值(OD)。实验重复3 次。
1.2.8 RT-PCR 检测 将P3 代ADSCs 按1×105个/孔的密度分别接种于ECM 材料包被的6 孔板(BM-dECM 组)以及普通6 孔板(对照组)中,置于细胞培养箱中孵育。分别于3、7、14 天时使用TRIzol reagent 提取各组细胞总RNA,使用常规方法检测RNA 浓度并定量反转录形成cDNA。采用SYBR Green RT-PCR 试剂盒检测2 组ADSCs中成骨相关基因:特异性AT 富集序列结合蛋白2(Specific AT enrichment sequence binding protein 2,SATB2)、Runt 相关转录因子(Related transcription factor 2,RUNX2)、骨钙蛋白(Osteocalcin,OCN);成脂标志基因:成脂过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor gama,PPAR-γ)、转录调节因子CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein alpha,C/EBPα);以及成软骨相关基因:聚集蛋白聚糖(Aggrecan,ACAN)、Ⅱ型胶原蛋白-A1(Type II collagen-A1,COL2A1)、性别决定相关基因SOX9 (SRY-related high mobility group-box gene 9,SOX9)mRNA 的表达情况。每个样本中设置3 个复孔同时进行,并重复实验3 次。以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,各基因的相对表达量以在对照组中ADSCs 测得的表达量作为基准量1 进行比较得到相对定量结果。各引物序列见表1。
本研究采用matK、psbA-trnH、psbK-psbI和rbcL 4个DNA候选条形码序列,对蜘蛛抱蛋属19种104批样品进行PCR扩增,并对扩增成功率、测序效率、种内与种间变异水平和鉴定成功率等指标进行综合评价,拟获得该属植物物种鉴定的最佳DNA条形码序列,以期为该属物种的分子分类学研究奠定基础。

表1 RT-PCR引物序列
1.2.9 统计分析 本实验所有数据分析和图表制作均使用GraphPad Prism 7.0 完成。数据结果以均数±标准差(±SD)表示,采用t 检验进行分析,α=0.05。
2.结果
2.1 BM-dECM 的表征
2.1.1 H&E 染色结果 对BM-dECM 材料进行H&E 染色结果显示,BM-dECM 材料结构良好,蓝紫色的细胞核已经被大部分脱除,粉色的细胞外基质成分得以保留(图1)。通过此种脱细胞方法处理所得的BM-dECM 呈一层均匀且致密的形貌,保持了连续的膜状形态。

图1 H&E 染色结果
2.1.2 免疫荧光染色结果 使用Fibronectin、Collagen I、Collagen IV 抗体对BM-dECM 材料进行免疫荧光染色,BM-dECM 材料中纤连蛋白和胶原纤维结构清晰可见(图2),证明所制备的BM-dECM 很好地保留了BMSCs 分泌的细胞外基质中的纤维蛋白和蛋白多糖等成分,可以仿生细胞生长的微环境,为其作为支架材料用于细胞培养创造了条件。

图2 BM-dECM 材料免疫荧光染色结果
2.1.3 DNA 定量检测结果 DNA 定量检测结果显示未进行脱细胞处理的细胞片中DNA 含量为73.96±10.20 ng/μl,脱细胞后BM-dECM 材料中DNA 的量下降为17.72±3.24 ng/μl,差异有统计学意义(P<0.05)(图3),极大的降低了BM-dECM材料的免疫原性。结合H&E 染色结果证实脱细胞处理后细胞核成分被大部分脱去,可以证明BM-dECM 材料满足细胞外基质材料的制备要求[12],为后续实验操作提供了可能。
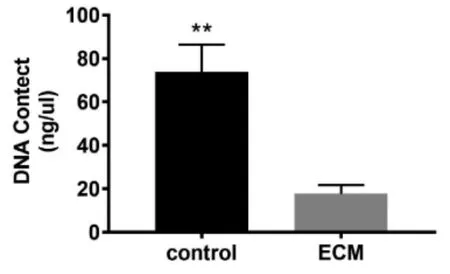
图3 BMSCs 细胞与BM-dECM 材料DNA 含量检测结果
2.2 ADSCs 增殖的检测 CCK-8 检测结果显示:BM-dECM 组和对照组中ADSCs 细胞数量都随着时间增加而呈现不断增加的趋势。第1 天时两组间OD 值没有差异(P>0.05);随后3、5、7 天均检测到BM-dECM 组的OD 值要高于对照组,差异有统计学意义(P<0.05)(图4)。结果表明BMdECM 材料能促进ADSCs 细胞体外增殖。

图4 两组ADSCs 增殖曲线
2.3 ADSCs 分化的检测
2.3.1 成脂相关基因RT-PCR 检测结果显示总体趋势对照组PPAR-γ、C/EBPα 基因表达量随时间增加逐渐升高,而ECM 组两基因表达量随时间增加呈下降趋势。PPAR-γ、C/EBPα 基因在两组细胞各个时间点的表达量具有统计学意义(P<0.05)(图5)。提示ADSCs 具有自发向成脂分化的潜力,而BM-dECM 材料对ADSCs 脂肪分化的能力具有一定抑制作用。
2.3.2 成骨相关基因RT-PCR 检测结果显示总体趋势对照组STAB2、OCN、RUNX2 基因表达量均随时间增加而降低;ECM 组STAB2、OCN基因表达量随时间增加逐渐升高,RUNX2 的表达量呈现3~7 天先上升而后7~14 天逐渐下降的趋势;除STAB2 基因3、7 天时表达量高于ECM 组外,其余各基因在其他时间点均为ECM 组高于对照组,差异有统计学意义(P<0.05)(图6),提示与对照组相比BM-dECM 材料在一定程度上促进了ADSCs 向成骨分化。
2.3.3 成软骨相关基因RT-PCR 检测结果显示 总体趋势虽然两组细胞COL2A1、SOX9、ACAN 基因表达量均随时间增加而降低,但是,除COL2A1 基因在3~7 天时对照组表达量高于ECM 组外,其余时间点均为ECM 组各个基因表达量高于对照组,差异有统计学意义(P<0.05)(图7)。提示虽然与对照组相比BM-dECM 在维持ADSCs成软骨分化能力方面具有一定的潜能,但随时间变化BM-dECM 对ADSCs 的成软骨能力仍具有一定的抑制作用。

图5 两组ADSCs 不同时间点成脂相关基因RT-PCR 检测结果
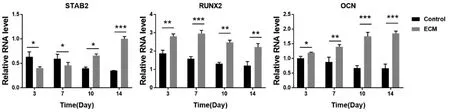
图6 两组ADSCs 不同时间点成骨相关基因RT-PCR 检测结果
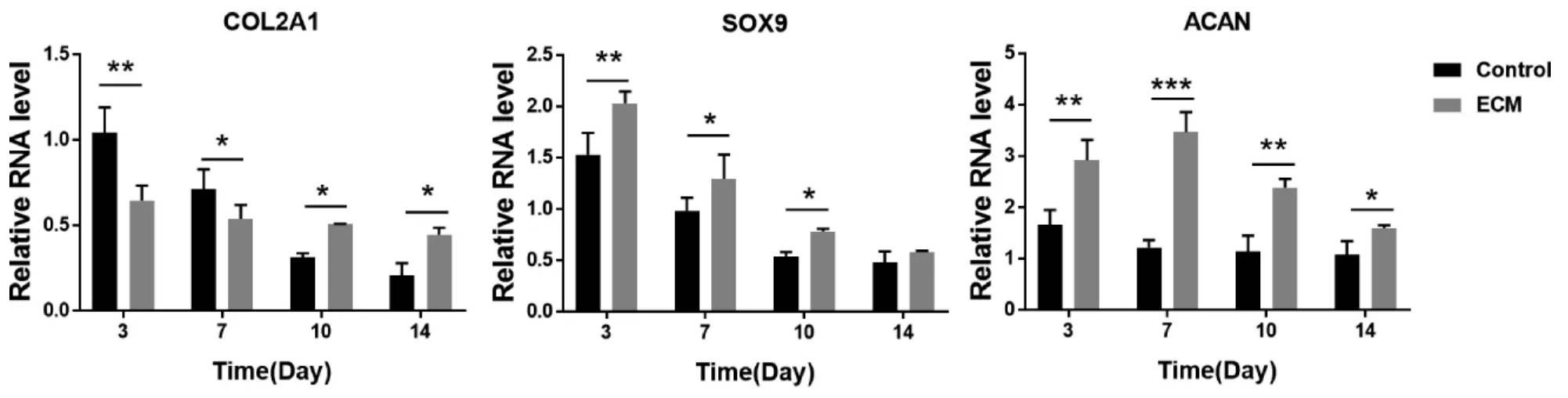
图7 两组ADSCs 不同时间点成软骨相关基因RT-PCR 检测结果
3.讨论
ADSCs 由于其具有多向分化潜能、免疫调控、可自我复制和可自体移植等优点,越来越受到学者们的青睐。然而与BMSCs 相比,ADSCs 的成骨分化能力较弱[13],并且体外培养扩增容易丧失干细胞性能,如何促进ADSCs 的增殖并增强其向成骨方向分化的潜能一直是组织工程领域研究的热点之一。
近年来研究者们发现ECM 材料对干细胞的增殖维持具有积极作用[14]。本实验的检测结果显示在BM-dECM 上培养的ADSCs 相比对照组具有更强的增殖能力,说明该材料具有良好的生物相容性。ECM 促进细胞增殖的原因主要有以下两点:首先,ECM 的3-D 空间结构和物理特性可以模仿天然细胞外基质所构成微环境的功能,即为细胞与细胞以及与微环境间的信息交流提供了途径,为营养物质的传送提供了输送通道[15-17];其次,ECM 是富含各类蛋白聚糖的材料,其纤维结构能够可逆地结合生长因子和细胞因子,这些活性成分在组织周围的信号通路中发挥作用,介导细胞的分裂迁移,促进细胞增殖[14,18]。
Ragelle 等研究者发现BM-dECM 的成分与骨髓中的ECM 几乎相同[19],可以精确模拟骨组织中各成分的组成与含量。近年来许多研究结果显示:与在TCP 上培养的BMSCs 相比,在BM-dECM上培养BMSCs 可提高其增殖速率和能力[20],保留干细胞标志物的表达,提高成骨分化潜能[21],降低细胞衰老,并降低细胞内ROS 活性[22],证明BMdECM 材料具有很好的仿生性及生物活性。本实验结果显示BM-dECM 材料同样可以促进ADSCs自发向成骨分化的潜能,其潜在原因可能是BMdECM 中的某些蛋白物质或者促成骨因子改善了ADSCs 的成骨微环境,从而显著促进ADSCs 的成骨分化,但本实验对其分化调节作用的具体机制没有作深入探讨,尚需进一步研究。
综上所述,BM-dECM 材料可以显著提高ADSCs 的体外增殖能力;通过对成脂、成骨、成软骨相关的标志基因的RT-PCR 检测进一步证实BM-dECM 材料抑制了ADSCs 成脂成软骨的分化能力,提高了ADSCs 的成骨潜能。本实验提示可以通过构建ECM 材料模拟微环境,来提高的ADSCs 增殖及成骨分化能力,为今后临床应用奠定基础。

