胃混合性神经内分泌-非神经内分泌癌1例临床病理分析
巩芮宁,邹玉玮,任琳琳,成鉴晓,章 程,江月萍
青岛大学附属医院 1.消化内科; 2.病理科,山东 青岛 266003
病例患者,男,51岁,因“上腹痛1个月余”就诊。患者入院1个月前,无明显诱因上腹阵发性隐痛。患者否认相关家族遗传史。当地胃镜检查示贲门一处菜花样隆起,大小约1.5 cm×1.5 cm,并可见隆起延伸至胃底,胃底大溃疡形成,周边隆起,僵硬,黏膜弹性差,可见胃底新鲜渗血。病理诊断:(贲门)黏膜低分化癌。入院后查血尿粪常规、血清甲胎蛋白(alpha fetoprotein,AFP)、糖链抗原19-9(carbohydrate antigen,CA19-9)、癌胚抗原(carcino-embryonic antigen,CEA)未见异常。腹部平扫及增强CT示贲门区壁增厚,可见肿块样改变,病变略强化,周围可见多发软组织结节影(见图1)。完善相关检查并排除手术禁忌证后,行全麻下贲门肿瘤切除+淋巴结清扫术。术后给予对症支持治疗,一般状态可。
术后组织巨检示距食管切缘2.5 cm于贲门处可见一溃疡型肿物,范围8 cm×7 cm,切面灰白质脆,侵达浆膜;小弯侧可见多枚肿大淋巴结,其中大者3 cm,另见多枚淋巴结融合。镜检示肿瘤构成于低分化鳞状细胞癌和神经内分泌癌(G3级)(见图2),侵达浆膜,未累及胃壁切缘及送检食管切缘;小弯侧(9/9)及送检贲门旁(5/6)淋巴结内均见癌转移。免疫组化:突触素(synaptophysin,Syn)、嗜铬粒蛋白A(chromogranin A,CgA)示神经内分泌癌区域(+)(见图3),角蛋白CK5/6(cytokeratin 5/6,CK5/6)、P40示鳞状细胞癌区域(+)(见图4),S100示神经侵犯(+),Ki67示神经内分泌癌区域阳性率约60%,鳞状细胞癌区域约60%,经D2-40、CD31染色,间质脉管内见癌栓。符合混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-nonneuroendocrine neoplasms, MiNENs)。患者术后好转出院。
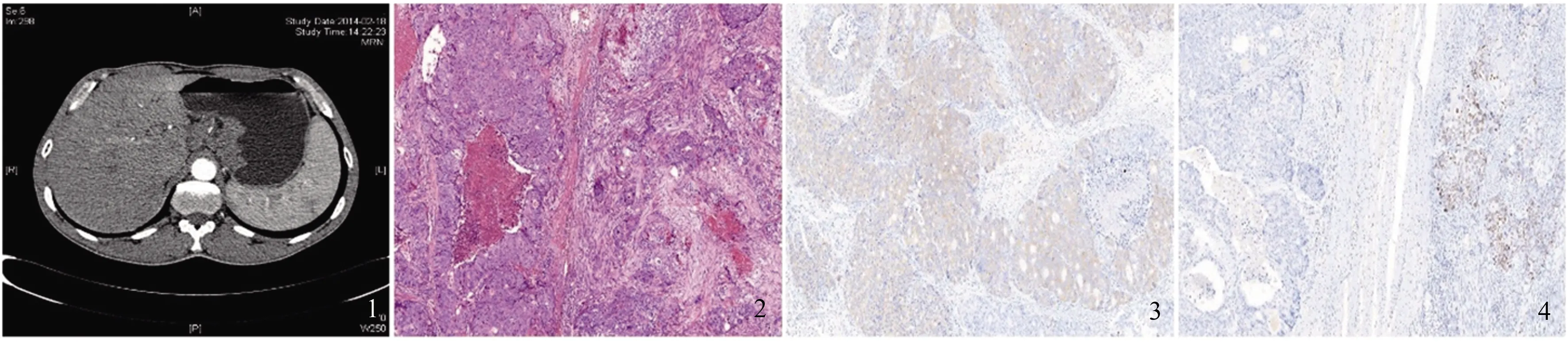
图1 腹部CT示贲门区壁增厚,延伸至胃底;图2 神经内分泌癌与鳞状细胞癌混合存在(HE染色,放大100倍);图3 神经内分泌区Syn染色阳性(IHC染色,放大100倍);图4 鳞状细胞癌区域P40染色阳性(IHC染色,放大100倍)
Fig 1 Abdominal CT showed thickening of the wall of the cardiac area; Fig 2 The tumor was composed of neuroendocrine carcinoma and squamous cell carcinoma; Fig 3 Immunohistochemical detection showed Syn positive in NEC area; Fig 4 P40 was positive in SCC of the area
讨论胃肠道肿瘤同时表现为外分泌和神经内分泌的病例罕见,在2010年世界卫生组织(WHO)分类中将同时包含内分泌和外分泌成分的肿瘤命名为混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinomas,MANECs),于2017年更名为MiNENs,且肿瘤中的不同成分均需达到30%[1]。MiNENs可见于阑尾、食管、胃、十二指肠、胆囊和结直肠等[2-3]。其中神经内分泌成分为神经内分泌癌(neuroendocrine carcinomas,NECs)或神经内分泌瘤,非神经内分泌成分可为腺癌(adenocarcinomas,AC)或鳞状细胞癌(squamous cell carcinoma,SCC),但SCC成分罕见,可见于食管和直肠[4]。MiNENs具有不同的形态特征,且各成分组成范围和分化程度不同。
由于胃MiNENs罕见,目前对其遗传学认识主要基于少部分文献报道。MiNENs中的不同肿瘤成分最常见共有突变为TP53基因[5]。对其起源目前存在两种主要假说,一种假说认为MiNENs中的两种成分共同起源于单克隆多能干细胞,另一种假说则认为两种成分来源于不同细胞系。Sinha等[6]对14例MiNENs及5例NECs全基因拷贝数分析,比较MiNENs、NECs及AC的染色体改变,发现MiNENs与AC在基因组上具有相关性,其中MYC扩增频率与AC相似。Sahnane等[7]发现,微卫星不稳定(microsatellite instability,MSI)NECs与外分泌癌之间存在相似性,且4例MSI-MANECs的外分泌区和神经内分泌区均检测到MSI的存在,提示错配修复缺陷发生在分化开始前。以上理论支持肿瘤的单克隆起源假说。Furlan等[8]通过对MiNENs进行等位基因分型分析,发现在染色体17p、18q、5q通常存在相同的杂合性缺失。而在其中1例碰撞瘤中检测到MiNENs中的两种成分存在完全不同的等位基因,提示两种肿瘤成分虽相邻生长,但具有不同的成瘤途径。我们报道的病例中NECs和SCC两种成分共存,过去对于这两者的关系研究较为缺乏,需要更多的研究进一步证实两者共存的发生机制。综上所述,在MiNENs起源方面,需要根据肿瘤细胞的存在形式和特征等方面进一步进行探讨,也需要更多的研究证实。
胃MiNENs患者无特异性临床表现,多表现为腹痛。本例患者以腹痛就诊,无神经内分泌肿瘤激素相关症状。诊断主要依靠影像学、内镜检查和病理检查等综合评估。由于术前穿刺时取材受限,且肿瘤多为低分化癌,故确诊主要依靠术后病理。胃MiNENs的治疗方式需要根据肿瘤的组织学成分、分化程度及患者临床表现等制定个体化方案。对于病灶可切除患者均应采用手术切除,术后辅助化疗或分子靶向治疗。手术方式与胃AC无异,对原发性肿瘤和转移瘤进行完全的手术切除(R0切除)[9]。辅助放化疗是治疗的重要组成部分,可显著提高患者生存率。
一项回顾性研究显示,胃MiNENs的疗效取决于主要成分的性质,而不是各成分在肿瘤组织中所占的比例大小,且肿瘤中的神经内分泌成分和分期影响患者预后[10]。由于胃MiNENs中的不同成分(外分泌成分和神经内分泌成分)对化疗反应性不同,因此,选择合适的化疗方案是胃MiNENs患者治疗中最具挑战性的部分,建议针对肿瘤中最具侵袭性的成分进行治疗。与单纯的AC或NECs相比,胃MiNENs具有更强的侵袭性,肿瘤多转移至肝脏及淋巴结,且多为神经内分泌成分[11]。而在我们的病例中,混合瘤中的两种成分均发生淋巴结转移,提示患者预后不佳。根据欧洲神经内分泌肿瘤学会指南,顺铂和依托泊苷被认为是治疗胃肠道低分化NECs的有效药物[12]。长效生长抑素类药物(奥曲肽)可用于缓解晚期患者的类癌症状。此外,不同的转移方式在诊治及评估预后方面亦发挥重要作用。由于该病罕见以及复杂的组织学组成,有关该病的临床资料较少,其生物学行为及预后仍难以预测,有碍制定统一的治疗指南。综上所述,对于胃MiNENs的治疗应首选手术切除,术后辅助放化疗以提高患者预后。
综上所述,胃MiNENs是一种侵袭性强,进展快的疾病。其确诊主要依靠术后组织病理形态及免疫组织化学方法。对于同时伴有神经内分泌癌和低分化鳞状细胞癌的患者,推荐针对肿瘤组织中侵袭性较强的部分进行综合治疗,最佳的治疗方案有待进一步的研究。
- 胃肠病学和肝病学杂志的其它文章
- 巨大胆总管囊肿1例报道

