三维成球培养优化间充质干细胞的研究进展
梁 瑜,乔 勇,刘星志,3,徐中娟,3,朱小立,索广力
(1.上海大学生命科学学院,上海 200444)(2.中国科学院苏州纳米技术与纳米仿生研究所,江苏 苏州 215123)(3.中国科学技术大学纳米技术与纳米仿生学院,安徽 合肥 230026)
1 前 言
间充质干细胞(mesenchymal stem cells, MSCs)来源于发育早期的中胚层,是具有高度自我更新能力和多向分化潜能的间质细胞,属于多能干细胞。MSCs最初在骨髓[1]中发现,后经研究证实其广泛存在于多种组织器官中,包括骨髓、脂肪、脐带血、羊膜、胸腺、牙髓、外周血、脐带等[2-4]。在体内或体外特定的诱导条件下,MSCs可分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经、肝、心肌、内皮等多种组织细胞[5, 6],经过连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复。同时,研究发现将MSCs作为细胞治疗的介质是安全且不具有潜在危险的,这为MSCs的广泛应用提供了坚实的基础[7-10]。MSCs因具有来源广泛、有多向分化潜能、免疫调控和自我更新等特点而日益受到人们的关注。截止到目前,MSCs已被广泛应用于移植物抗宿主病(graft-versus-host disease, GVHD)、再生障碍性贫血、急性心梗、肝损伤、脑卒中、骨发育不全、肌萎缩侧索硬化症、系统性红斑狼疮、系统性硬化症、克隆氏病、中风、糖尿病、糖尿病足、肝硬化、关节炎、支气管肺发育不全、脊髓损伤等多种疾病[11-28]的治疗,并获得了明显的治疗效果。截止到2020年3月,全球登记在册的 MSCs用于治疗的临床试验为1070例,我国为246例[29]。
虽然MSCs被广泛应用于不同疾病的治疗,并表现出鲜明的优势,但在应用中仍面临诸多问题:如临床细胞的大量需求难以满足、细胞质量的异质性、移植后体内存活能力差、体外2D贴壁培养造成MSCs特征变异和其治疗疾病的具体机制未知等。
其中,最现实的问题就是如何在体外培养出足够数量且优质的MSCs以满足临床需求。临床治疗中,MSCs的需求量为0.5×106~2×106kg-1,一般输入治疗4~8次,按平均体重75 kg和治疗6次计算,单个病人的细胞需求总数量达到4.5×108个,需要获取足够量的原代MSCs并进行多次体外传代(可能达到10次以上)才能满足[30-33]。目前,传统的2D贴壁培养方式仍为MSCs体外快速培养的主要方式。研究证明,随着传代次数的增加和培养时间的延长,MSCs会逐渐减弱甚至丧失分化和旁分泌能力,其生物学特性可能发生根本变化[34, 35]。由于以上问题,MSCs注入机体后还会面临或导致其他诸多问题:① 细胞的存活能力差,不能有效地忍耐机体中的各种胁迫,诸如缺氧、营养不足和血液悬浮造成的失巢凋亡(anoikis)等;② 大量活力差或凋亡的细胞注入机体导致炎症和不良免疫反应;③ 不能有效抑制T细胞的杀伤作用,不能有效分泌各种有益的细胞因子和生长因子,以提高机体的免疫力;④ 细胞的特有干细胞特性丧失,从而失去某些特有的损伤修复功能。所以,在体外扩增足够多MSCs的同时,又能保证其活力和主要的生物学特性不发生变化,是急需解决的科学问题。
生物体内的细胞是在3D的立体微环境中生长的,虽然2D培养可以快速增殖MSCs,但并不是细胞生长的天然状态,培养微环境与机体内微环境差异太大,会影响细胞的基因表达、信号转导等,导致所培养的细胞逐渐丧失其在生物体内的生物学特性及功能,还会导致细胞在分化能力和活力等方面的异质性[34, 35]。3D培养技术的应用,为细胞在体外培养的过程提供了一个更加接近体内生存条件的微环境,更有利于细胞的增殖、存活以及本身特性的保持。与传统的2D贴壁培养相比,3D培养形成球状细胞聚集体(multicellular spheroid, MCS),被认为是模拟更真实的机体内生存环境。3D培养细胞球已经被广泛应用于干细胞临床医学和再生医学研究等领域,并在许多体外实验及临床前动物研究中显示出良好的效果[36-38]。
本文对MSCs体外3D成球培养的方法进行了总结,并综述了3D成球培养对MSCs生物学特性和功能的影响。针对MSC 3D成球培养在应用中急需解决的具体问题及其优化干细胞的生物学机理的研究进行了讨论和展望。
2 3D成球培养的MSCs的生物学特性
对细胞进行3D成球培养时,这种在体外生长的过程更加接近体内生存条件的微环境,因而更有利于细胞的增殖和存活以及本身特性的保持。相较于2D培养的细胞,3D成球培养的MSCs在生物学特性和功能方面会发生巨大变化。
2.1 细胞的形态和性状发生改变
形态上,3D培养的细胞不再二维贴壁生长,而是立体成球,细胞核较大而细胞体积明显缩小,仅为贴壁培养时细胞体积的约1/4,因此在静脉注射细胞时,细胞肺栓塞几率降低,经过心、肝、脾、肾的细胞数量增加了25%[39]。
细胞形态发生变化,细胞骨架也随之改变。3D培养的细胞其细胞球周围生成的细胞外基质(extracellular matrix, ECM)比2D培养的细胞要多[40]。细胞中的整合蛋白和ECM相互作用形成聚集体,然后通过介导细胞间粘附的钙黏蛋白建立连接,使细胞重构成球[41, 42]。
2.2 细胞存活能力增强
当细胞成球培养时,细胞增殖缓慢,细胞的抗凋亡和抗衰老能力增强。Qiao[43]等研究发现,细胞凋亡标志物Cleaved Caspase-3相较于2D培养的细胞表达水平降低。当恢复成贴壁培养时,衰老相关的基因表达水平降低,增殖能力增强。在缺氧条件下,缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的表达量升高,早期凋亡的细胞数量较少。Cheng等[44]研究也发现3D成球培养中抗凋亡基因 Bcl-2高表达、促凋亡基因 Bax低表达,使得MSCs寿命增加并延缓衰老。Lee等[45]在小鼠缺血的肢端组织中分别皮下注射入成球培养和贴壁培养的MSCs,对比发现MSCs细胞球在小鼠体内移植区的增殖能力比相应2D培养的细胞增殖能力更强。
2.3 MSCs抗炎症和旁分泌能力增强
大量研究表明,MSCs成球培养可以增强细胞的抗炎症和免疫调节能力以及旁分泌能力。悬滴法制备的人骨髓间充质干细胞球,其分泌斯氏降钙素1(Stanniocalcin-1,STC-1)和肿瘤坏死因子α诱导蛋白6(TNF-stimulated gene 6 protein,TSG-6)的能力得到增强[39]。将细胞球注射入小鼠腹膜炎模型中,检测发现炎症标志物如白细胞介素-1β(Interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等表达水平均显著降低。Li等[41]研究发现MSCs细胞球旁分泌的多种细胞生长因子与贴壁培养的MSCs相比均有增加, 其中肝细胞生长因子(hepatocyte growth factor,HGF)和转化生长因子-β3(transforming growth factor-β3, TGF-β3)的旁分泌能力显著优于单层贴壁培养的MSCs。通过成球培养,增强了人脂肪来源的间充质干细胞(human adipose tissue derived mesenchymal stem cells,hADMSCs)的存活和旁分泌能力,进而促进缺血组织的血管生成,提高治疗效果[46]。与单层培养相比,成球培养的细胞能更有效地适应低氧环境,上调缺氧适应信号(即基质细胞衍生因子-1α(stromal cell-derived factor-1α,SDF-1α)和HIF-1α并抑制凋亡,促进血管生成和抗凋亡因子(即肝细胞生长因子、血管内皮生长因子和成纤维细胞生长因子2)的分泌。
2.4 MSCs自我更新能力和多向分化潜能增强
3D成球培养可以维持MSCs干性,通过提高MSCs的多潜能相关基因Nanog的表达,来增强细胞的多向分化潜力[47, 48]。Cheng等[44]研究也发现,与贴壁培养的MSCs相比,3D成球培养的MSCs细胞球中 Nanog、Sox-2、POU5FI/OCT4等多能干细胞标记物的表达显著增强,证明了3D成球培养可增强MSCs的多向分化潜能。
3 体外3D成球培养的方法
3.1 多细胞聚集式3D成球培养的方法
目前报道的3D成球培养大多是利用细胞聚集成团形成球状细胞聚合体,并在3D环境中增殖培养形成3D细胞球。这里介绍其中几种典型的干细胞3D成球培养方法。
3.1.1 悬滴法3D培养干细胞球
Foty[49]报道了3D培养干细胞球的悬滴法。首先将细胞液滴加在组织培养皿皿盖内部,每一滴的体积为15~30 μL,包含300~3000个细胞。翻转培养皿皿盖,悬滴因表面张力会悬挂在培养皿皿盖上,重力作用下,悬滴中的细胞彼此间直接接触且与细胞外基质接触,在悬滴底部形成单一球体,之后在生理条件下培养,直至形成真正的3D球状体。Kelm等[50]将孔板的每个孔结合特异性抗体,该抗体可特异性结合血管内皮生长因子(vascular endothelial growth factor,VEGF),然后把人主动脉成纤维细胞(human aortic fibroblasts,HAF)以梯度浓度接种到每个孔中,并将平板倒置以形成悬滴和细胞球。之后除去培养基和细胞球,使用酶联免疫吸附剂测定法(enzyme linked immunosorbent assay,ELISA)和显色读数以定量基于细胞球的VEGF产生。(图1)。这种方法不需要特殊的设备,能够生产特定大小、具体细胞数量的球体,可用于测量生物力学性质或用于生理学相关模型中的分子和生物化学分析,但是难以实现大规模生产。
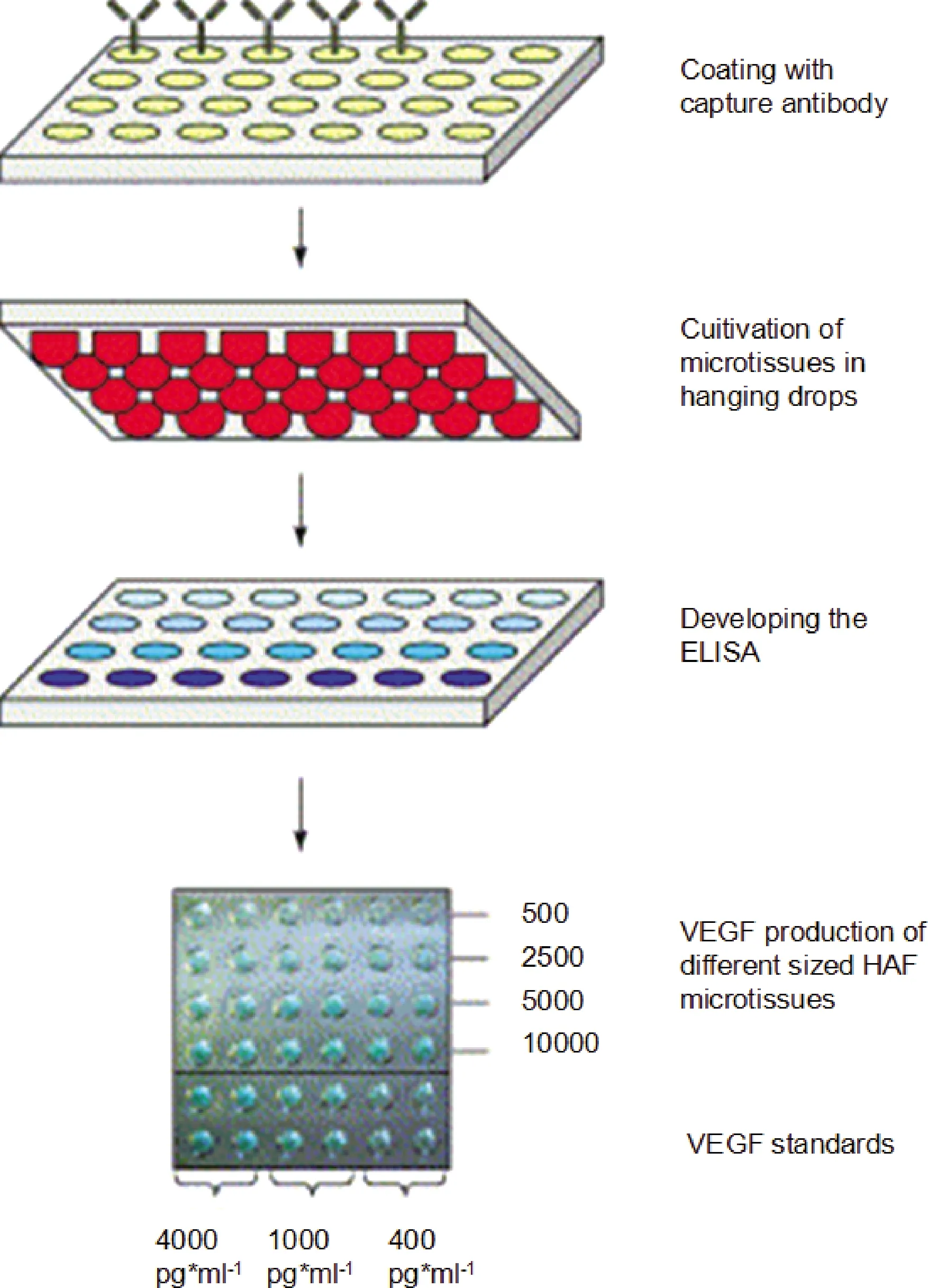
图1 悬滴法三维培养干细胞球[50]Fig.1 A hanging drop cell culture protocol for generation of 3D spheroids[50]
3.1.2 微图案法3D培养干细胞球
Wang等[51]报道了基于光刻和微图案化技术进行3D成球的培养方法。首先在玻璃板上涂覆胶原蛋白和聚乙二醇,接着在基质区域上形成大小一致的微图案孔,从而制备出尺寸精确、质量均匀的MSCs球体,然后诱导分化为脂肪细胞和成骨细胞。基因芯片分析表明,3D球体培养体系诱导的MSCs分化效率高,不仅可以上调成脂、成骨相关基因的表达水平,还可以通过下调维持MSCs自我更新能力的基因来调控基因表达。光刻的图案还能根据实际需要进行变化。该方法获得的球体大小较为一致,但制作较为复杂,获得的细胞数量较少。
3.1.3 低吸附表面培养法3D培养干细胞球
该方法主要是将细胞接种在本身吸附力较低的培养皿或孔板中,或者通过在培养器皿上覆盖低粘附的聚合物涂层使细胞悬浮成球[52]。该方法简单,但获得的细胞球大小不一致,成球质量不高,细胞球大小受细胞接种密度影响,成球形状因细胞种类的不同而改变。
3.1.4 动态悬浮法3D培养干细胞球
为了获取大量的细胞球,研究者们开始利用生物反应器进行细胞培养,其类型包括搅拌式生物反应器[53]、旋转式生物反应器[54]、灌流式生物反应器[55]及中空纤维膜反应器[56]等。反应器的优点是可以获取足够数量的细胞、反应参数可以调节。但是搅拌式和旋转式反应器中产生的机械剪切力和培养基泡沫对细胞有损伤,采用灌流式反应器时细胞分泌因子和营养流失较为严重。它们共同的缺点是,细胞成球形状和大小不可控,细胞异质性严重。
3.1.5 壳聚糖膜等基质介导法3D培养干细胞球
台湾大学高分子科学与工程研究所的黄国祥等[57]通过壳聚糖膜法3D培养干细胞球。首先在壳聚糖膜和使用透明质酸(hyaluronan,HA)进一步修饰的壳聚糖膜(壳聚糖-HA)上培养从人类脂肪组织来源成体干细胞(human adipose tissue derived adult stem cells, hADAS)和人胎盘间充质干细胞(human placenta tissue derived mesenchymal stem cells, hPDMC)中分离的MSCs,将hADAS和hPDMC(每种细胞3×104个)接种在24孔组织培养板中的每个膜上。观察到两种来源的MSCs形成3D球状体与MMP-2表达增加有关,且壳聚糖-HA上的细胞形成球状体更快,球状体的尺寸大于单独的壳聚糖(图2)。同时,发现在壳聚糖膜和壳聚糖-HA膜上形成粘附的球状体可以更好地维持MSCs的干细胞特性标记基因的表达,并增加它们的软骨分化能力,可作为软骨组织工程的新细胞来源。球体形成的调节机制依赖于Rho/Rho相关激酶(Rho/Rho-associated kinase,ROCK),值得进一步研究。不过该方法获得球体的效率不高,球体形状不统一。
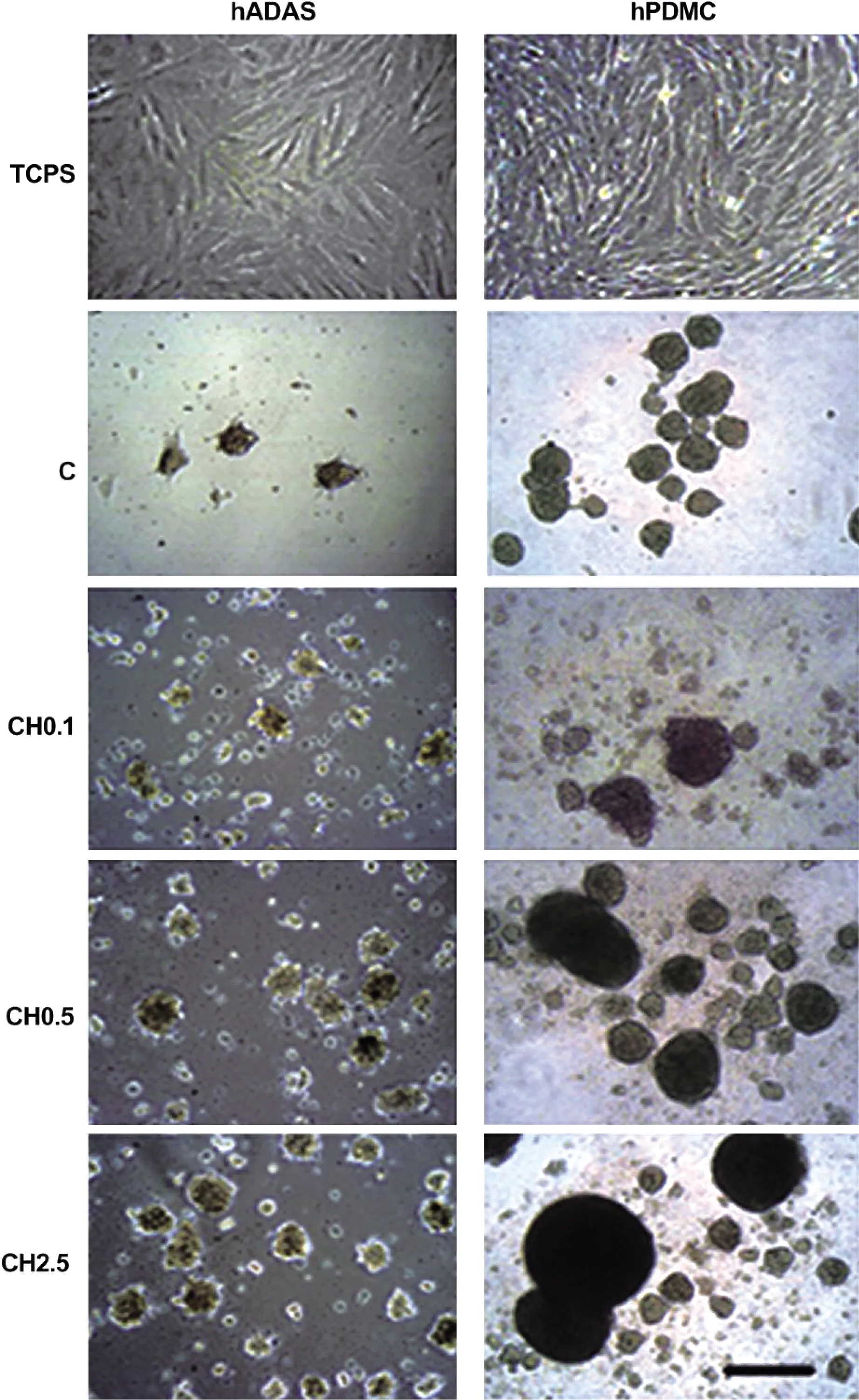
图2 壳聚糖膜法三维培养干细胞球[57]Fig.2 Spheroid formation of mesenchymal stem cells on chitosan and chitosan-hyaluronan membranes[57]
3.1.6 微流体法3D培养干细胞球
杜克大学生物医学工程系的Chan等[58]使用微流体法3D培养干细胞球。微流体与支架的整合被认为是一种有前景的体外培养MCSs新方法,因为它不仅可以受控产生尺寸均匀的MCSs,还可以恢复细胞-细胞之间以及细胞-基质之间的相互作用,该相互作用对MCSs形态和功能至关重要。微流体装置主要由两根微米级通道组成,一根提供持续流动包含细胞的水相液体,另一根提供持续流动的油相液体。将包含细胞的水相液体通入油相液体中,由于水油不相容,在流动的油相液体中生成含细胞的水相微球,微球中的细胞聚集在一起形成多细胞球。通过控制动态参数,微流体装置可控制细胞在微米级通道内的流动,创造出独特的环境以满足多细胞球体的生产要求(图3)。这种方法还可以通过减少剪切应力来减小细胞损伤,其中的微流室可以控制多细胞球体的尺寸。而支架提供的物理基质支持可以促进MCSs分秘ECM。该方法还能够调节MCSs形成和生长的微环境以模拟体内条件,而且具有商业化的潜力。这种基于液滴的方法能够快速生产多细胞球体,且效率高,唯一的不足就是需要特定的设备。
多细胞成球的培养方法还有很多。例如借助外力作用使细胞成球的方法,通过离心法使细胞成团进而聚集生长成球,球体通常较大,核心区域缺氧,这种方法临床应用较少,但适用于研究骨再生[59]。细胞装载磁性纳米颗粒通过磁场诱导使细胞聚集成球[60],可用于阐明细胞-细胞之间的相互作用和研究药物传递基质,但引入外来材料涉及材料的代谢时程和安全性问题,不适用于临床治疗,且细胞尺寸不可控,无法避免外力对细胞的损伤。基于表面声波技术的3D声学镊子也可以用于制备多细胞球体,该方法可以连续制造150多种尺寸可控的球体,同时每30 min可将细胞球转移到培养皿中。该技术可实现快速高通量,但需要特殊设备[61]。
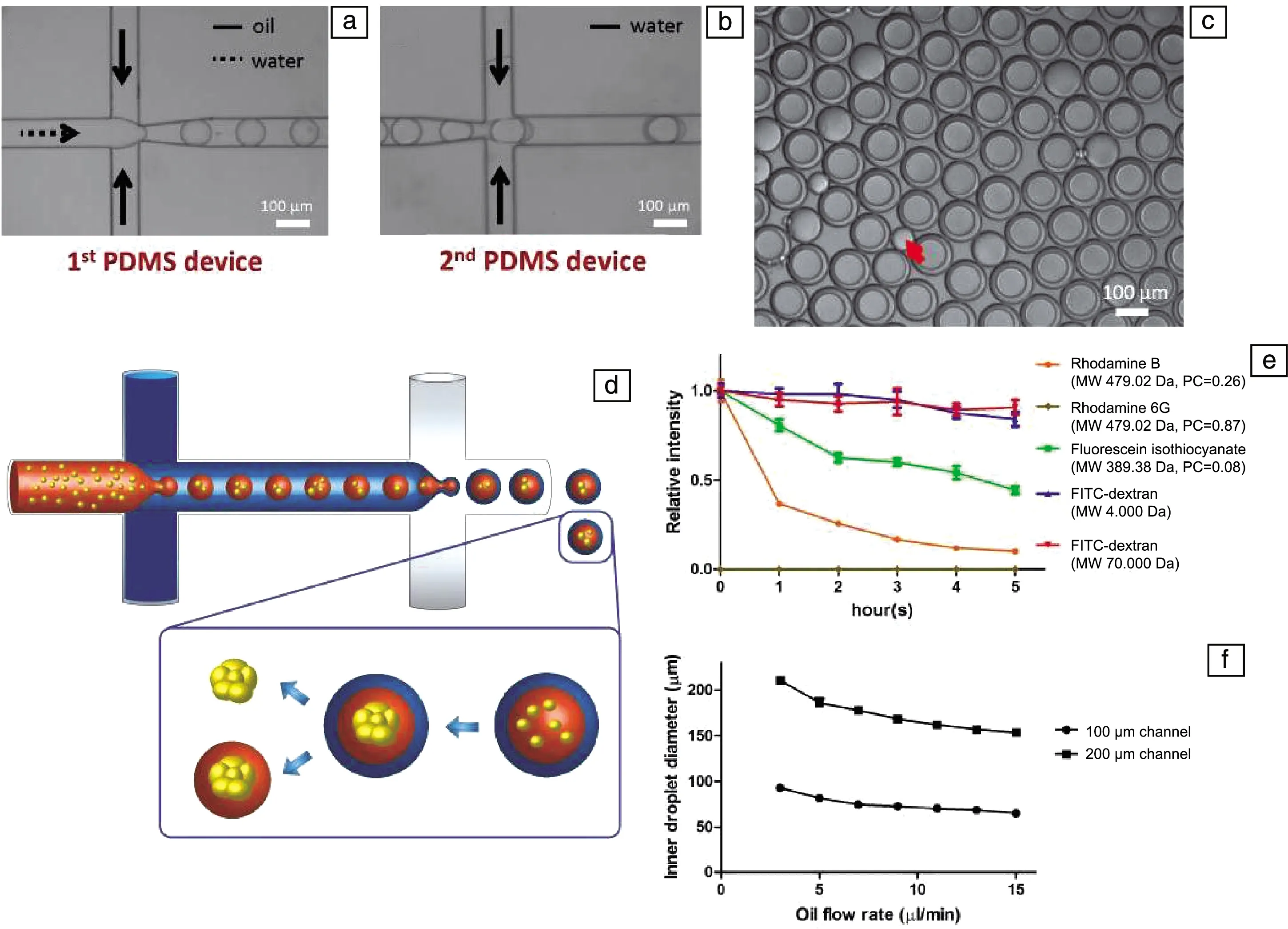
图3 微流体法三维培养干细胞球[58]:(a,b)在两个流动聚焦装置中形成水-油和水-油-水乳剂;(c)包封在液滴中的细胞组装形成单个球状体,随后可以在有或没有微凝胶包封的情况下释放;(d)收集后在100 μm通道宽度的装置中产生的液滴,红色箭头表示作为副产物产生的空油滴;(e)不同染料包裹在液滴中的扩散曲线,图例中提供了染料的分子量(MW)和分配系数(PC);(f)内部水相流速固定2 μL/ min,通过改变油相流速(n≥30)来控制液滴的核心尺寸Fig.3 Three-dimensional culture of spheroids generation by microfluidic[58]: (a, b) Formation of w/o and w/o/w emulsions in two flow-focusing devices; (c) Schematic diagram showing how droplets are generated and spheroids are formed. Cells encapsulated in droplets assemble to form a single spheroid, which can be subsequently released with or without microgel encapsulation; (d) The appearance of droplets generated in device with 100 μm channel width after collection. The red arrow indicates an empty oil droplet generated as side product; (e) Diffusion curve of different dyes encapsulated in droplets. Molecular weight (MW) and partition coefficient (PC) of the dyes are provided in the legend; (f) Size of core of droplets controlled by fixing inner aqueous phase flow rate at 2 μL/min and altering oil phase flow rate (n≥30)
多细胞聚集3D成球培养有一个明显的缺陷,就是多个质量良莠不齐的细胞聚集的3D培养无法对细胞的质量异质性起到筛选的作用。另外,在尺寸不可控的较大3D细胞球中,不同部位的细胞会由于营养的不均衡导致质量的异质性,比如在细胞球中心部位的细胞,因缺少营养、缺氧和失巢凋亡而衰老、凋亡或变异等。
3.2 单细胞3D成球培养的方法
最近的研究报道了一种新颖的、基于细胞芯片单MSCs 2D阵列和3D培养的单细胞来源细胞球培养方式,可显著地优化脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)的质量。作者团队和中国科学院遗传与发育生物学研究所的戴建武实验室合作,通过细胞芯片使单细胞和可控数量的多细胞分别形成2D阵列,并结合细胞3D培养技术,创新性地发展了一种可大量生产单细胞来源细胞球(single cell derived sphere, SCDS)和可控的多细胞来源细胞球(multiple cell derived spheroid,MCDS)的方法(图4),建立SCDS和均一MCDS的生产体系[43]。在该研究中,大量的实验数据证明,与2D和MCDS相比,用SCDS培养UCMSCs对间充质干细胞特征维持、细胞迁移、存活、抗衰老和胁迫耐受等方面有显著的优化作用。动物实验的数据显示,用SCDS培养UCMSCs可以显著增加异种移植体内的血管生成量。在小鼠急性肝损伤动物模型中,SCDS培养的UCMSCs表现出更好的归巢能力和创伤组织修复能力。
显然,相较于2D和MCDS细胞培养,SCDS培养对UCMSCs在细胞治疗中有非常显著的优化作用,其主要原因在于:① SCDS细胞培养是以干细胞自我更新能力为标准和理论依据来优化UCMSCs,干细胞的自我更新能力表现为单个细胞的增殖能力,单细胞芯片上单细胞2D阵列结合3D细胞培养技术获得的SCDS,既是对细胞自我更新能力的筛选,也是对细胞自我更新能力的驯化和恢复;② 通过筛选和驯化,SCDS培养的UCMSCs在细胞活力和生物学特性方面实现均一化,部分地消除了细胞的异质性;③ SCDS的尺寸较小,通常在50 μm以下,可以不通过酶解,直接用于机体注射; ④ 与MCDS相比,SCDS中的单细胞具有较好的均一性,每个细胞所处的微环境较为一致;⑤ 与2D培养的细胞相比,SCDS球体表面有基质保护,使细胞更易于抵抗不利的生存环境,如酸、碱、酶解、缺氧和缺营养等;⑥ 与2D培养的细胞相比,SCDS的离散度更高,利于细胞在机体内的运输和分布并减少细胞聚集;⑦ SCDS培养的细胞更易进入G0期并促进AMPK的激活,利于细胞保持干细胞特性、抵抗不利生存环境;⑧ 由一个细胞分裂出的几个子细胞在一个有限的发育环境中有机地相互作用,有利于形成功能单位,并易于在体内较快地行使功能;⑨ SCDS在不良生存环境中的耐受性可能使其更好地应用于3D生物打印和类器官构建研究;⑩ 细胞芯片生产的细胞球具有细胞数可控和均一化特征,易于在生产中实现标准化。
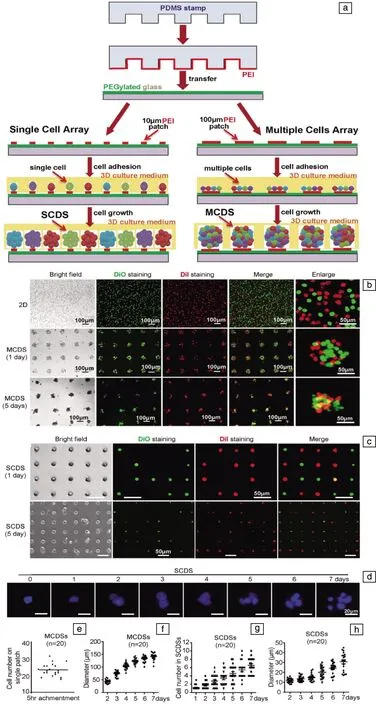
图4 三维培养单细胞来源干细胞球[40]:(a)细胞芯片的制备和3D培养形成SCDS的流程图;(b,c)细胞芯片上SCDS和MCDS的表征,UCMSCs培养形成的2D、MCDS和SCDS细胞进行双染实验获得的代表性照片;(d)SCDS培养0~7天的的荧光图,细胞核被Hoechst 33342染成蓝色;(e)用散点图统计最初接种在直径为100μm孔上粘附的细胞数;(f)统计培养2~7天形成MCDS时的细胞球尺寸;(g,h)用散点图统计培养1~7天形成SCDS的细胞数、细胞球尺寸,n=20Fig.4 Three-dimensional culture of single cell-derived stem cell spheres[40]: (a) The scheme of cell chip fabrication and SCDS formation in 3D culture; (b, c) The characterization of SCDS and MCDS on cell chips, epresentative images of double staining experiment using 2D, MCDS and SCDS cultured UCMSCs; (d) The fluorescent images of SCDS from 0 day to 7 days, the nuclei of cells were stained by Hoechst 33342 as blue color; (e, f) The scatter diagram of initial cell number on one 100 μm diameter of patch and diameter of MCDS cultured from 2 to 7 days; (g, h) The scatter diagram of cell number within one SCDS and diameter of SCDS cultured from 1 day to 7 days, n=20
4 3D成球培养优化MSCs的展望
3D培养的细胞球较2D培养的细胞在存活、因子分泌、干细胞特性保持、迁移、抗衰老、抗炎和血管生成等方面有较大的优势,预示着其在未来的组织创伤修复的临床应用中有很好的前景。但是,也面临诸多的问题。
4.1 MSCs成球制备方法的局限性
虽然目前传统3D成球方法制备的多细胞球体具有众多优势,但是明显的缺陷限制了多细胞球体在研究和治疗领域的应用。首先,多细胞球体是由多个活力上有差异的细胞混合形成的球体,细胞的质量存在较大的异质性。其次,尺寸较大的多细胞球体内部存在营养物质、氧气和废弃物代谢等差异,球体中心的细胞很难获得足够的营养物质和氧气条件,产生的废弃物也很难及时代谢到环境中,影响了基因表达水平,甚至可能导致基因突变,从而影响细胞的质量。而且,多细胞球体中心的细胞由于缺少细胞外基质的支撑,易发生失巢凋亡。此外,损伤的细胞在体内可能引起不良的免疫反应。因此,需要获得便于均一化、标准化,能够进行质量控制和评估的制备方法,同时还需要能够大量生产以满足临床需要。作者团队建立的单细胞来源成球(SCDS)的培养方法,可以对单个细胞进行质量的筛选和驯化,在一定程度上实现了质量的均一性。但在未来,该方法需要优化工艺,攻克3D培养生物材料制备和细胞球自动化规模生产的难题。
4.2 需要深入研究3D成球培养优化MSCs的机理
在以往的治疗模型中,通过细胞因子、缺氧、营养不良培养基/雷帕霉素诱导剂诱导自噬、热休克、氧化应激或化学物质对MSCs进行预处理,可以促进移植后的细胞存活或功能[62]。用IL-1β和/或干扰素-γ预处理骨髓间充质干细胞可以提高其对直接葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎的治疗效果[63]。3D成球培养的MSCs对细胞存活和抗炎症也有促进作用,因此研究3D成球MSCs模型的生物学特性及其在不同病理条件下发挥治疗作用的机制可以为今后的临床应用提供指导。
目前已有大量的研究对MSCs成球机理进行探索,但仍然不够全面。需要引入先进的生物学技术如单细胞测序分析等,加强分子生物学水平的机理研究,从细胞信号转导、能量代谢、微环境调控、表观遗传调控等方面进行解析,找到参与干细胞优化的关键调控因子和通路等。深入的机理研究将有助于:① 建立干细胞优化评估标准;② 筛序优化干细胞的小分子化合物,探索出优化MSCs的新方法;③ 标准化临床治疗方法等。
4.3 协同MSCs球作用的生物材料研究
1999年,Horwitz等[64]利用骨髓间充质干细胞成功治疗了3个婴儿成骨不全的病例,并在临床上初次验证了MSCs可以异体移植且分化融入异体中,此后出现了越来越多的临床应用。不同的临床症状需要使用不同的干细胞治疗方式。
当治疗需要进行体内血管注射入细胞时,细胞球的尺寸要小,对细胞的归巢能力及均一化要求较高;在组织重塑和表面修复时,可以进行局部注射。相较于贴壁培养的细胞,细胞球更适合作为种子细胞结合生物材料进行组织工程类的修复。而寻找合适的支架材料,调节细胞球与支架材料的接种密度、作用比例显得尤为重要。此外 ,对生物支架的降解能力、弹性模量、空间孔隙大小及组织相容性都需要进行考虑。另外,还可以利用水凝胶等支架材料模拟干细胞生长的微环境(细胞因子、理化信号的刺激及力学刺激),使干细胞球更好地发挥作用。还可以构建复合型的功能材料,模拟微血管系统,使其在体内发挥更好的治疗效果。
5 结 语
MSCs细胞球在体外和体内的生物学特性证实了3D成球培养对MSCs的优化作用,显示了其在再生医学和组织工程临床应用中的巨大应用潜力。3D细胞球整合了细胞-细胞以及细胞-基质间的相互作用,对其深入研究,有助于了解体内组织间相互作用的机制,为生物组织工程的研究提供理论依据。干细胞的临床应用还处于初始阶段,需要建立健全有效的质量评估体系,研发新的方法和工艺,针对特定的临床需求,大规模生产质量均一的MSCs。此外,在干细胞不同的临床应用中,需要不同性质的生物材料的配合使用,通过优化生物材料的性能,定向诱导分化达到更好的应用效果。相信随着研究的不断深入,MSCs多细胞球体的应用前景也将越来越广阔,为不同组织创伤修复提供更有效的解决方案。

