胃癌中FOXD3的表达及其与β-catenin表达的相关性
邹长棪,林华妹,胡 丹,苏 颖,夏 言,郑雄伟,3,林贤东,3
胃癌是最常见的恶性肿瘤之一,病死率位居恶性肿瘤的第3位[1]。虽然近年胃镜检查等早期筛查手段逐渐得到重视,新辅助化疗、手术、靶向药物治疗等肿瘤综合治疗手段显著提高,但全球胃癌的发病率和病死率仍呈上升趋势[1-2]。因此,探索胃癌在分子水平的发生、发展,积极寻找有效的早期检测手段和治疗方法是胃癌防治的迫切任务。叉头框转录因子D3(forkhead box D3, FOXD3)是FOX转录因子家族的重要成员之一,参与胚胎发育和胚胎干细胞、神经嵴细胞系的形成、迁移和分化[3]。在肿瘤的发生、发展中起重要的调控作用,慢性淋巴细胞白血病、黑色素瘤、结直肠癌、乳腺癌、肝癌和肺癌等均可见FOXD3异常表达[4-7]。本实验采用免疫组化EnVision法和qRT-PCR法检测FOXD3在胃癌及癌旁组织的表达,初步探讨其表达水平与胃癌临床病理特征及预后的关系,通过分析FOXD3与β-catenin表达的关系,探讨FOXD3与肿瘤信号通路的相关性。
1 材料与方法
1.1 临床标本 收集2014~2015年福建省肿瘤医院存档的78例胃癌手术切除标本,并取相应的癌旁组织作为对照组,患者术前均未接受过任何治疗,术后经病理学证实为胃癌。78例胃癌中,男性61例,女性17例,中位年龄61岁(39~82岁)。新鲜组织获取后立即放入液氮保存,随后转入-80 ℃冰箱保存,整个收集过程及保存过程均按照无酶原则操作。随访时间从明确诊断开始至末次随访或死亡,以月为单位。本实验经福建省肿瘤医院伦理委员会批准,所有纳入患者均在术前签署知情同意书。
1.2 主要试剂和仪器 Trizol、qRT-PCR提取试剂盒购自德国QIAGEN公司,qRT-PCR扩增试剂盒购自德国罗氏公司LightCycler 480 SYBR Green I Master,β-catenin购自北京中杉金桥公司,DAB显色试剂盒购自罗氏公司。PCR扩增仪为Eppendof Mastercycler Gradient公司。qRT-PCR仪器为Roche LightCycler 480Ⅱ。全自动免疫组化染色仪为罗氏公司Benchmark XT。
1.3 qRT-PCR 取100 mg冻存新鲜组织液氮环境下研磨成粉末状,加入1 mL Trizol,静置10 min后抽提mRNA。使用分光光度计测定RNA浓度。按照逆转录试剂盒操作说明书将提取RNA逆转成cDNA,-80 ℃保存备用。qRT-PCR按照SyberGreen说明书配制反应体系,反应条件如下:95 ℃ 10 min、95 ℃ 2 s、60 ℃ 20 s、70 ℃ 10 s,40个循环;进行熔解曲线检测。每个样本设3个复孔,实验重复3次。以GAPDH为内参基因对各基因表达进行标准化,同时以T-177892癌组织表达为准(calibrator)对其他标本进行量化,即它的表达量设为1,量化其他样本的表达量;采用2-ΔΔCt法计算相对表达量的RQ值,为了便于统计,把RQ值取lg进行分析[8]。
1.4 免疫组化 免疫组化染色采用EnVision法,将石蜡包埋组织4 μm厚切片,操作步骤严格按照试剂盒说明书进行。β-catenin(UMAB15,北京中杉金桥公司)为即用型抗体,用罗氏全自动免疫组化染色仪染色,孵育40 min,完成自动染色过程。阳性对照采用已知阳性病例,阴性对照用PBS代替一抗。β-catenin表达定位于胞核。染色评分标准:镜下以细胞核出现棕黄色或棕褐色颗粒为阳性。采用半定量积分法判断结果。(1)按阳性细胞百分率计分:阳性细胞数占1%~10%为1分,11%~50%为2分,≥51%为3分;(2)按细胞染色强度计分:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分结果相乘:0~4分为阴性,5~9分为阳性[9]。结果由两位病理科医师判定。
1.5 统计学分析 采用SPSS 17.0软件进行统计学分析,配对资料的比较采用配对t检验;两组间的比较先进行正态性检验及方差齐性分析,后进行两独立样本t检验;采用χ2检验或Fisher精确概率法进行免疫组化结果分析;采用Spearman进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 qRT-PCR法检测FOXD3 mRNA在胃癌及癌旁组织中的表达 qRT-PCR法检测78例胃癌及癌旁组织中FOXD3 mRNA的表达,结果显示胃癌组织中FOXD3 mRNA的表达量为0.146±0.036(lgRQ,RQ=2-ΔΔCt),相应癌旁组织中的表达量为-0.379±0.107,上调3.35倍,两组间差异有统计学意义(P<0.01,图1)。表明FOXD3 mRNA在胃癌组织中的表达水平高于癌旁组织。
2.2 FOXD3蛋白表达与胃癌临床病理特征的关系 将78胃癌按照WHO组织分型,中+高分化胃癌组32例,FOXD3的表达量为0.24±0.04;低分化胃癌组46例,表达量为0.08±0.05,两组间差异有统计学意义(P=0.03)。按照Lauren分型,肠型胃癌组29例,FOXD3的表达量0.23±0.05;弥漫型胃癌组49例,表达量为0.09±0.05,两组间差异有统计学意义(P=0.04),表明FOXD3表达与胃癌分化程度和Lauren分型密切相关。而FOXD3表达与患者性别、年龄,肿瘤部位、大小、淋巴结转移、神经侵犯、脉管侵犯及EBER感染无显著相关性(P>0.05,表1)。

图1 qRT-PCR法检测FOXD3 mRNA在胃癌及癌旁组织中的表达:红线表示每组的平均值
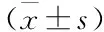
表1 FOXD3蛋白表达与胃癌临床病理特征的关系
*P<0.05
2.3 FOXD3表达与胃癌患者预后的关系 78例胃癌组织中FOXD3的相对表达量lgRQ符合正态分布,故取中位数0.18将其分为高表达量组(41例)和低表达量组(37例)。
78例胃癌患者从明确诊断开始随访,随访时间1~49个月,其中27例死亡,9例失访。FOXD3高表达组36例,死亡19例(52.8%),平均生存时间(31.7±3.1)个月;FOXD3低表达组33例,死亡8例(24.2%),平均生存时间(38.4±2.7)个月。采用Kaplan-Meier法绘制生存曲线,结果显示FOXD3高表达组总体生存率(overall survival, OS)比低表达组差,差异有统计学意义(P=0.046,图2)。
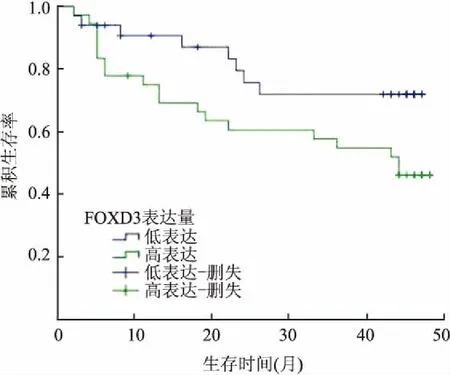
图2 FOXD3表达胃癌患者的生存曲线
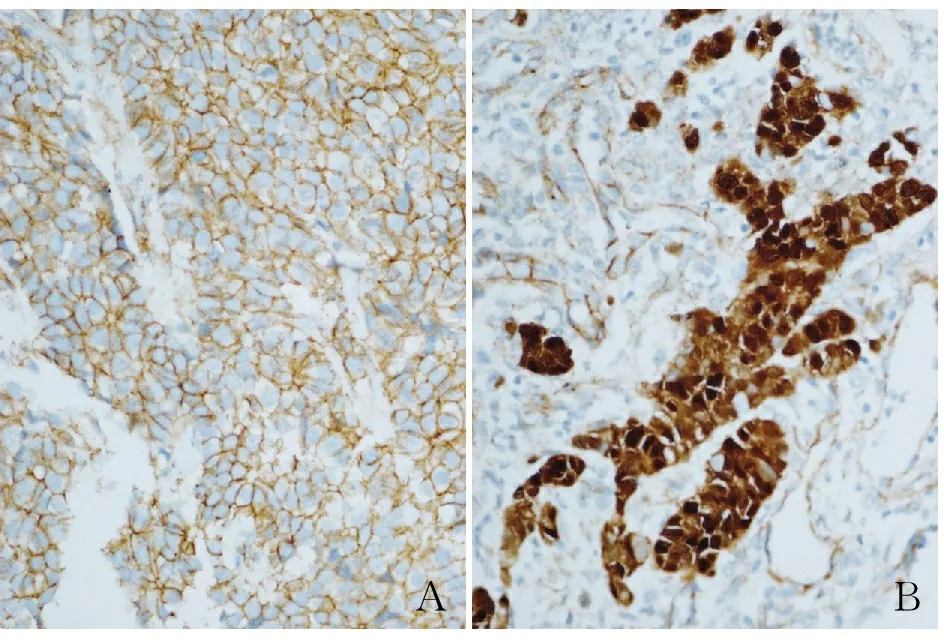
2.4 胃癌组织中FOXD3表达与β-catenin表达的相关性 β-catenin是Wnt信号通路的关键蛋白,可将信号从胞质传到细胞核,启动核内特定基因的表达。正常情况下,β-catenin蛋白主要存在于正常细胞胞膜,基因突变后导致细胞核内堆积。因此,β-catenin在核内表达才确认为阳性(图3A、B)。
AB
图3 β-catenin在胃癌组织中的表达:A.β-catenin低表达;B.β-catenin高表达,EnVision法
据上述以FOXD3表达量的中位数(0.18)将78例胃癌患者分为高表达量组(41/78)和低表达量组(37/78)。在检测β-catenin蛋白表达的基础上,通过Spearsman等级相关法分析,结果显示:FOXD3表达与β-catenin表达呈正相关(r=0.280,P=0.023,表2)。

表2 胃癌组织中FOXD3表达与β-catenin表达的相关性
3 讨论
FOX蛋白家族是一类广泛存在于动植物细胞中的转录因子,其在细胞凋亡的调节和细胞周期的调控、胚胎发育、免疫调节等方面发挥重要作用[10]。FOXD3是FOX转录因子家族的重要成员之一。FOXD3有维持脊椎动物胚胎发育和胚胎干细胞多能性,调控神经嵴细胞系的形成、迁移和分化的功能,且在决定正常或恶性胚胎干细胞继续增殖还是分化的过程中起关键作用[3,11]。据报道,FOXD3与其他转录因子相互作用,在肿瘤的发生、发展中起重要的调节作用[12]。
本实验通过qRT-PCR法检测胃癌组织及相应癌旁组织中FOXD3的表达,结果显示胃癌组织中FOXD3的表达量显著高于癌旁组织,处于高表达状态。王旭等[13]利用qRT-PCR和免疫组化法分析子宫颈癌组织及癌旁组织中FOXD3的表达[13],结果显示,FOXD3 mRNA及蛋白的表达水平均高于正常子宫颈组织。臧星卉等[14]在上皮性卵巢癌组织中的研究结果显示FOXD3表达水平高于卵巢良性上皮性肿瘤组织和正常的卵巢,进一步研究表明,FOXD3可能参与上皮性卵巢癌的发生、发展。以上结果显示,FOXD3在癌组织中呈高表达,与本组实验结果一致。Chu等[6]在乳腺癌的研究中发现,相对癌旁组织,乳腺癌组织中FOXD3呈低表达,FOXD3低表达与不良预后密切相关,进一步分析发现,FOXD3高表达抑制肿瘤的侵袭转移。以上结果表明,FOXD3在不同类型的组织样本中存在异质性,其功能也不尽相同。
本组实验进一步分析了FOXD3的表达量与胃癌不同临床病理特征的关系及患者术后OS的相关性,发现FOXD3表达与胃癌分化和Lauren分型密切相关,且胃癌组织中FOXD3高表达组OS较低表达组差(P<0.05)。在乳腺癌、直肠癌、肺癌、甲状腺癌及恶性黑色素瘤等肿瘤中均发现FOXD3异常表达与肿瘤临床特征及预后密切相关。Bao等通过qRT-PCR分析131例肺癌血清中FOXD3的表达,发现FOXD3异常表达与TNM分期、淋巴结转移和分化密切相关。ROC曲线表明,FOXD3可作为非小细胞肺癌患者的诊断生物学标志物[7]。印永祥等[15]在乳腺癌中研究显示,FOXD3表达与淋巴结转移密切相关,与其他类型乳腺癌相比,三阴型乳腺癌中FOXD3表达明显增加。Li等[16]在分析胃癌TCGA数据结果表明,FOXD3的低表达和高表达的5年OS和无瘤生存率(disease free survival, DFS)分别为43.1%、55.9%和37.2%以及46.7%,高水平的FOXD3表达与不良的OS和DFS预后相关。以上结果均表明,FOXD3在肿瘤发生、发展中起重要作用,可能是独立的预后指标。
为了进一步探讨FOXD3在胃癌中的作用,通过免疫表型分析FOXD3表达与Wnt/β-catenin信号相关蛋白的相关性,结果显示:FOXD3表达与β-catenin表达呈显著正相关。正常情况下,β-catenin蛋白主要存在于正常细胞的胞膜,基因突变后导致细胞核内堆积。β-catenin是Wnt信号通路的关键蛋白,可将信号从胞质传到细胞核,启动核内特定基因的表达。以上结果提示,FOXD3异常表达与Wnt/β-catenin信号通路密切相关。Wnt/β-catenin信号通路是一类在生物体进化过程中重要的信号转导通路,调控细胞的增殖、分化、极化、凋亡与抗凋亡等过程,该信号通路的异常与包括癌症在内的多种疾病相关[17-18]。胃癌的发生、发展也与Wnt/β-catenin信号的活化存在密切的联系。其参与胃癌细胞的周期调控,促进细胞的增殖、侵袭、转移等[19]。据报道FOXD3可通过调节Wnt/β-catenin信号通路促进小鼠外胚层干细胞的自我更新[20]。FOXD3/microRNA-496可调节Wnt信号通路影响人骨髓间充质干细胞的成骨作用[21]。这些研究提示FOXD3可能与调节Wnt/β-catenin通路的功能有关,本组实验结果显示,FOXD3与β-catenin的表达呈正相关,但FOXD3是否通过Wnt/β-catenin促进胃癌的发生、发展,仍需进一步深入探讨。
综上所述,本组实验结果显示,FOXD3在胃癌的发生、发展过程中发挥重要作用,并且与肿瘤组织分化、Lauren分型及预后密切相关。FOXD3可能是判断胃癌预后的分子标志物。FOXD3可能通过Wnt/β-catenin信号促进胃癌的发生、发展,还有待于深入探讨。

