脑钠肽在糖尿病肾病蛋白尿不同阶段的变化
高 琳,黎 娟,吴孟水,谭 静
脑钠肽(brain natriuretic peptide,BNP)是一种心脏神经内分泌激素,由左心室肌细胞合成和分泌,具有促进排钠、排尿,舒张血管功能,且能抑制血管平滑肌细胞增生,有抗心肌重塑作用。目前临床上常用于慢性心功能不全的筛查,及评估心梗后的左心收缩功能[1]。糖尿病造成的肾脏损害是肾衰竭的常见原因,是糖尿病防治领域的重点。但糖尿病肾病通常在Ⅳ期患者中才会检测出尿素氮和肌酐的升高,蛋白尿临床最早发现通常也在Ⅲ期,用这些指标评估肾脏功能均偏晚,且蛋白尿和血肌酐还受饮食、运动等因素影响。目前有较多的研究表明BNP不仅在心衰的患者中升高,在肾功能受损的患者中也有明显升高,甚至在早期糖尿病肾病患者中有所升高[2]。BNP能否成为一个筛查早期糖尿肾病及预测治疗效果的敏感指标需进一步验证。
1 对象与方法
1.1 对象 选取2016年1月—2018年6月武警安徽总队医院内分泌科收治的糖尿病住院患者214例,其中男112例,女102例。患者符合以下条件:①糖尿病的诊断符合1999年WHO提出的糖尿病诊断标准[3]。②排除合并慢性心功能不全、近1个月内发生过急性冠状动脉综合征的患者,且患者无糖尿病酮症酸中毒、高渗性昏迷等急性并发症,无尿路感染及血尿。③近期未服用肾素-血管紧张素转换酶抑制药及其受体阻断药和利尿药。④本研究经我院伦理委员会审批,所有患者签署知情同意书。将214例患者留取晨尿,测定尿白蛋白/肌酐比值(albumin/creatinine ratio,ACR)值,根据ACR值进行分组,其中正常白蛋白尿组(ACR≤3.0 mg/mmol)92例;微量白蛋白尿组(3.0 mg/mmol<ACR<35 mg/mmol)74例;临床白蛋白尿组(ACR≥35 mg/mmol)48例。给微量白蛋白尿组和临床白蛋白尿组(共122例)患者进行治疗。
1.2 治疗方案 降糖:微量白蛋白尿组采用胰岛素、口服降糖药,或两者合用。临床白蛋白尿组主要以胰岛素控制血糖。降压(高血压者):优先选择肾素-血管紧张素转换酶抑制剂药及其受体阻断剂药、钙离子拮抗剂药。抗氧化:硫辛酸等。改善微循环:前列地尔等。减少尿蛋白:肾素-血管紧张素转换酶抑制剂药及其受体阻断剂药。中成药护肾等治疗2周后,复查ACR、BNP、空腹血糖(fasting blood glucose,FPG)、肌酐(creatinine,Cr)。
1.3 检测方法 BNP测定:清晨空腹卧位采血2 ml,离心取血清,采用LTRIC-600型时间分辨荧光免疫分析仪(光景生物科技有限公司,中国),原厂提供的试剂盒,检测15 min。ACR测定:留取患者清晨起床后,进早餐前未做其他运动时排泄的尿标本10 ml,采用Afinion检测仪(Axis-Shield公司,挪威)即时检测,试剂为原厂提供。糖化血红蛋白(hemoglobin A1c,HbA1c)测定:采用DCAVantage检测仪(西门子公司,日本),放射免疫分析法。FPG、Cr采用生化仪检测(罗氏公司,瑞士)。
1.4 统计学处理 应用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示。3组间比较在满足正态分布情况下采用单因素方差分析,2组间比较用LSD检验;用非参数检验非正态分布数据,2组间比较用M-W检验。以P<0.05为差异有统计学意义。
2 结果
结果显示,临床白蛋白尿组的BNP和Cr显著高于微量白蛋白尿组和正常白蛋白尿组;微量白蛋白尿组BNP与正常白蛋白尿组比较也升高;而临床白蛋白尿组的FPG和HbA1c与微量白蛋白尿组和正常白蛋白尿组比较下降(表1)。微量白蛋白尿和临床白蛋白尿的122例患者治疗2周后复查,BNP也有明显降低(表2)。

表1 3组糖尿病患者的一般资料及ACR、生化指标、BNP比较
3 讨论
预测糖尿病肾病临床常用的检测方法是肾小球滤过率、尿白蛋白排泄率、ACR。肾活检作为金标准,因其有创性和可接受性差,更多的用于与其他肾病的鉴别诊断。而肾小球滤过率、尿白蛋白排泄率、ACR因受到其敏感性和特异性的限制也不能很好的预测早期糖尿病肾病。目前一些学者关注血浆或尿液中的生物标志物如足细胞标记蛋白,Wilms,Tumor-1,胱抑素C,尿微小RNA等预测早期糖尿病肾病,尚处于研究阶段[4]。有学者通过计算机构建多种风险模型预测早期糖尿病肾病,也未得到广泛认可推广[5]。糖尿病肾病是糖尿病常见且严重的慢性并发症,是终末期肾病的主要原因之一。糖尿病肾病患者心血管疾病风险明显升高[6]。如何早期预测糖尿病肾病风险并及早给予干预具有重要意义。目前一些研究已证实糖尿病患者的血浆BNP水平与肾脏损害风险呈独立的正相关关系[7]。血浆BNP水平与糖尿病肾病的疾病进展及死亡相关,对疾病预后有一定的预测作用[8]。
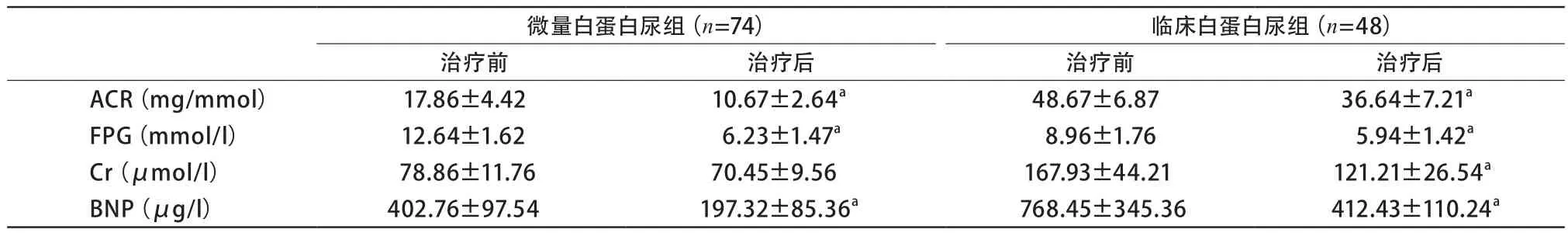
表2 微量白蛋白尿组和临床白蛋白尿的患者治疗前后的比较
BNP临床上多用于心力衰竭的诊断检测指标,其固有的病理生理作用如促进排钠、排尿,舒张血管、抑制血管平滑肌细胞增生等在肾脏等疾病的诊断和治疗中也有着一定的应用前景。本次研究用ACR值对糖尿病肾病患者进行分组,研究其与BNP的关系。ACR留取晨尿操作简单方便,且与24 h尿微量白蛋白符合度高。自2002年起,ACR已被美国肾脏病基金会推荐使用替代24 h尿液收集,来估算尿微量白蛋白排泄量,评价肾脏损害的程度。本研究发现随着糖尿病患者尿蛋白量的增多,BNP升高,与Seki等[8]研究结果一致。
王青等[9]也发现糖尿病伴肾衰患者BNP明显高于糖尿病肾功能正常者。Peng等[10]证实糖尿病合并蛋白尿者比非蛋白尿者的BNP水平更高。这些研究均排除了对BNP有影响的心功能不全患者,本研究与这些研究相符。糖尿病肾病肾脏功能受损引起BNP升高,分析可能的机制:①报道正常蛋白尿和微量白蛋白尿的糖尿病患者,其血管容量扩张无显著差异。BNP升高可能与肾小管中尿钠肽受体(NPR-A)下调有关。而BNP生理活性主要是通过和NPR-A受体联结的鸟苷酸环化酶介导起作用的。因BNP生理活性下降,心室肌需分泌更多BNP满足机体需要。②肾脏分泌一种中性内肽酶,帮助BNP的降解。肾损伤患者,中性内肽酶分泌下降且活性降低,BNP的降解随之下降。③BNP与心钠素均为利尿钠肽素,有相似的分子结构,且都与同一受体结合,具有相似的生物学效应。有报道,糖尿病的血管病变造成了一定的血管结构改变,使血管舒张压对心钠素的反应降低,对BNP的反应也降低,也造成了BNP的生理活性下降,使得心室肌需分泌更多BNP。而升高的BNP水平也会对糖尿病患者的肾功能产生影响。有报道糖尿病患者输注利钠肽可引起蛋白尿,拮抗利钠肽受体可防止肾损伤,推测升高的BNP可诱导肾小球超滤过而损伤肾功能加速糖尿病肾病的进展,尤其在微量白蛋白尿期[11]。因为BNP与心钠素一样,对肾入球小动脉有舒张作用,而对出球小动脉起收缩作用,共同导致肾小球内压升高,产生肾小球超滤过,使得尿蛋白排泄进一步增加[12]。以上可见检测血BNP水平可能是评估糖尿病肾脏并发症的重要辅助工具。
也有较多的研究发现糖尿病组BNP水平显著高于非糖尿病组,也观察了BNP在慢性心衰合并糖尿病患者中的应用价值,发现糖尿病患者在心衰评分相近的情况下较非糖尿病者BNP水平明显更高,故作者认为在评价心衰时应考虑糖尿病和血糖值[10]。本研究糖尿病肾病患者治疗前后随血糖水平的改善BNP改善也支持上述观点。糖尿病患者的BNP水平升高,潜在的机制不清楚。可能涉及BNP形成的增加和降解的减少。推测高血糖所致的高渗状态,导致细胞脱水和血容量增加,这些变化都可能增加心室的张力,从而提高BNP的水平[13]。此外,糖尿病患者多伴随冠状动脉病变引起的心肌缺血、缺氧、坏死、纤维化也可增加心室壁张力,促进BNP的分泌[14]。本次研究未设非糖尿病对照组,此点有待进一步研究。本研究也发现,有临床蛋白尿的患者空腹血糖和糖化血红蛋白水平与其他2组比较没有上升,分析可能糖尿病肾病偏晚期的患者会更加频繁的就医而更加重视自身血糖的监测和控制。而且这部分患者很多因肾功能的损害已由口服药控制血糖改为胰岛素降糖,使血糖有了更好地改善。
一项日本的研究显示,BNP较基线水平降低,在糖尿病肾病患者可能提示蛋白尿的缓解,是糖尿病肾病缓解的预测因子[15]。本次研究证实,蛋白尿升高的糖尿病患者治疗后随尿蛋白不同程度的缓解与BNP下降是同步的,支持上述观点。故BNP不仅是预测早期糖尿病肾病的一个标志,还能否成为预测糖尿病肾病治疗效果的敏感指标需进一步验证。

