干旱及复水对野生苦瓜幼苗生长和生理特性的影响
者国雄 王愣 杨朴丽 龙继明 杨焱 张祖兵
摘 要: 为了研究干旱及复水处理对野生苦瓜幼苗生长和生理特性的影响,探讨野生苦瓜的抗旱机制,为其栽培育种提供理论依据。以野生苦瓜‘JH01为试验材料,对干旱胁迫4、8、12、16 d和复水处理2、5 d野生苦瓜幼苗部分生理指标的变化进行研究。结果显示,随着干旱胁迫时间的延长,植株长势变弱,叶片萎蔫程度加重,叶片相对电导率、丙二醛含量、超氧阴离子含量、过氧化氢含量和脯氨酸含量逐渐上升,叶绿素含量呈先升高后降低的变化趋势;复水后,各指标得到了不同程度的恢复,复水5 d时叶绿素含量、相对电导率、过氧化氢含量均恢复到接近对照水平;此外,脯氨酸的可塑性指数达0.98,明显大于其他生理指标,叶绿素含量的可塑性指数最小为0.29。综上表明,野生苦瓜幼苗具有一定的耐旱能力,复水对干旱胁迫具有缓解作用。
关键词: 野生苦瓜; 干旱; 复水; 幼苗生长; 生理特性
中图分类号:S642.5 文献标志码:A 文章编号:1673-2871(2020)04-038-05
Abstract: The research aimed at the effects of drought stress and rewatering on the growth and physiological properties of wild bitter gourd seedlings, discussing the drought resistance mechanism of wild bitter gourd and providing the theoretical basis for its cultivation and breeding. Wild bitter gourd ‘JH01was selected as experimental material in order to study the growth and physiological response of seedlings subjected to 4,8,12,16 days drought stress and subsequent 2 d,5 d rewatering treatments. The results showed that with the extension of drought stress time, the plant grew weaker and the degree of leaf wilting increased, and the relative conductivity, the contents of malondialdehyde, superoxide radicals, hydrogen peroxide and proline increased, while the level of chlorophyll increased firstly and then decreased. After rewatering treatments,most parameters recovered in certain degree. The content of chlorophyll, relative conductivity and hydrogen peroxide all recovered approximately to the control level at 5 d after rewatering. In addition, the plasticity index of proline was 0.98, which was significantly higher than other physiological indexes, and the plasticity index of chlorophyll content was 0.29 at the minimum. It was concluded that the wild bitter gourd seeding had certain drought tolerance and rewatering could release the drought stress.
Key words: Wild bitter gourd; Drought stress; Rewatering; Seedling growth; Physiological property
苦瓜(Momordica charantia Linnaeus)又名凉瓜,属葫芦科(Cucurbitaceae)苦瓜属(Momordica)一年生蔓性攀缘草本植物,原产于东印度或南亚热带地区[1-2]。有报道显示,葫芦科苦瓜属植物约有40种,我国有5种,分布于全国各省[3]。苦瓜不仅是夏季佳蔬,又是一味良药,其果实富含苦瓜皂苷、苦瓜黄酮、苦瓜素、苦瓜凝集素、苦瓜甙等多种生物活性成分,具有降血糖、抗病毒、抗氧化、减肥瘦身等功效[4-7],近几年,随着苦瓜在抗肿瘤、艾滋病治疗等方面的药理作用逐步被揭示[8],苦瓜作为对人体无副作用的天然药食同源蔬菜,成为药物提取及加工的重要原材料,种植面积不断攀升,然而栽培种苦瓜的抗性有限,受环境因素制约严重,影响产业发展。大量研究表明,野生种质遗传基础广泛、蕴藏丰富的优异基因,是苦瓜的重要抗性资源[9-10]。因此,对该类资源需进行充分调查研究,才能使其在抗病和抗逆育种中得到更有效的利用。目前国内外学者对野生苦瓜的抗癌活性成分[11]、抗肿瘤[12]、表型性状评价和种质遗传多样性[13-16]、染色体数目与核型分析[1]、生物学特性和光合特性[10]、栽培管理技术[9,17]等方面進行了研究,但对野生苦瓜抗逆性方面的研究还鲜见报道。笔者通过盆栽试验研究不同干旱处理条件下对野生苦瓜幼苗长势和生理特性的影响,探索野生苦瓜的抗旱机制,以期为野生苦瓜栽培管理、抗逆性筛选、抗旱品种的选育提供理论参考。
1 材料与方法
1.1 材料
供试材料野生苦瓜‘JH01的种子于2018年7月采自云南省西双版纳,海拔为580 m,地理位置为北纬22°01′,东经100°46′,年均气温22.5 ℃,年均降雨量1 200 mm,土壤为酸性红土,pH 4.8。野生苦瓜‘JH01比市售苦瓜小,呈长卵形,表面有疣状突起及软刺,未成熟果皮为浓绿色,成熟果皮为橙黄色,熟透后果皮自然炸裂露出种子,种子由红色种衣包裹。
1.2 试验设计
试验于2018年8月在云南省热带作物科学研究所育苗大棚内开展,棚内平均温度为20~28 ℃,相对湿度为60%~70%。从苗床上选取生长良好、大小一致的苦瓜幼苗移栽至口径规格为14 cm×10 cm塑料花盆中,每盆1株苗,每处理5株苗,3次重复,随机排列,浇足水,待4叶1心时选取生长一致的幼苗进行干旱胁迫处理。持续干旱16 d后复水,分别在持续干旱4 d(D4)、8 d(D8)、12 d(D12)、16 d(D16)和复水2 d(R2)、5 d(R5)时观察盆栽野生苦瓜幼苗植株长势情况并采集成熟叶片进行相关生理指标测定。以正常浇水为对照(CK),每处理5株苗,3次重复。
1.3 测定指标与方法
1.3.1 植株生长形态观测 采用田间实物现场观察的方法,对不同干旱及复水处理下的盆栽野生苦瓜植株的生长表现(生长旺盛或受抑制)、叶片状况(色泽变化,萎蔫状况)等进行描述记录。
1.3.2 生理指标测定 叶绿素(Chl)含量测定采用浸提法,相对电导率(REC)测定采用电导仪法,丙二醛(MDA)含量采用硫代巴比妥酸法测定,游离脯氨酸(Pro)含量采用磺基水杨酸提取茚三酮显色法测定[19];超氧阴离子自由基(O2-·)和过氧化氢(H2O2)含量采用苏州科铭生物技术有限公司生产的试剂盒测定(货号分别为:SA-2-G和H2O2-2-Y)。
叶样研磨使用北京旭鑫盛科仪器设备公司生产的ST-M 200组织研磨仪,生理指标的测定用上海元析UV-5500 H型分光光度仪进行测定。
此外,可塑性指数(plasticity index,PI)=(不同处理下某参数的最大值-最小值)/最大值[20]。
1.4 数据分析
试验数据采用SPSS 23.0软件进行差异显著性分析,用Excel 2010软件对数据进行制图。
2 结果与分析
2.1 干旱和复水对野生苦瓜幼苗生长的影响
从表1中可看出,干旱胁迫处理严重抑制了野生苦瓜植株正常生长,导致植株长势变弱,新稍新叶抽发速度下降。野生苦瓜在干旱胁迫后的第8天植株下部叶片呈现边缘变黄并下垂,随着胁迫时间的延长,植株中部、上部叶片也出现下垂,并逐渐加剧;在干旱后第12 天,植株生长受到严重抑制,整株叶片呈现下垂,下部叶片变黄萎蔫;在干旱后第16天,植物停止生长,茎秆倒伏,上部叶片萎蔫,中下部叶片枯萎部分脱落,下部茎秆发干。在复水2d后,叶片萎蔫程度减弱,中上部叶片不再下垂,色泽正常;复水5d后,植株生长势基本恢复,顶梢开始抽发。
2.2 干旱和复水对野生苦瓜幼苗叶绿素含量的影响
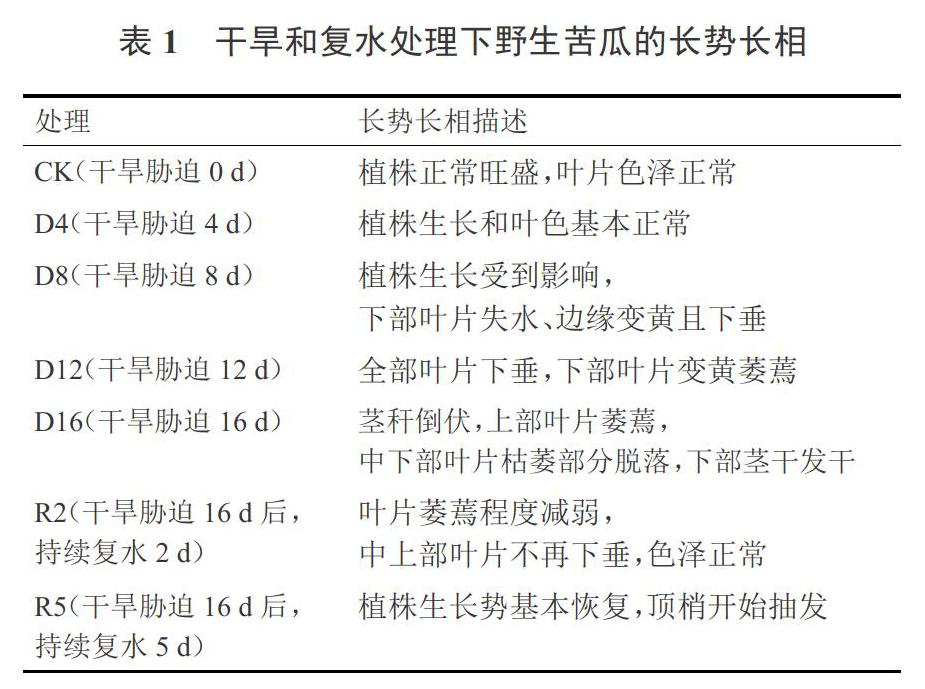
由图1可知,野生苦瓜幼苗叶绿素a(Chla)与总叶绿素(Chl(a+b))含量的变化趋势基本一致,随着干旱程度的加剧均呈上升—下降趋势,随着复水时间的延长,Chla、Chlb含量均呈上升趋势,且在不同水分处理下的差异达到显著水平。其中,Chla含量在D16时降至最低,复水后逐渐升高,而Chlb含量在受到干旱胁迫12 d时达到最大值,比CK显著增加了51.4%, 在持续干旱16 d后进行复水(R2、R5),其Chla和Chl(a+b)迅速回升,Chl(a+b)较复水前分别增长了21.5%和41.5%,复水5 d(R5)处理的Chla、Chlb和Chl(a+b)含量显著高于对照水平。
2.3 干旱和复水对野生苦瓜幼苗相对电导率的影响
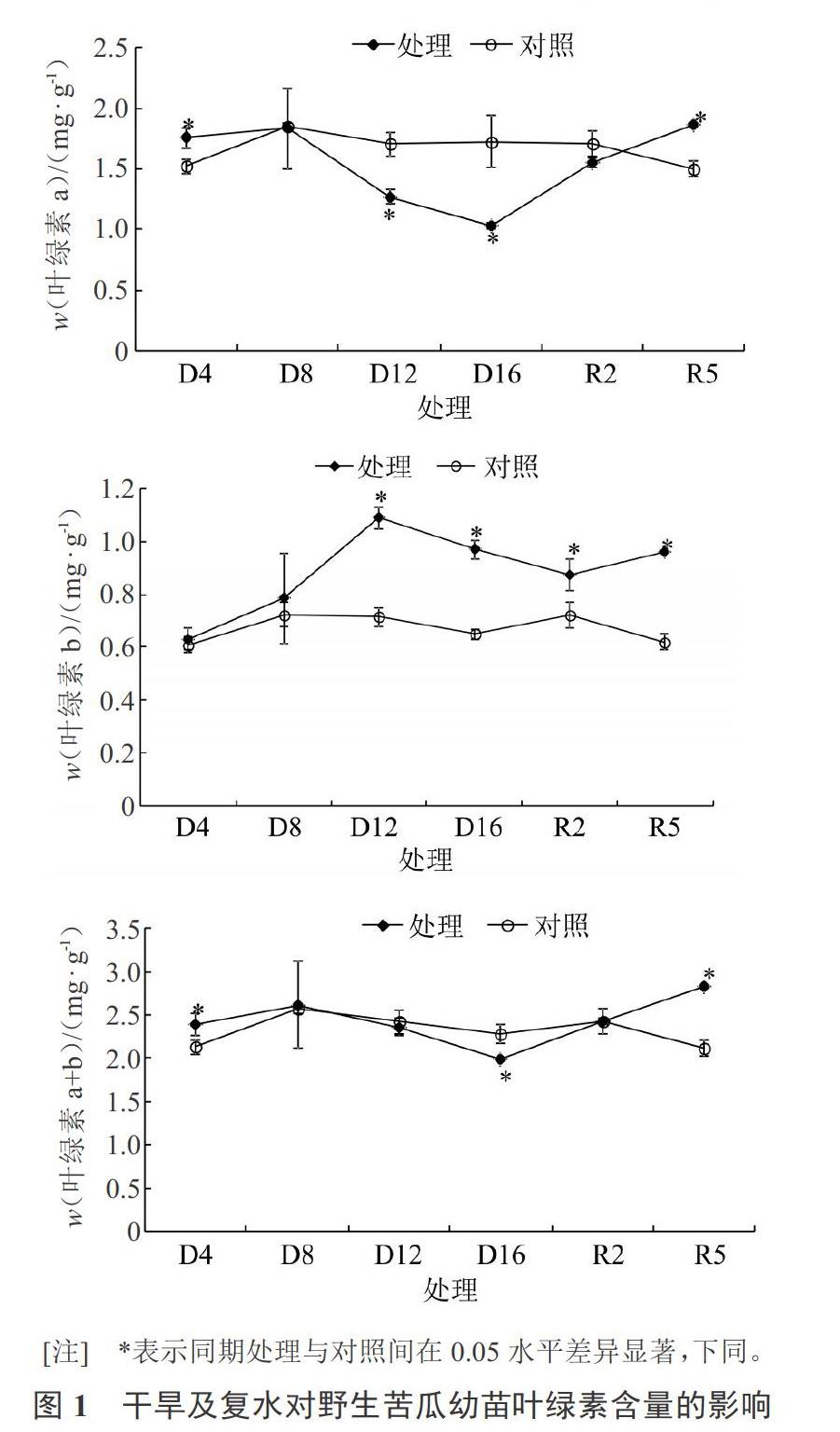
REC是衡量细胞质膜是否受到伤害的指标之一,通常情况下,当细胞膜遭受某种伤害时,电解质则大量涌向细胞外,导致REC激增。由图2可以看出,干旱4 d(D4)处理的REC略低于对照但差异不显著,随着干旱处理时间的延长,REC呈上升趋势,干旱处理与对照间差异不显著,在干旱16 d时REC达最大,比对照显著增加了1.3倍,连续干旱16 d后进行复水,REC迅速下降,R2的REC比的D16显著下降了48%,随着复水次数的增加,REC逐渐降低,R2的REC含量接近对照水平,R5的REC低于R2和对照,R2、R5与对照间没有显著差异。
2.4 干旱和复水对野生苦瓜幼苗丙二醛含量的影响
MDA是脂膜过氧化物作用的最终产物,MDA的积累可能会对膜和细胞造成一定的伤害。由图3可以看出,不同干旱胁迫及复水处理后,叶片内MDA含量发生了不同的变化。在D4处理时,MDA含量与对照相比虽有所下降,但差异不明显,野生苦瓜叶片MDA含量在D8处理时开始较对照组显著增加,随干旱胁迫时间的延长,丙二醛含量呈上升趋势,D8、D12、D16分别较对照增加了26.58%、36.02%和59.53%,在D16处理时达最大值。复水2 d,叶片中MDA含量降至2.95 μmol·g-1,相比对照下降5.7%,复水5 d后叶片的MDA含量显著高于对照,MDA含量在复水期间呈先降后升趋势。
2.5 干旱和复水对野生苦瓜幼苗超氧阴离子含量的影响
由图4可知,在干旱及复水处理下野生苦瓜叶片O2-·含量呈单峰曲线变化趋势。在轻度干旱D4处理下,O2-·含量较对照显著下降了21.05%;随干旱胁迫程度加剧O2-·含量持续增加,在胁迫8~12 d内O2-·含量保持在一个稳定水平且显著高于对照;在胁迫16 d,O2-·含量最大为405.78 nmol·g-1,是CK的2.04倍;復水期间,R2处理时O2-·含量急剧下降,且略低于对照,差异不明显,R5处理时下降幅度虽小,O2-·含量虽降至较低水平却与对照间不存在显著差异,降幅为18.61%。这与REC的变化趋势相似。
2.6 干旱和复水对野生苦瓜幼苗H2O2含量的影响
如图5所示,野生苦瓜的H2O2含量随胁迫时间的延长呈缓慢递增趋势。干旱胁迫12 d前,H2O2含量上升幅度不大,与对照没有显著差异,且D4和D8处理的H2O2低于对照;而在干旱胁迫12 d时,H2O2含量显著高于对照,在D16处理条件下,H2O2含量达最大,比对照显著增加23.31%。野生苦瓜叶片H2O2含量在复水后呈先降后升,与MDA、Chlb复水处理后的变化趋势相似;R2和R5处理下H2O2含量与对照间差异显著,其中R2大幅度下降,与D16相比降幅为50.16%,比对照显著下降了31.93%,在复水5 d时其H2O2含量有所上升,比对照显著增加了18.60%。
2.7 干旱和复水对野生苦瓜幼苗脯氨酸含量的影响
在正常环境条件下,植物体内的Pro含量相对较低,但受到逆境胁迫后会急剧增加从而缓解膜质过氧化对细胞膜造成的伤害。由图6可知,不同干旱和复水处理下,Pro含量变化幅度不同,且达显著水平。在干旱胁迫处理D4、D8和D12条件下野生苦瓜叶片中的Pro含量均显著低于对照,其降幅分别为71.81%、35.89%和13.86%;随着干旱时间的持续,Pro在植物体内大幅度积累,D16时其含量显著高于对照并达最大值,比对照增加了7.32倍;复水2 d(R2)后叶片Pro含量较复水前显著下降,Pro含量略低于对照水平,差异不显著,且随着复水时间的延长,R5的Pro含量显著上升高于对照。
2.8 干旱胁迫对野生苦瓜生理参数可塑性指数的影响
由表2可知,测定的生理指标可塑性指数由大到小的顺序为Pro> O2-·>REC> H2O2>MDA> Chla> Chlb> Chl(a+b),Pro的可塑性指数(PI)值最大为0.98,Chl(a+b)总含量的PI最小为0.29。所有生理指标的可塑性指数的均值为0.56,Pro、O2-·和REC明显大于均值,说明它们能较其他指标更好反映野生苦瓜对干旱胁迫的响应。
3 讨论与结论
植物抗旱性强弱体现在干旱胁迫下的植株生长状态和复水后的恢复能力。干旱胁迫会诱导O2-·和H2O2的产生,启动膜质过氧化反应,造成膜脂过氧化产物(MDA)的积累,此时植物体内积累大量Pro等渗透调节物质来缓解膜质过氧化对细胞膜造成的伤害[20-21]。笔者发现,在持续干旱16 d后,野生苦瓜叶片呈现出植株倒伏,叶片萎蔫严重,中下部叶片枯萎,部分脱落,复水5d后,植株生长势基本恢复。试验结果表明,随干旱处理时间的延长,野生苦瓜叶片叶绿素含量呈先升后降的趋势,与王宁等[19]对节节麦的研究一致。从这些结果可推断出干旱使土壤含水量大幅下降,叶片失水,严重制约野生苦瓜叶绿素的合成并导致叶绿素分解,复水后又迅速恢复,表明叶绿素的合成未受到根本性破坏,野生苦瓜可通过自身调节恢复。
植物在干旱胁迫下细胞膜质过氧化产生O2-·和H2O2,而REC和MDA是评价膜质过氧化的重要参数[22-23]。在本研究中,随着干旱处理时间的增加,野生苦瓜叶片中REC、MDA、O2-·和H2O2含量一直呈逐渐上升趋势,这与节节麦[19]、雅安紫云菜[22]和白三叶[24]等的研究结果一致。在胁迫8~12 d内O2-·与MDA含量均保持在一个稳定水平且显著高于对照,在干旱胁迫12 d前,H2O2含量上升幅度不大,与对照没有显著差异,在D16处理时,电導率、MDA、O2-·和H2O2含量皆达最大值,表明此时野生苦瓜的细胞膜损害程度严重。复水后各指标又大幅度下降,R2与R5的REC呈下降趋势,这与O2-·的变化趋势相似,R5时REC和O2-·略低于对照水平且差异不显著,复水期间,随复水时间的延长,MDA与H2O2含量变化总体趋势相似,呈明显先降后升现象,由此可见,通过自身的调节机制,野生苦瓜对干旱胁迫造成的膜系统损伤进行了积极地修复。这也可能是野生苦瓜对干旱胁迫的重要适应机制。
Pro作为渗透调节物质对维持膜的完整性及提高植株的抗逆性具有重要意义[25],Pro可以维持细胞的渗透压来抵抗干旱胁迫带来的伤害[26]。在本研究中,干旱胁迫造成Pro含量持续增加,在处理12 d后大幅增加,D16处理时达最高值,比对照增加了7.32倍,由此表明野生苦瓜幼苗通过Pro含量的增加来降低细胞渗透势,保障其体内正常的代谢活动,从而抵御干旱胁迫,复水2 d后Pro含量较复水前显著下降,略低于对照,但差异不显著,随着复水时间的延长,R5的Pro含量显著上升,这可能是干旱胁迫致使野生苦瓜渗透调节能力增强所致。
综上所述,野生苦瓜在干旱胁迫下,膜质过氧化产物和渗透调节物质均随胁迫程度加强而增加,其中Pro增幅较大;经复水处理后,野生苦瓜幼苗的植株长势、Chl含量、REC、MDA、O2-·、H2O2和Pro含量均得到了一定程度的恢复。在干旱胁迫16 d时植株茎秆倒伏,中下部叶片枯萎部分脱落呈现极度萎蔫,但是复水2 d后中上部叶片不再下垂,生长势得以恢复,复水5 d后顶梢开始抽发,恢复正常生长能力。因此野生苦瓜具有一定的耐旱能力及复水后迅速恢复生长的能力。
参考文献
[1] 庄东红,宋娟娟,叶君营,等.一种野生苦瓜的部分形态特征、营养成分和染色体核型[J].热带作物学报,2005,26(3):39-42.
[2] 杨衍,刘昭华,詹园凤,等.苦瓜种质资源遗传多样性的AFLP分析[J].热带作物学报,2009,30(3):299-303.
[3] 中国科学院植物研究所.中国高等值物种属检索表[M].北京:科学出版社,1979:425.
[4] 向长萍,吴昌银,汪李平.苦瓜营养成分分析及利用评价[J].华中农业大学学报,2000,19(4):388-390.
[5] 杜小凤,吴传万,王连臻,等.苦瓜营养成分分析及采收期对苦瓜营养品质的影响[J].中国农学通报,2014,30(1):226-231.
[6] 白娟,祝莹,董英.苦瓜粉缓解大鼠肥胖相关炎症的作用途径[J].中国食品学报,2018,18(8):16-23.
[7] ALI L,KHAN A A,MAMUN M F,et al.Studies on hypoglycemic effects of fruit pulp,seed,and whole plant of Momordica charantia on normal and diabetic model rats[J].Planta Medica,1993,59(5):408-412.
[8] 万新建,李作善,缪南生,等.苦瓜种质资源的研究与利用[J].现代园艺,2009(8):29-31.
[9] 高安辉,王彬,熊正飞,等.苦瓜栽培种和野生种的繁殖比较试验及野生苦瓜繁殖技术研究[J].现代园艺,2017(3):19-20.
[10] 罗海玲,蒋义平,黄玉辉,等.野生苦瓜与栽培苦瓜的生物学性状和光合特性比较[J].南方农业学报,2012,43(12):2009-2014.
[11] 李祖强,罗蕾,凌敏.山苦瓜的抗癌活性成分[J].中草药,1999,30(6):409-411.
[12] 徐国辉.山苦瓜抗肿瘤的药理研究[J].云南医药,1983(3):177-180.
[13] 张楠.四份野生瓜种质资源研究[D].哈尔滨:东北农业大学,2012.
[14] 吴水金,李海明,黄惠明,等.不同山苦瓜资源田间性状和品质分析[J].中国蔬菜,2018(3):59-62.
[15] 龙卫平,李育军,卢文佳,等.国外引进野生苦瓜资源的性状调查研究[J].长江蔬菜,2009(14):29-30.
[16] 张长远,何晓莉,吴海滨,等.野生苦瓜主要经济性状杂交分离分析[J].热带作物学报,2014,35(7):1278-1281.
[17] 赖正锋,张少平,李跃森,等.山苦瓜栽培技术[J].现代农业科技,2013(1):93-93.
[18] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[19] 王宁,袁美丽,陈浩,等.干旱胁迫及复水对入侵植物节节麦幼苗生长及生理特性的影响[J].草业学报,2019,28(1):70-78.
[20] 黄承建,赵思毅,王龙昌,等.干旱胁迫对苎麻光合特性和产量的影响[J].中国麻业科学,2012,34(6):273-277.
[21] 郭鹏辉,高丹丹,刘慧霞,等.薰衣草种子萌发及幼苗生长对干旱胁迫的响应[J].安徽农业科学,2017,45(32):134-137.
[22] 王兆,胡祥东,魏可心,等.岩生植物雅安紫云菜对干旱及复水的生理响应[J].西北植物学报,2017,37(5):915-922.
[23] SHI H,WANG Y,CHENG Z,et al.Analysis of natural variation in bermudagrass (Cynodon dactylon) reveals physiological responses underlying drought tolerance[J].Plos One,2012,7(12):1-12.
[24] 李州,彭燕,蘇星源.不同叶型白三叶抗氧化保护及渗透调节生理对干旱胁迫的响应[J].草业学报,2013,22(2):257-263.
[25] 马正华,王柳英,宋维秀.西北黄芪和山野豌豆对低温胁迫的生理响应研究[J].广西植物,2009,29(4):533-536.
[26] 阮志平.东澳棕叶片和根系对干旱和复水的生理响应[J].西北林学院学报,2016,31(5):90-95.

