干扰PTX3表达对甲状腺癌细胞TPC-1增殖、侵袭及TLR4/NF-κB通路蛋白表达的影响
程 远,向 森,路慧彬
1)驻马店市中心医院内分泌科 河南驻马店 463000 2)驻马店市中心医院肿瘤一科 河南驻马店 463000 3)郑州大学第一附属医院介入科 郑州 450052
甲状腺癌发病率与地区、种族、性别有一定关系;女性发病较多,男女发病比例为1∶(2~4);任何年龄均可发病,但以青壮年多见[1-2]。Pentraxin 3(PTX3)是一种进化保守的模式识别分子,是先天免疫的重要组成部分[3],其表达受多种信号通路的调控,如NF-κB、JNK和PI3K/Akt信号通路[4]。PTX3参与癌症的发生和发展,已被视为一种反映癌症进展的标志[5-6]。然而,目前对PTX3在甲状腺癌中的作用尚未形成定论。TLR4/NF-κB信号通路是主要的炎症途径之一。Toll样受体(TLR)是一类天然免疫受体,其适度表达维持了机体的防御功能,在抵抗和清除病原微生物、维持机体免疫系统的稳定状态方面具有重要意义[7-8]。TLR4的激活可诱导促炎因子的生成,从而引发自身免疫性疾病或炎症性疾病[9]。NF-κB能够调节自身免疫性疾病、慢性炎症和多种恶性肿瘤的疾病过程[10-11]。本探究利用si-PTX3干扰甲状腺癌细胞TPC-1中PTX3的表达,观察TPC-1细胞增殖、侵袭能力,以及炎症因子IL-6、NO和TNF-α水平的变化,探讨PTX3与甲状腺癌的关系,为甲状腺癌的诊断和治疗提供新思路。
1 对象与方法
1.1甲状腺癌组织中PTX3表达的检测
1.1.1 标本来源 收集2015年6月至2018年12月我院收治的甲状腺乳头状腺癌患者32例,留取患者肿瘤组织标本及距离肿瘤组织3~6 cm的癌旁正常组织(均经病理证实)。
1.1.2 组织中PTX3 mRNA的检测 采用实时荧光定量PCR检测组织中PTX3 mRNA表达水平。RNA提取试剂盒、反转录试剂盒、PCR试剂盒购自北京全式金生物技术有限公司,引物由北京擎科生物技术有限公司合成。PTX3正向引物序列 5’-CAT TCTCACTCGACACACGAT-3’,反向5’-GCCGAG GCGTTGACCTAGAGC-3’。内参GAPDH正向引物序列5’-GGAGCGAGATCCCTCCAAAAT-3’,反向5’-GGCTGTTGTCATACTTCTCATGG-3’。细胞裂解液购自陕西科源生物科技有限公司。将待测组织研磨成粉末状,加入裂解液混合均匀,30 min后离心取上清;提取总RNA,经反转录得cDNA;以cDNA为模板,进行荧光定量PCR。反应条件为:95 ℃ 10 min;95 ℃ 20 s,60 ℃ 1 min,35个循环。采用2-ΔΔCt法计算PTX3 mRNA表达水平。
1.1.3 组织中PTX3蛋白的检测 采用Western blot法检测组织中PTX3蛋白的表达。PTX3一抗、内参GAPDH一抗、HRP标记的二抗均购自北京索莱宝生物科技有限公司。将待测组织研磨成粉末状,加入裂解液混合均匀,30 min后离心提取总蛋白,4 ℃12 000×g离心15 min,收集上清,BCA法测定蛋白浓度。取50 μg蛋白上样进行SDS-PAGE,电转移至PVDF膜上,加50 g/L脱脂奶粉封闭液3 mL室温条件下于摇床上封闭1 h,TBST溶液清洗膜10 min×3次;加入一抗(1∶500)4 ℃孵育过夜,回收一抗;TBST洗膜10 min×3次;加入HRP标记的二抗(1∶2 000)室温孵育1 h;TBST洗膜10 min×3次。最后,取适量发光液(A和B液等体积混匀)孵育膜3 min,于凝胶成像系统中曝光,用Quantity-One软件分析蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参GAPDH条带灰度值。
1.2TPC-1细胞来源及分组甲状腺癌细胞TPC-1来源于中国科学院细胞库;DMEM培养基和胎牛血清购自北京索莱宝生物科技有限公司。将TPC-1细胞用含有体积分数10%胎牛血清的DMEM细胞培养液,于37 ℃、体积分数5% CO2培养箱中培养,当达到60%~70%融合时用2.5 g/L胰酶消化处理,以1∶3的比例进行传代。将TPC-1细胞以1×105个/孔的密度接种于6孔培养板,细胞约铺满培养板70%时,用无血清培养基培养24 h。然后分3组处理,si-PTX3组和si-NC组脂质体法转染si-PTX3或对照si-NC(北京擎科生物科技有限公司),空白对照组不转染。脂质体来源于北京索莱宝生物科技有限公司。37 ℃培养4~6 h后,将无血清培养基更换为完全培养基继续培养24 h。利用实时荧光定量PCR和Western blot法检测3组细胞中PTX3 mRNA和蛋白表达水平(方法同前),以判定si-PTX3的干扰效率。
1.33组TPC-1细胞凋亡的检测收集3组细胞,离心并重悬于结合缓冲液中,加入5 μL的Annexin V-FITC轻轻吹打混匀,再加入5 μL的PI轻轻吹打混匀,室温下暗中温育5~15 min,然后使用FACSCalibur流式细胞仪进行分析。实验重复3次。Annexin V-FITC/PI试剂盒购自北京索莱宝生物科技有限公司。
1.43组TPC-1细胞增殖的检测将3组细胞以1×105个/孔的密度接种在96孔板中,于37 ℃、体积分数5% CO2培养箱中培养24 h;BRDU法检测细胞增殖,按试剂说明操作。试剂来源于北京索莱宝生物科技有限公司。细胞增殖率=(1-实验组细胞数/空白对照组细胞数)×100%。
1.53组TPC-1细胞侵袭能力的检测将3组细胞以1×105个/孔接种于6孔板中,于37 ℃、体积分数5% CO2培养箱中培养24 h;消化、离心,用无血清培养基稀释成2×104个/mL的细胞悬液。按照200 μL/孔将细胞悬液加入Transwell小室上室,同时在下室加入10%TBS和500 μL培养基,于37 ℃、体积分数5% CO2培养箱中培养。24 h后取出小室,吸去上室中的液体,用PBS清洗3次,用棉棒在上室中轻轻转动,吸干水分并擦去膜内侧的细胞;在上室中加入结晶紫染液,5 min后回收染液,用流水缓缓冲洗,再次用棉棒吸干水分;于正置显微镜下拍照;在100倍视野下计数3个视野的侵袭细胞数。细胞侵袭率=(1-实验组细胞数/空白对照组细胞数)×100%。
1.63组细胞中Caspase-3、MMP-1、磷酸化TLR4(p-TLR4)、p-P65和 NF-κB 蛋白的检测收集3组细胞,采用Western blot法检测凋亡相关蛋白Caspase-3,侵袭相关蛋白MMP-1,以及TLR4/NF-κB信号通路蛋白p-TLR4、p-P65和NF-κB的表达情况,以GAPDH为内参,具体操作同前。抗体均购自北京索莱宝生物科技有限公司。Caspase-3、p-TLR4、p-P65一抗稀释度为1∶1 000,MMP-1和NF-κB一抗稀释度为1∶800。
1.73组细胞中IL-6、NO和TNF-α水平的检测收集3组细胞,按照ELISA试剂盒(北京索莱宝生物科技有限公司)指导说明操作,检测细胞中IL-6、NO和TNF-α水平。
1.8统计学处理采用SPSS 20.0对数据进行分析。甲状腺癌和癌旁正常组织中PTX3 mRNA和蛋白表达水平的比较采用配对t检验;2组细胞增殖率、侵袭率的比较采用两独立样本t检验;3组细胞凋亡率,Caspase-3、MMP-1、p-TLR4、p-P65和NF-κB蛋白表达水平及细胞中IL-6、NO和TNF-α水平的比较采用单因素方差分析,组间比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1甲状腺癌组织中PTX3的表达甲状腺癌组织中PTX3 mRNA和蛋白的表达水平均高于癌旁正常组织,见表1。
2.23组TPC-1细胞中PTX3mRNA和蛋白表达水平的比较见表2。si-PTX3组细胞中PTX3 mRNA和蛋白表达水平低于空白对照组和si-NC组,提示si-PTX3可成功干扰TPC-1细胞中PTX3的表达。

表1 甲状腺癌和癌旁正常组织中PTX3 mRNA和蛋白表达水平的比较
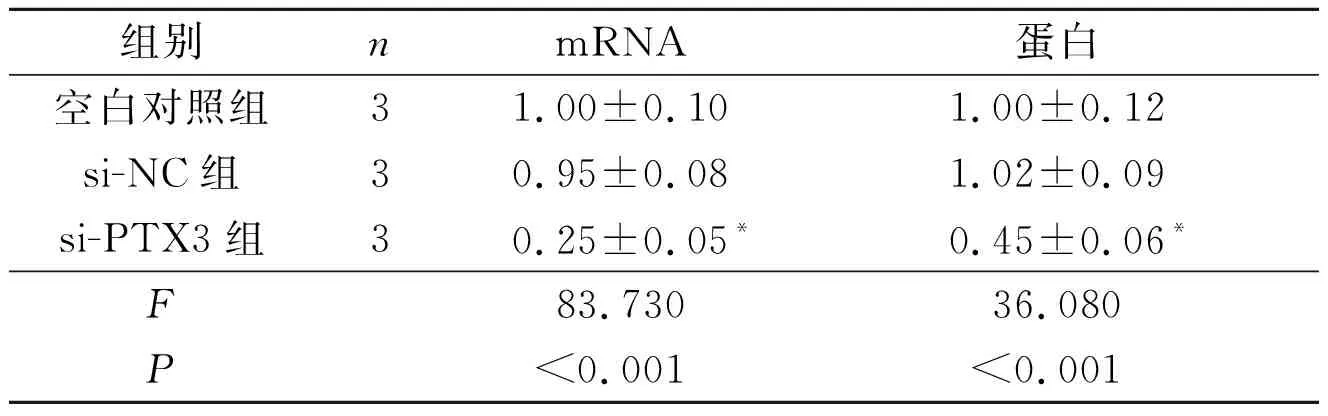
表2 3组TPC-1细胞中PTX3 mRNA和蛋白表达水平的比较
*:与空白对照组和si-NC组比较,P<0.05
2.33组TPC-1细胞增殖、凋亡和侵袭能力的比较见图1、表3和图2、表4。与空白对照组或si-NC组相比,si-PTX3组细胞增殖率和侵袭率降低,凋亡率升高(P<0.05);细胞凋亡蛋白Caspase-3表达升高,而侵袭相关蛋白MMP-1表达降低(P<0.05)。

图1 3组TPC-1细胞BRDU染色(上)和侵袭实验(下)结果
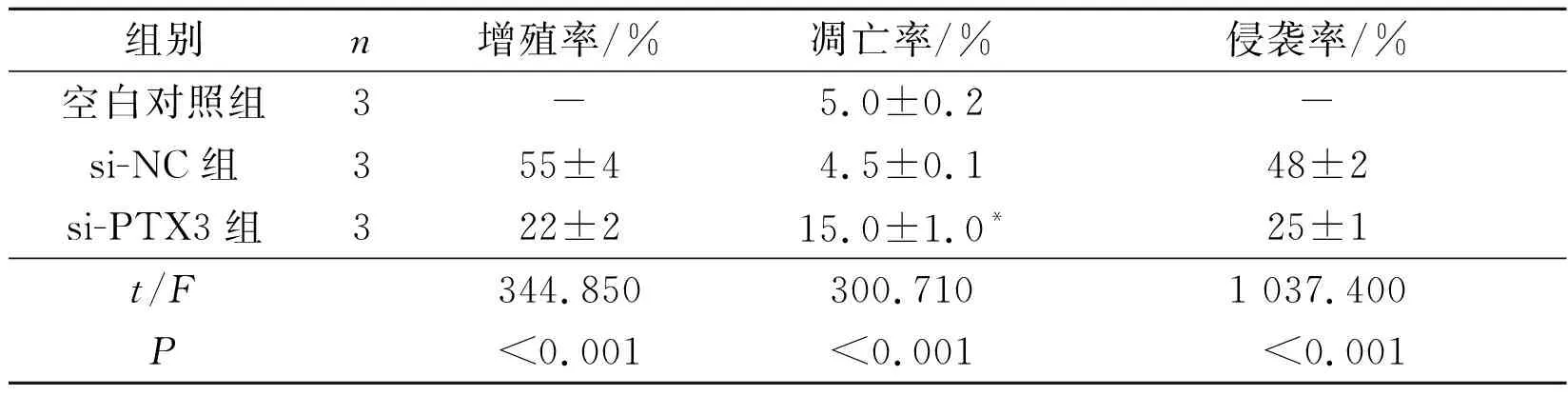
组别n增殖率/%凋亡率/%侵袭率/%空白对照组3-5.0±0.2-si-NC组355±44.5±0.148±2si-PTX3组322±215.0±1.0*25±1t/F344.850300.7101 037.400P<0.001<0.001<0.001
*:与空白对照组和si-NC组比较,P<0.05

图2 3组TPC-1细胞中Caspase-3和MMP-1蛋白的表达

组别nCaspase-3 MMP-1空白对照组30.58±0.060.55±0.05si-NC组30.62±0.070.59±0.06si-PTX3组31.98±0.15*0.21±0.05*F184.41045.630P<0.001<0.001
*:与空白对照组和si-NC组比较,P<0.05
2.43组TPC-1细胞中TLR4/NF-κB信号通路蛋白表达的比较见图3和表5。si-PTX3组细胞中p-TLR4和p-P65表达水平低于空白对照组和si-NC组;3组NF-κB蛋白表达差异无统计学意义。
2.53组TPC-1细胞中促炎细胞因子水平的比较si-PTX3组细胞中IL-6、NO和TNF-α水平较空白对照组和si-NC组降低,见表6。

图3 3组TPC-1细胞中TLR4/NF-κB信号通路蛋白的表达

表5 3组TPC-1细胞中TLR4/NF-κB信号通路蛋白表达的比较
*:与空白对照组和si-NC组比较,P<0.05

表6 3组TPC-1细胞中促炎细胞因子水平的比较
*:与空白对照组和si-RNA组比较,P<0.05
3 讨论
甲状腺癌约占全身恶性肿瘤的1%;除髓样癌外,绝大部分甲状腺癌起源于滤泡上皮细胞[12]。研究[5-6,13-15]发现,PTX3参与癌症的发生和发展过程,其在肺癌、胰腺癌、胶质瘤和乳腺癌等多种肿瘤组织中表达均显著增加,与肿瘤的分化程度相关。PTX3也是炎症反应的效应因子,在炎症条件下可以激活效应器,是先天免疫的重要组成[7]。因此,PTX3可能是肿瘤相关炎症和恶性肿瘤的标志物[16]。TLR4是一种天然免疫受体。近年来,TLR4/NF-κB信号通路在肿瘤炎症反应中的作用逐渐引起人们的重视。Tang等[17]报道,沉默PCSK9可以抑制TLR4/NF-κB信号通路,进而抑制炎症因子的水平,从而抑制胃癌的进展。Yan等[18]报道,miR-223可以抑制TLR4/NF-κB信号通路,进而抑制肺癌细胞的增殖活性和迁移能力,抑制肺癌的进一步恶化。
本研究发现,甲状腺癌组织中PTX3 mRNA和蛋白表达水平均高于癌旁正常组织。干扰PTX3可抑制甲状腺癌细胞TPC-1的增殖活性和侵袭能力,促进细胞凋亡。进一步的研究结果表明si-PTX3可显著抑制TPC-1细胞中TLR4/NF-κB信号通路蛋白的表达及炎症因子水平。以上结果表明PTX3可能通过激活TLR4/NF-κB信号通路,诱导炎症反应;促进甲状腺癌细胞TPC-1的增殖活性和侵袭能力,抑制其凋亡。
综上所述,本研究证明PTX3可能通过激活TLR4/NF-κB信号通路,促进甲状腺癌细胞TPC-1的增殖和侵袭,PTX3有可能成为状腺癌治疗的新靶点。

