纤维素酶和果胶酶提取对甘草渣多糖抗氧化和抗肿瘤性能的影响
(湖北中医药大学药学院,湖北武汉 430065)
甘草是一种常见的可药食同源的草本生植物,因其具有补脾益气、调和诸药、清热解毒等功效[1],而在医药、食品、烟草等领域具有广泛应用。甘草的主要成分有三萜皂苷类、黄酮类、多糖类等[2],其中三萜皂苷类的甘草酸和黄酮类的甘草苷通常被认为是甘草的主要生物活性成分,因此,已有大量关于其提取工艺、生物活性等相关报道[3-5]。目前,在甘草的加工应用过程中,通常是提取其中的主要有效成分使用,提取后的副产物甘草渣当作残渣或是丢弃或是用作饲料,这样不仅污染环境,也造成了甘草资源浪费。虽然,已有众多研究学者日渐关注甘草渣的再利用[6-7],但是对于甘草渣中有效成分提取再利用关注较多的当属黄酮类,对多糖的研究甚少。
植物多糖是由多个单糖以糖苷键相连而成的高分子化合物[8],它作为一种天然的生物分子,具有良好的生物相容性、生物降解性和低细胞毒性。现代药理研究表明,植物多糖还具有多重药理活性[9],如调节免疫、抗氧化、抗肿瘤、降血脂、抗菌等,因此已在医药、食品、轻工业等领域有广阔应用。目前,植物多糖的提取方法众多[10],因此,不同提取方法对植物多糖的提取率和生物活性等影响引起了众多研究学者的关注。例如,He等[11]比较了水热提取法、冷压萃取法、冻融冷压萃取法、超声-水热提取法、微波-水热提取法和酶解-水热提取法对铁皮石斛茎中多糖理化性能的影响。Shang等[12]考察了水热提取法、超声提取法、酶提取法和酶解-超声提取法对紫云英多糖的理化性能和生物活性的影响。华思敏等[13]采用水、纤维素酶及碱液提取黑木耳多糖,比较了不同工艺提取得到的黑木耳多糖的抗氧化性与糖苷酶抑制作用。Hu等[14]比较了水热提取法和超声提取法得到的乌拉草多糖的结构和体外抗氧化活性。近年来,酶提法作为一种高效、绿色的提取方法越来越受到关注[15]。它是以酶为催化剂通过破坏植物细胞壁从而释放细胞内的有效成分,并且利用酶的特异性和选择性可以在温和条件下反应进而有效保持生物活性物质的生物潜力。然而,鲜见不同酶提取对植物多糖的生物活性等的影响研究。
基于此,本文以甘草渣为研究对象,采用纤维素酶和果胶酶在实验优化条件下分别提取甘草渣多糖,研究不同酶提取对甘草渣多糖的抗氧化性和抗肿瘤性能的影响,以期为后续甘草资源的有效再利用提供依据。
1 材料与方法
1.1 材料与仪器
甘草渣 随州神农百草药业有限公司;葡萄糖标准品、果胶酶(30000 U/g)、纤维素酶(10000 U/g)、水杨酸(分析纯)、2,2-二(4-叔辛基苯基)-1-苦肼基自由基(DPPH)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,98%) 阿拉丁试剂公司;无水乙醇、苯酚、柠檬酸、柠檬酸钠、二水合磷酸二氢钾、十二水合磷酸氢二钾、硫酸亚铁(FeSO4)、30%双氧水(H2O2)、二甲亚砜(DMSO) 分析纯,国药集团化学试剂有限公司;浓硫酸 分析纯,成都市科龙化工试剂厂;DMEM培养基、胎牛血清(FBS) Hyclone;PBS缓冲液 Life;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT) Sigma;肝癌细胞HepG2 武汉普健生物有限公司。
DF-101S型集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;WGL-125B型电热鼓风干燥箱 天津市泰斯特仪器有限公司;JJ124BC型电子天平 常熟市双杰测试仪器厂;SC-04型低速离心机 安徽中科中佳科学仪器有限公司;MX-S型试管振荡器 北京大龙公司;UV-2600型紫外分光光度仪 岛津企企业管理有限公司;TENSOR II型傅里叶变换红外光谱仪 德国BRUKER公司;Envision型全功能微孔板检测仪 PerkinElmer公司;HF90 CO2培养箱、HF-1200LC型生物安全柜 Heal force。
1.2 实验方法
1.2.1 甘草渣中粗多糖的提取
1.2.1.1 纤维素酶提取甘草渣中粗多糖 精密称取干燥至恒重的甘草渣粉末2.0 g,按料液比1∶20加入pH5.5的柠檬酸-柠檬酸钠缓冲液,加入2%的纤维素酶,在55 ℃下水浴加热酶解2 h。再于100 ℃水浴中加热20 min灭酶活性,冷却后,转移至离心管中4000 r/min离心20 min,取上清液,水浴浓缩至体积1/5,然后加4倍量的无水乙醇,4 ℃静置过夜,得到粗多糖[16-17]。
1.2.1.2 果胶酶提取甘草渣中粗多糖 精密称取干燥至恒重的甘草渣粉末2.0 g,按料液比1∶20加入pH5的柠檬酸-柠檬酸钠缓冲液,加入2%的果胶酶,在50 ℃下水浴加热酶解2 h。再采用与1.2.1.1相同的步骤进行灭酶、醇沉等处理。
1.2.2 甘草渣多糖的纯化 采用Savege法[18]除蛋白。按照粗多糖溶液:Sevage试剂(氯仿∶正丁醇=4∶1)=5∶1 (v∶v)的比例,混合后于振荡器强烈振荡20 min,产生乳白色沉淀,4000 r/min离心15 min,收集上清液,如此重复至少三次,直到没有明显的蛋白层出现。
1.2.3 甘草渣多糖的紫外吸收光谱 采用紫外分光光度计测定甘草渣多糖在200~400 nm范围内的紫外可见吸收光谱[19]。
1.2.4 甘草渣多糖含量的测定 以葡萄糖为标准物,采用硫酸-苯酚法[20]绘制葡萄糖标准曲线。精密移取一系列浓度梯度的葡萄糖标准溶液0.2 mL,加入0.2 mL 5%的苯酚溶液摇匀,再加入1.0 mL浓硫酸充分振荡2 min后,置于95 ℃的沸水浴中加热15 min中后冷却,以等量蒸馏水替代葡萄糖标准品溶液作为空白,采用紫外-可见分光光度法测定最大吸收波长处的吸光度,以吸光度为纵坐标,葡萄糖浓度为横坐标,得到标准曲线。根据回归方程按下式测定甘草渣多糖的总含量。
其中,c为回归方程中得到的甘草渣多糖的质量浓度(mg/mL);V为定容体积(mL);N为稀释倍数;m为甘草药渣质量(g)。
1.2.5 甘草渣多糖的红外表征 将甘草渣多糖溶液滴涂在CsI窗片上,待溶剂挥干后采用傅里叶变换红外光谱仪测定4000~400 cm-1的光谱[21]。
1.2.6 甘草渣多糖抗氧化性能研究
1.2.6.1 DPPH自由基清除活性 DPPH自由基清除活性的测定参考李珊珊等[22]的方法稍作修改。取0.225 mg/mL的DPPH乙醇溶液0.5 mL,加入1.5 mL 0.000393、0.000783、0.00118、0.00157和0.00236 mg/mL的果胶酶提取甘草渣多糖溶液或1.5 mL 0.00298、0.00895、0.01491、0.04971、0.07457 mg/mL的纤维素酶提取甘草渣多糖溶液立即混匀后,在室温下避光30 min,测定517 nm处的吸光度A1;以等量乙醇替代DPPH溶液测定吸光度A2,以等量乙醇溶液替代多糖溶液测定吸光度A0。以等体积的0.000393、0.000783、0.00118、0.00157和0.00236 mg/mL维生素C反应液作为阳性对照,每次实验重复三次。DPPH自由基的清除率按下式计算:
1.2.6.2 羟基自由基清除活性 羟基自由基清除活性的测定参考Yin等[23]的方法稍作修改。0.45 mL 0.00380、0.0110、0.0200、0.0230和0.0300 mg/mL的甘草渣多糖溶液与0.6 mL 9 mmol/L的水杨酸乙醇溶液、0.6 mL 9 mmol/L的FeSO4水溶液和0.6 mL 9.8 mmol/L的H2O2混合后,在37 ℃下水浴30 min后,测定溶液在510 nm处的吸光度A1;以蒸馏水替代H2O2测定吸光度A2,以蒸馏水替代多糖溶液测定吸光度A0。以等体积的0.00380、0.0230、0.0300、0.0360和0.0450 g/mL维生素C反应液作为阳性对照,每次实验重复三次。羟基自由基的清除率按下式计算:
1.2.6.3 ABTS自由基清除活性 ABTS自由基清除活性的测定参考Hu等[14]的方法稍作修改。取5 mL 2.45 mmol/L的K2S2O8水溶液与5 mL 7 mmol/L的ABTS水溶液混合,在室温下于暗处避光放置12 h后,取1.2 mL用pH7.4的PBS缓冲溶液稀释至10 mL得到ABTS+溶液。取等体积的ABTS+溶液与0.00550、0.0110、0.0170、0.0220、0.0280、0.0340和0.0400 mg/mL的甘草渣多糖溶液混合,测定其在734 nm处的吸光度A1;以蒸馏水代替ABTS+溶液测定吸光度A2,以蒸馏水替代多糖溶液测定吸光度A0。以等体积的0.000840、0.00167、0.00335、0.00502、0.00669和0.00837 mg/mL维生素C反应液作为阳性对照,每次实验重复三次。ABTS自由基的清除率按下式计算:
1.2.7 甘草渣多糖的抗肿瘤研究 采用MTT法[24]测定甘草渣多糖的抗肿瘤性能。在96孔板上按照7000个/孔接种HepG2细胞,采用10% DMEM+10% FBS作为培养基在37 ℃下培养。待细胞贴壁后,每孔加入200 μL上述培养基或0.125、0.0833、0.0227、0.0119、0.00250 mg/mL多糖溶液。37 ℃培养24 h后,向每孔中加入20 μL PBS缓冲液配制的5 mg/mL的MTT 溶液。继续孵育4 h后,停止培养,小心吸弃孔内培养基上清液。对于悬浮细胞需要离心后再吸弃孔内培养基上清液。再向每孔中加入150 μL DMSO,振荡10 min溶解结晶。采用酶标仪在490 nm处测定OD值。根据下式计算细胞的抑制率:

1.3 数据处理
实验数据采用Origin 8.6进行绘图,SPSS 24.0进行统计分析,选取可信度为95%,计算IC50。
2 结果与分析
2.1 甘草渣多糖的紫外可见吸收光谱
两种酶提取得到的甘草渣多糖的紫外吸收光谱如图1所示,均在260和280 nm没有明显的吸收峰,由此可知甘草渣多糖中不含蛋白质和核酸[25]。
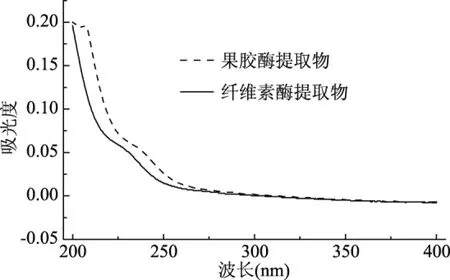
图1 甘草渣多糖的紫外吸收光谱Fig.1 UV spectra of licorice residue polysaccharide
2.2 甘草渣多糖的含量测定
采用硫酸-苯酚法测定了两种酶提取得到的甘草渣多糖的含量。以蒸馏水代替葡萄糖标准溶液为空白,测定葡萄糖标准溶液在200~800 nm内的紫外吸收光谱,得到最大吸收波长为490 nm。测定一系列浓度梯度的葡萄糖标准溶液在490 nm处的吸光度,绘制标准曲线如图2所示,得知葡萄糖标准溶液在0.005~0.030 mg/mL范围内,具有良好的线性关系,线性回归方程为A=31.427c+0.0276,R2=0.9998,式中,A为吸光度,c为葡萄糖标准溶液浓度。

图2 葡萄糖标准溶液的标准曲线Fig.2 Standard curve for glucose standard solution
根据葡萄糖标准曲线方程,可得纤维素酶提取甘草渣多糖的得率为10.71%,果胶酶提取甘草渣多糖的得率为8.43%,表明纤维素酶提取得到的多糖得率更高。这可能是由于纤维素酶对甘草细胞壁及细胞内部结构的降解和破坏作用更强,进而有利于释放细胞内的多糖[26]。
2.3 甘草渣多糖的红外表征
两种酶提取得到的甘草渣多糖的红外光谱如图3所示,两者较为相似,均表现出明显的多糖特性吸收峰。在3390 cm-1附近有-OH的伸缩振动峰,C-H在2935 cm-1附近的弯曲伸缩振动峰归因于-CH2。1720 cm-1附近的吸收峰对应C=O的吸收峰位,1600 cm-1附近的吸收峰说明C=O未酯化,这表明多糖中含有糖醛酸[27]。1406和1235 cm-1附近的吸收峰对应的C-O-H弯曲振动和C-O伸缩振动。此外,840 cm-1附近的吸收峰为α-糖苷键的特征吸收峰,610 cm-1附近的吸收峰对应吡喃糖骨架的伸缩振动吸收峰[28],这表明甘草渣多糖的糖环为α-吡喃环。

图3 甘草渣多糖的红外光谱Fig.3 IR spectra of licorice residue polysaccharide
2.4 甘草渣多糖的抗氧化性能研究
2.4.1 DPPH自由基的清除活性 由图4可知,果胶酶提取多糖和纤维素酶提取多糖分别在0.000393~0.00236和0.00298~0.07457 mg/mL浓度范围内对DPPH自由基的清除活性呈现剂量依赖关系。随着多糖浓度的增加,两种多糖对DPPH自由基的清除率随之增加。经拟合,果胶酶提取的多糖和纤维素酶提取的多糖对DPPH自由基的IC50值分别为0.00243和0.226 mg/mL,维生素C的IC50值为0.00220 mg/mL。说明在相同浓度的情况下,果胶酶提取的多糖对DPPH自由基的清除能力略低于维生素C,但明显地高于纤维素酶提取的多糖。

图4 甘草渣多糖的DPPH自由基清除能力Fig.4 Scavenging ability of licorice residuepolysaccharide on DPPH radicals
2.4.2 羟基自由基的清除活性 图5给出了以维生素C为对照,两种酶提取的甘草渣多糖对羟基自由基的清除活性。从图5中可以看出,在0.0038~0.0300 mg/mL浓度范围内,甘草渣多糖对羟基自由基的清除活性呈现剂量依赖关系。并且,随着多糖浓度的增加,纤维素酶提取的甘草渣多糖对羟基自由基的清除率远高于果胶酶提取的多糖。当浓度为0.03 mg/mL时,纤维素酶提取的多糖和果胶酶提取的多糖对羟基自由基的清除率分别为59.12%和23.31%,维生素C对羟基自由基的清除率为11.23%,纤维素酶提取的多糖和果胶酶提取的多糖对羟基自由基的清除率分别是维生素C对羟基自由基的清除率的5倍和2倍。经拟合,果胶酶提取的多糖和纤维素酶提取的多糖对羟基自由基的IC50值分别为0.305和0.0238 mg/mL,维生素C的IC50值为0.156 mg/mL。由此可见,纤维素酶提取的甘草渣多糖对羟基自由基有较强的清除能力。
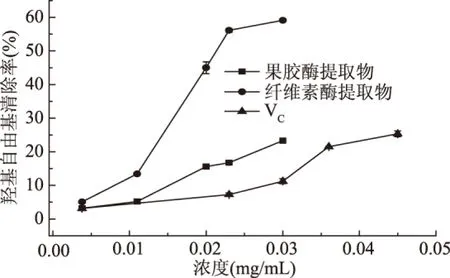
图5 甘草渣多糖的羟基自由基清除能力Fig.5 Scavenging ability of licorice residuepolysaccharide on hydroxyl radicals
2.4.3 ABTS自由基的清除活性 图6是以维生素C为对照,两种酶提取的甘草渣多糖对ABTS自由基的清除活性。从图6中可以看出,在0.0055~0.0400 mg/mL的浓度范围内,果胶酶提取的甘草渣多糖的总抗氧化能力明显强于纤维素酶提取的多糖;但随着浓度的增加,这种差异性减弱。经拟合,果胶酶提取的多糖和纤维素酶提取的多糖对ABTS自由基的IC50值分别为0.0403和0.0401 mg/mL,维生素C的IC50值为0.00310 mg/mL。表明果胶酶和纤维素酶提取的多糖的总抗氧化能力几乎相当,均明显低于维生素C。目前,已有文献报道多糖的化学成分、结构、分子质量和构象对多糖的生物活性和其它药用性能具有一定的影响[29]。因此,不同酶提取的甘草渣多糖对各种自由基的清除率不同,这很可能是与其组成中不同单糖的比例及其侧链连接有关[30]。
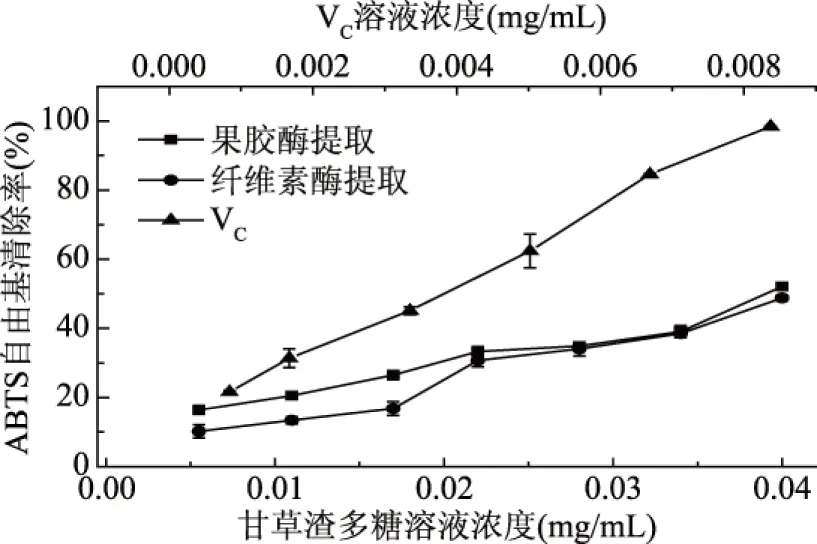
图6 甘草渣多糖的ABTS自由基清除能力Fig.6 Scavenging ability of licorice residuepolysaccharide on ABTS radicals
2.5 甘草渣多糖的抗肿瘤性能研究
选取肝癌细胞HepG2细胞作为研究对象,纤维素酶和果胶酶提取的甘草渣多糖的抗肿瘤性能如图7所示。从图7中可以看出,甘草渣多糖具有明显的抗肿瘤性能。此外,在相同的浓度下,纤维素酶提取的多糖比果胶酶提取的多糖抗肿瘤性能更优,且随着多糖的浓度降低更显著。例如,当浓度为0.125 mg/mL时,纤维素酶提取的多糖肿瘤抑制率为35.18%,此时果胶酶提取的多糖肿瘤抑制率为31.23%;当浓度为0.0025 mg/mL时,纤维素酶提取的多糖肿瘤抑制率为13.84%,为果胶酶提取的多糖肿瘤抑制率的3倍。
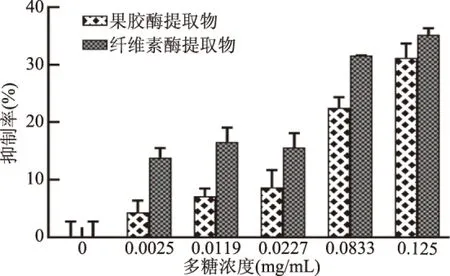
图7 甘草渣多糖的抗肿瘤特性Fig.7 Antitumor property of licorice residue polysaccharide
3 结论
果胶酶和纤维素酶提取的甘草渣多糖得率分别为8.43%和10.71%,表明纤维素提取多糖的得率更高。红外光谱结果表明两种酶提取的多糖的红外光谱没有明显差别,均具有α-吡喃环糖环。抗氧化性实验结果表明果胶酶和纤维素酶提取的多糖对DPPH自由基、羟基自由基和ABTS自由基的IC50分别为0.00243、0.305、0.0403 mg/mL和0.226、0.0238、0.0401 mg/mL,说明果胶酶提取的多糖对DPPH自由基有较好的清除能力,而纤维素酶提取的多糖对羟基自由基有更好的清除能力,两者对ABTS自由基的清除能力几乎相同。抗肿瘤结果表明在相同的浓度下,纤维素酶提取的多糖对HepG2肿瘤细胞的抑制率更高,说明纤维素酶提取的多糖抗肿瘤性能更优。本研究结果为甘草渣的提取再利用提供了指导意义,也为后期甘草资源的进一步有效利用奠定了基础。

