白苏叶乙醇提取物体外抗氧化活性评价及相关性分析
,*,2,*
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134; 2.天津天狮学院食品工程学院,天津 301700)
白苏(Perillafrutescens(L.)Britt)系唇形科紫苏属紫苏植物的近似种,全株密被白色柔毛,叶片背面呈白色[1-2]。白苏在我国各地均有种植,叶可直接食用或作为调味料用于肉类的增香,种子可用于榨取食用油。白苏具有抑菌、抗氧化、抗衰老等作用[1-2]。关于白苏化学成分的研究甚少,远远不及同样资源丰富的紫苏[3-5],且其研究主要集中在茎叶中所含的挥发油[6-11],对于白苏黄酮类物质的报道甚少。王静等[12]发现白苏叶黄酮类物质清除超氧阴离子自由基、过氧化氢及抑制猪油氧化的能力均略强于紫苏叶黄酮。本课题组此前的工作中,优化了黄酮类的微波辅助提取条件,从白苏叶的乙醇提取物(WPEE)中鉴定出了13种化合物,主要成分为迷迭香酸(74.94 μg/mg)、野黄芩苷(50.08 μg/mg)、柠檬酸(47.94 μg/mg)和芹菜素-6,8-二-C-葡萄糖苷(41.08 μg/mg)[13-14]。
抗氧化剂通常是具有还原性和自由基清除能力,可以减弱、抑制甚至消除氧化反应的一类物质[15]。随着人们对食品安全的要求日渐提高,相比人工合成抗氧化剂,人们更关注较为安全的天然抗氧化剂。而现阶段的研究表明,任何一种单一的评价方法均无法充分地评价样品的抗氧化活性[16-17]。而不同的抗氧化评价方法之间所得的结果是否具有相关性未见报道,因此使用不同的方法从不同的角度对样品的抗氧化活性和清除自由基的能力进行研究并解释不同评价方法的相关性是非常必要的。
本文采用六种方法即细胞内活性氧清除能力(CAA)、总抗氧化活性(TAA)、清除超氧阴离子自由基(SSAR)、清除羟自由基(SHR)、清除二苯基苦基苯肼自由基(SDR)能力以及抑制卵黄脂蛋白脂质过氧化(ILLP)能力来评价WPEE的抗氧化活性。探讨利用这六种方法评价抗氧化活性的可行性,以及这些方法与WPEE中活性成分含量的关系,借以揭示不同的抗氧化性评价方法之间的内在联系,为白苏资源作为天然抗氧化剂替代人工合成抗氧化剂方面提供理论依据。
1 材料与方法
1.1 材料与仪器
白苏叶 河北省安国市,粉碎、过筛(20目);RAW264.7巨噬细胞 美国模式培养物集库存;胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;无血清高糖培养基(dulbecco modified eagle medium,DMEM)及青霉素、链霉素抗体 美国Hyclone公司;甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT) 中国医学科学院血液研究所;活性氧检测试剂盒 江苏碧云天生物科技有限公司;二苯基苦基苯肼(DPPH) 美国Sigma公司;其余试剂 均为国产分析纯。
DS-5MC倒置显微镜 日本尼康公司;SpectraMax M5多功能读板机 美国分子器件公司;HERAcell 240i二氧化碳培养箱 美国热电公司;Lambda 25紫外-可见分光光度计 美国珀金埃尔默公司;H2050R-1医用离心机 湖南湘仪离心机仪器公司。
1.2 实验方法
1.2.1 白苏叶乙醇提取物(WPEE)的制备 按照文献[13-14]的方法,采用微波辅助提取法对白苏叶粉末进行提取(提取条件为:乙醇浓度63%、液料比41∶1 mL∶g、微波温度72 ℃、提取时间7 min以及微波功率500 W),并利用AB-8大孔树脂进行纯化,冷冻干燥后获得白苏叶醇提物粉末备用。使用甲醇配制4 mg/mL的白苏叶醇提物样品液,经制备色谱分离纯化初步得到2个组分(以下简称F1和F2),贮于阴凉干燥处备用。
1.2.2 细胞内活性氧清除能力(CAA)的测定 利用DMEM将WPEE、F1和F2分别配制成1.0 mg/mL的储备液,0.2 μm滤膜过滤除菌后,冰箱冷藏4 ℃储存备用。实验前利用DMEM将储备液适当稀释得到浓度为0.001、0.1和0.5 mg/mL的工作液。
首先,为选择细胞抗氧化活性测定时合适的WPEE的浓度,运用MTT比色法测定不同浓度下的细胞存活率[18]。将RAW264.7细胞置于DMEM培养基[含10% FBS、青霉素(100 U/mL)和链霉素(100 μg/mL)],37 ℃、5% CO2条件下培养至对数生长期。将对数生长期的RAW264.7细胞以1×105个/孔的密度接种于白色透明96孔板,37 ℃、5% CO2条件培养24 h后,吸除上述DMEM培养基并使用磷酸缓冲液(PBS,0.85% NaCl,2.68 mmol/L KCl,10 mmol/L Na2HPO4和1.76 mmol/L KH2PO4)冲洗3次。再向每孔中加入100 μL浓度为0.001、0.1和0.5 mg/mL的WPEE、F1或F2溶液,不同浓度的所有样品均设六个复孔,再培养24 h后,加入20 μL 5.0 mg/mL MTT再培养4 h,吸除液体后向每孔加入100 μL二甲基亚砜用以溶解蓝紫色甲瓒结晶,置于多功能读板机低速振荡以助溶解,并利用读板机读取570 nm处吸光度值ODx;空白组为每孔不接种细胞,以DMEM培养基替代样品,读取吸光度值记为OD0;而对照组为每孔接种细胞,同样以DMEM培养基替代样品,读取吸光度值记为ODc。细胞的存活率(%)由式(1)计算:
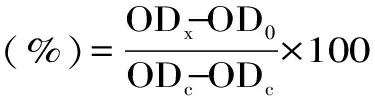
式(1)
然后,采用DCFH-DA探针法测定细胞内荧光强度。接种细胞于黑色96孔板(底部透明),培养24 h后吸除上述DMEM培养基并使用PBS冲洗3次。再向每孔加入100 μL 10 μmol/L DCFH-DA探针和100 μL 0.1 mg/mL WPEE(上述细胞存活率实验证明此浓度的黄酮对细胞存活率无影响),培养30 min后吸除液体,再使用PBS冲洗,最后加入100 μL 100 μmol/L H2O2,每隔5 min测定上述液体1 h内荧光强度的变化(激发波长和发射波长分别为488和525 nm)。空白组为加入探针但不加WPEE和H2O2的孔,对照组为加入探针和H2O2但不加入WPEE的孔。一方面,DCFH-DA探针可自由进出细胞,活细胞酯酶可分解DCFH-DA生成还原性的DCFH,产物DCFH无法穿透细胞膜,故滞留于细胞内;另一方面,细胞内的活性氧(ROS)可在H2O2的刺激下增多,H2O2亦可自发产生更多的ROS,ROS将还原性的DCFH氧化成荧光物质DCF,其荧光强度可间接反映细胞内ROS水平,并可间接评价样品的细胞内抗氧化能力[19-20]。故细胞内抗氧化活性的测定可通过测定DCF荧光强度实现,分别以时间和荧光强度为横、纵坐标绘制曲线,CAA可由式(2)计算:
式(2)

1.2.3 总抗氧化活性(TAA)的测定 参照文献[16,21-22]所使用的磷钼络合物法测定WPEE的TAA。首先将WPEE、F1、F2及VC溶液配制成浓度0.1~0.3 mg/mL的样品待测液,其次将0.4 mL的样品待测液与4.0 mL的磷钼试剂(钼酸铵、磷酸钠和硫酸终浓度分别为4.0、28.0和0.6 mmol/L)混匀于水浴95 ℃恒温反应90 min,测定695 nm处吸光度A695 nm。所有测定均平行重复3次,以下同(细胞抗氧化实验除外)。
1.2.4 清除超氧阴离子自由基(SSAR)能力的测定 参照文献[23-24]利用邻苯三酚自氧化动力学法测定WPEE的SSAR。首先进行全波长扫描确定邻苯三酚在碱性条件下(Tris-HCl缓冲液pH8.2,浓度0.05 mol/L)的最大吸收波长为320 nm。在相同碱性条件下,将浓度为0.1~0.3 mg/mL WPEE、F1和F2或VC的样品液各1.5 mL分别加入0.5 mL 3.0 mmol/L邻苯三酚溶液和2.5 mL蒸馏水(上述反应试剂均提前37 ℃恒温水浴20 min),每隔1 min测定320 nm处吸光度值A320 nm。以A320 nm为纵坐标,反应时间为横坐标作图,所得直线的斜率为添加样品后的邻苯三酚的自氧化速率Vs。而将样品液替换为蒸馏水进行上述操作,作图所得的斜率为邻苯三酚本身的自氧化速率V0。SSAR由式(3)计算:
式(3)
1.2.5 清除羟自由基(SHR)能力的测定 参照文献[25]利用水杨酸法测定WPEE的SHR。利用Fenton反应亚铁离子(Fe2+)与过氧化氢反应生成OH-自由基,而OH-自由基与水杨酸反应生成有色物质,在510 nm处有特征吸收,当加入OH-自由基清除剂时与水杨酸形成竞争关系,减少有色物质的生成量,从而降低吸光度值。取若干支比色管,首先加入1.0 mL 10 mmol/L硫酸亚铁溶液(由煮沸放冷的蒸馏水及稀硫酸配制)和2.0 mL 5 mmol/L水杨酸,再分别加入1 mL浓度为0.1~0.5 mg/mL的WPEE、F1、F2或VC的样品液,最后加入2.0 mL 0.03% H2O2混匀,置于恒温水浴37 ℃、30 min后测定A510 nm。其中,An为加入样品液时所得吸光度值,以蒸馏水替代样品液时为空白对照液吸光度值A0,不添加H2O2时样品溶液的本底吸光度值为A′n。SHR由式(4)计算:
式(4)
1.2.6 清除DPPH自由基(SDR)能力的测定 参照文献[26-27]测定WPEE的SDR。DPPH自由基被还原时,颜色会由紫色褪至淡黄色,故可通过测定加入抗氧化物质后517 nm处吸光度A517 nm的变化即可计算DPPH自由基的清除率。首先,配制浓度为0.02~0.10 mg/mL的WPEE、F1和F2以及VC样品溶液。取0.5 mL上述样品液与3.5 mL 1.0×10-4mol/L DPPH混匀避光反应30 min后测定吸光度值A517 nm;0.5 mL样品液与3.5 mL无水乙醇混匀后测定空白吸光度值为A0;0.5 mL无水乙醇与3.5 mL 1.0×10-4mol/L DPPH混匀后测定对照吸光度值为A1。SDR由式(5)计算:
式(5)
1.2.7 抑制卵黄脂蛋白脂质过氧化(ILLP)能力的测定 Fe2+能够诱发卵黄磷脂C-2位上的低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)以及多不饱和脂肪酸(PUFA或称为过不饱和脂肪酸)的过氧化,此模型可运用于WPEE抗氧化能力的测定。按照文献[28]方法并略作改进。首先取新鲜鸡蛋的卵黄与0.1 mol/L磷酸缓冲液(PBS,pH7.45)1∶1 (v∶v)磁力搅拌混匀,再使用该PBS稀释25倍,制得卵黄悬液冷藏4 ℃储存待用。取0.2 mL卵黄悬液,加入0.6 mL 0.1 mg/mL的WPEE、F1和F2或VC样品液,0.2 mL 25 mmol/L FeSO4溶液及1.0 mL PBS混匀,37 ℃培养12 h后加入0.5 mL 20%三氯乙酸,混匀静置10 min,离心10 min(3500 r/min)。分别吸取2.0 mL上清加入1.0 mL 0.8%硫代巴比妥酸(TBA)混匀,沸水浴15 min,冷却后于532 nm测定样品吸光度值Ab。以蒸馏水代替样品经上述操作,测定对照吸光度值A0。ILLP以抑制率表示:
式(6)
1.3 统计分析
所有实验测定均重复3次,测定结果以平均值±标准偏差(Mean±SD)表示。采用SPSS 16.0统计软件对不同方法测定的WPEE、F1、F2以及VC的抗氧化性及清除自由基的数据进行单因素方差统计分析,进一步使用SPSS对不同测定方法所得白苏叶黄酮抗氧化活性及清除自由基能力、白苏叶黄酮含量百分比进行皮尔森相关性分析。
2 结果与分析
2.1 WPEE、F1和F2对细胞内活性氧清除能力(CAA)的影响
2.1.1 WPEE浓度的选取 细胞内抗氧化活性测定时需在不影响细胞存活前提下进行,故需要选择合适的WPEE浓度。故测定不同浓度的WPEE、F1和F2对RAW264.7细胞存活率的影响,实验结果如图1所示。MTT可与活细胞的琥珀酸脱氢酶反应生成蓝色的甲瓒结晶,于可见光处有吸收;相反,死细胞不具有此种还原酶无法将MTT还原[29]。活细胞数量与甲瓒结晶生成量成正比,故测定吸光度值的高低可以间接反映活细胞的数量。图1显示当WPEE、F1和F2浓度低于0.5 mg/mL时,对RAW264.7细胞存活率均无影响;当样品液浓度为0.001时对细胞内自由基的清除率较低或效果不明显,而当样品液浓度较高时,WPEE相对浪费,故测定CAA时,WPEE、F1和F2浓度均选取中间浓度0.1 mg/mL。
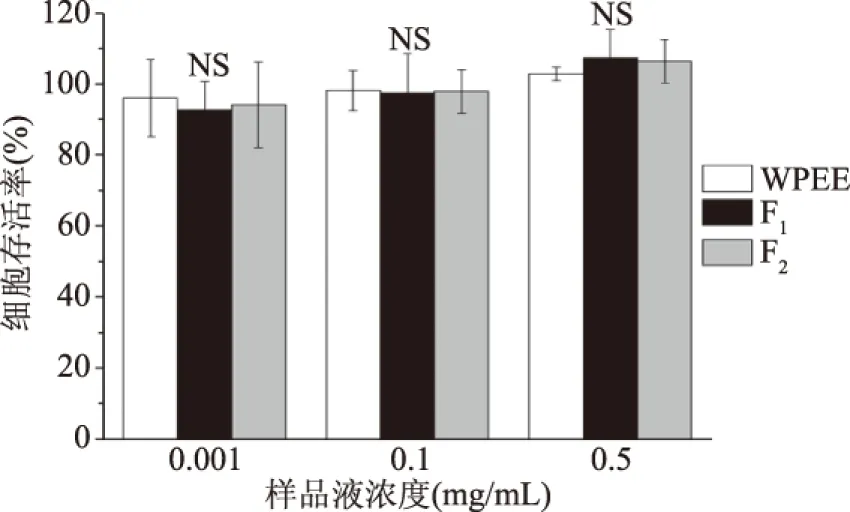
图1 WPEE、F1和F2对细胞存活率的影响Fig.1 Effects of WPEE,F1 and F2 on the cell viability注:NS代表相同浓度下WPEE和不同组分的细胞存活率无显著性差异(P>0.05)。
2.1.2 细胞内荧光强度的测定结果 WPEE、F1和F2(浓度均为0.1 mg/mL)对RAW264.7细胞荧光强度的影响如图2所示。DCFH-DA本身无荧光,经酯酶水解生成的DCFH可被ROS氧化成具有荧光的DCF,荧光强度越高,说明ROS含量越多,当ROS清除剂存在时,ROS含量减少则荧光强度降低,故荧光强度的测定可间接反应出样品的CAA大小[20]。由图2可知,与对照组相比,WPEE、F1和F2均可极显著降低DCF荧光强度(P<0.01),证明了WPEE、F1和F2均具有清除细胞内ROS的能力,具有良好的细胞内抗氧化效果。其中,荧光强度越低代表样品所清除的ROS含量越多,F2组的荧光强度降低最多,WPEE次之,F1降低最少,故可得出在细胞内清除ROS的能力依次为F2>WPEE>F1。

图2 WPEE、F1和F2对DCF荧光强度的影响Fig.2 Effects of WPEE,F1 and F2on the fluorescence intensity of DCF注:图中不同小写字母代表反应时间为1 h时不同样品组的DCF荧光强度差异极显著(P<0.01)。
2.1.3 CAA值测定结果 利用上述曲线的积分面积及公式(6)计算可得WPEE、F1和F2在RAW264.7细胞CAA值(图3)。在浓度为0.1 mg/mL时,WPEE、F1及F2均具有一定的抗氧化活性,且抗氧化效果差异极显著(P<0.01),由高到低依次为F2>WPEE>F1。这主要是由于F1和F2的主成分中含有柠檬酸和迷迭香酸[14],后者比起前者结构上具有多个酚羟基,而这些酚羟基通常是自由基清除的主要作用基团[30]。上述结果说明WPEE及其成分不仅在体外可以清除自由基,亦可以进入细胞内清除ROS,在细胞内亦能够发挥良好的抗氧化效果。
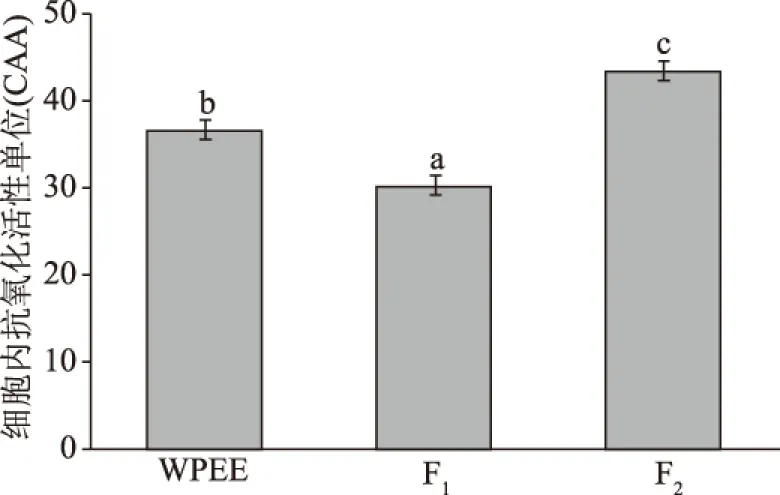
图3 WPEE、F1和F2对RAW264.7细胞内抗氧化活性单位(CAA)的影响Fig.3 Effects of WPEE,F1 and F2 on the cellularantioxidant activity(CAA)units in RAW264.7 cells注:图中不同小写字母代表相同浓度下WPEE和不同组分的细胞内抗氧化活性单位(CAA)差异极显著(P<0.01)。
2.2 WPEE、F1和F2的总抗氧化活性(TAA)
WPEE、F1和F2以及VC的TAA的测定结果如图4所示。样品液浓度与吸光度成正相关,且在测试浓度范围内(0.1~0.3 mg/mL)TAA大小顺序为:VC>F2>WPEE>F1。根据白苏叶成分的研究结果[14]可知,F1和F2的主成分中含有柠檬酸和迷迭香酸,且各占其组分含量的28%和41%,此外,F1和F2含黄酮类物质约为39%和53%。柠檬酸供氢能力较弱,是常见的金属螯合剂,而迷迭香酸以及黄酮类物质均具有多个酚羟基结构,故F2比F1具有更好的抗氧化活性。

图4 WPEE、F1和F2以及VC的总抗氧化活性(TAA)Fig.4 Total antioxidant activities(TAA)of WPEE,F1,F2 and Vc注:图中不同小写字母代表样品液浓度为0.30 mg/mL时不同样品的总抗氧化活性(TAA)差异极显著(P<0.01)。
2.3 WPEE、F1和F2清除超氧阴离子自由基(SSAR)的能力


图5 WPEE、F1和F2以及抗坏血酸(VC)对超氧阴离子自由基的清除率rate of WPEE,F1,F2 and VC注:图中不同小写字母代表相同浓度下不同样品的超氧阴离子自由基的清除率差异极显著(P<0.01);不同大写字母代表相同样品不同浓度下的超氧阴离子自由基的清除率差异极显著(P<0.01)。
2.4 WPEE、F1和F2清除羟自由基(SHR)的能力
WPEE、F1和F2以及VC在不同浓度下对羟自由基清除率的测定结果如图6所示。在浓度范围0.1~0.5 mg/mL时,样品对羟自由基的清除能力均具有浓度依赖性,浓度增加清除率升高,且WPEE和F2清除率甚至超过VC,当浓度为0.5 mg/mL时,清除能力依次为F2>WPEE>VC>F1,F2的清除率接近50%而VC仅达到36.75%。黄酮类化合物结构上具有酚羟基,而这些酚羟基是发挥羟自由基清除能力的主要作用基团,且酚羟基数目与清除能力成正相关[30]。F2中含量最高为迷迭香酸占41%,其次是野黄芩苷占27%[14]。迷迭香酸是酚酸类物质,具有多个酚羟基故具有良好的羟自由基的清除能力[31];而野黄芩苷结构上于A环具有5-和6-OH,C环具有4′-OH,对羟自由基亦具有良好的清除能力。本研究结果中F2具有更高的羟自由基清除能力亦证明了此结论。

图6 WPEE、F1和F2以及抗坏血酸(VC)对羟自由基(OH-·)的清除率Fig.6 Hydroxyl radicals(OH-·)scavengingrate of WPEE,F1,F2 and VC注:图中不同小写字母代表样品液浓度为0.5 mg/mL时不同样品的羟自由基清除率差异极显著(P<0.01)。
2.5 WPEE、F1和F2清除DPPH自由基(SDR)的能力
WPEE、F1和F2以及VC对DPPH自由基清除率测定结果如图7所示。在浓度范围0.02~0.10 mg/mL时,样品对DPPH自由基的清除能力均随着浓度的升高而增加。当样品浓度为0.10 mg/mL时,清除能力依次为VC>F2>WPEE>F1(P<0.01),其中F2对DPPH自由基的清除率较高,亦证明了F2主要成分迷迭香酸及黄酮类化合物的结构上所具有的酚羟基有助于自由基的清除。

图7 WPEE、F1和F2以及抗坏血酸(VC)对DPPH自由基的清除率Fig.7 DPPH free radicals scavengingrate of WPEE,F1,F2 and Vc注:图中不同小写字母代表样品液浓度为0.10 mg/mL时不同样品的DPPH自由基清除率差异极显著(P<0.01)。
2.6 WPEE、F1和F2抑制卵黄脂蛋白脂质过氧化(ILLP)的能力
WPEE、F1和F2以及VC抑制卵黄脂蛋白脂质过氧化能力的测定结果如图8所示。在相同浓度0.1 mg/mL时,VC与WPEE各组分对脂质过氧化均有抑制效果,其中F2和WPEE的抑制率分别达到了72.40%和68.04%,均极显著高于VC的54.02%(P<0.01),但F1的抑制率较低,为23.03%。该反应模式是利用Fe2+诱发卵黄脂蛋白的PUFA更易产生脂质过氧化[32],而黄酮类化合物具有抑制脂蛋白PUFA的脂质过氧化功能,本研究中WPEE对该脂质过氧化的抑制率高于70%的结果亦证明了此结论:F2脂质过氧化抑制率最高主要是因其主成分(迷迭香酸和野黄芩苷)的酚羟基数量多,易与自由基反应;相反地,F1抑制率低是由于其第一主成分是柠檬酸无酚羟基,且第二主成分芹菜素-6,8-二-C-葡萄糖苷[14]具有C-6,8位碳糖苷,已有研究表明,此糖苷对黄酮的抗氧化活性及清除自由基能力具有不利影响[33]。故WPEE的F1和F2抑制脂质过氧化能力差距较大。
图8 WPEE、F1和F2以及VC对卵黄脂蛋白脂质过氧化的抑制率Fig.8 Inhibition rate of yolk lipoproteinperoxidation of WPEE,F1,F2 and VC注:图中不同小写字母代表相同浓度下不同样品对卵黄脂蛋白脂质过氧化的抑制率极显著(P<0.01)。
2.7 相关性分析

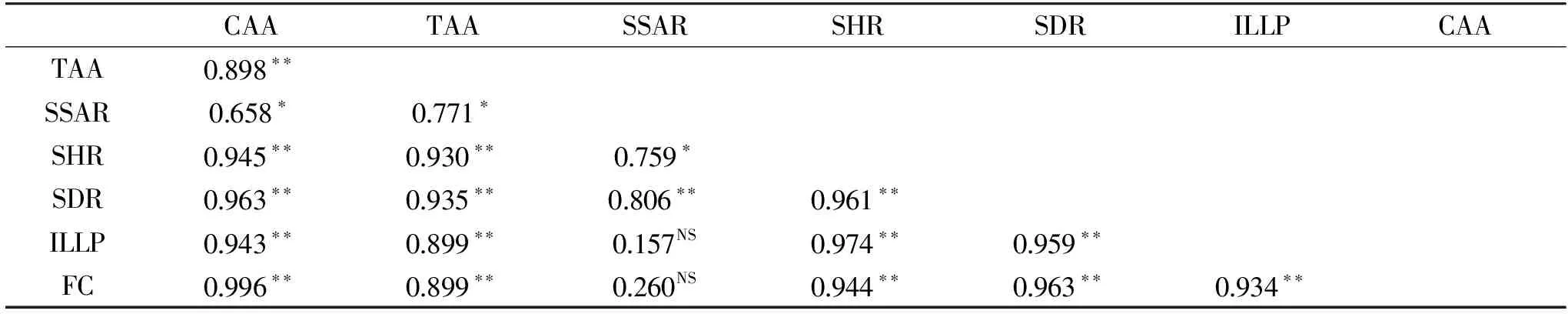
表1 抗氧化活性及清除自由基能力、WPEE相对含量的皮尔森相关系数Table 1 Pearson’s correlation coefficients among antioxidant activities,free radical scavenging activities and relative content of WPEE
3 结论
本研究结合六种不同体系对WPEE体外抗氧化活性及清除自由基能力进行评价。对于黄酮抗氧化活性的正确评价需要结合其理想浓度,因为不同体系所使用的方法原理、灵敏度、特征性均不一致,故每种体系所使用的黄酮浓度均是不同的。独立的测定方法、不同浓度、不同组分的测定结果全面评价了WPEE的抗氧化活性和清除自由基能力。六种评价方法均证实WPEE有明显的抗氧化活性,其中TAA、SSAR和SDR活性顺序均为:VC>F2>WPEE>F1,但SHR及ILLP活性顺序为:F2>WPEE>VC>F1。综上所述,WPEE作为天然抗氧化剂完全有潜力代替人工合成抗氧化剂应用于食品工业,天然、安全、无污染。未来的研究热点可能包括建立一整套操作成本低廉、简便、结果可靠且较为全面的测试方法所构成的植物天然抗氧化性能评价标准与体系。

