青麦仁分离蛋白理化性质及功能特性的研究
,*
(1.河南省农业科学院农副产品加工研究中心,河南省全谷物小麦制品加工国际联合实验室,河南省全谷物鲜食加工工程技术研究中心,河南郑州 450002; 2.郑州大学化学与分子工程学院,河南郑州 450001; 3.淮阳县金农实业有限公司,河南淮阳 466700; 4.民权县科农食品贸易有限公司,河南民权 476800; 5.江苏省农业科学院,江苏南京 210014;6.江苏徐淮地区连云港农业科学研究所,江苏连云港 222000)
随着全球人口剧增,人们对蛋白质的需求量不断增加。苜蓿叶可溶性蛋白、核桃分离蛋白、马铃薯分离蛋白等许多新型蛋白资源已被人们开发利用[1-3],新型植物蛋白资源开发、提高优质植物蛋白质的利用率已经成为全球性的发展方向。
青麦仁是已长饱满、还处于乳熟期的小麦粒,色泽碧绿,口感独特,富含蛋白质,是一种深受大众喜爱、营养价值较高的全谷物食品[4]。鲜食青麦仁蛋白的能量和营养价值明显优于大多数植物蛋白质,是优质价廉的天然氮源,具有广阔的发展前景[5]。我国小麦资源丰富,2019年产量约13106万吨,居世界前列。目前对小麦的研究主要集中于面粉的开发利用及面制品品质的改良方面[6-8],而对鲜食青麦仁的研究还鲜有报道。青麦仁通常作为全谷物鲜食菜肴在餐桌上食用,对其功能性营养因子的综合性开发及利用研究相对较少。目前,主要集中在加工工艺的开发上[9-11],通过对青麦仁分离蛋白理化特性及加工特性的研究,将其作为一种新型优质植物蛋白质资源的开发,对于提高其附加值、发展可循环经济具有十分重要的意义。
本论文以青麦仁为原料制备优质分离蛋白,提取分离清蛋白、球蛋白、醇溶蛋白和谷蛋白,对4种蛋白表面微观结构及青麦仁组分进行分析,并研究分离蛋白的分子量分布及氨基酸组成、理化性质、持水性、持油性、乳化性、起泡性,为青麦仁分离蛋白质的进一步开发及应用提供基础数据和理论支撑。
1 材料与方法
1.1 材料与仪器
青麦仁(百农201) 河南省农科院农副产品加工研究所提供;石油醚(30~60 ℃)、浓硫酸、浓盐酸(盐酸浓度36%~38%)、甲醇、冰醋酸、无水乙醇、氯仿、硼酸、甲基红指示剂、溴甲酚绿指示剂、氢氧化钠、消化片、无水亚硫酸钠、氯化钠、磷酸二氢钾、十二烷基硫酸钠、三羟甲基氨基甲烷等 均为国产分析纯。
DHG-9240A鼓风干燥箱 上海精宏实验设备有限公司;SOX500脂肪测定仪 山东海能科学仪器有限公司;TC-4-10陶瓷纤维炉 北京中兴伟业仪器有限公司;JW1042低速离心机 安徽嘉文仪器装备有限公司;K110全自动凯氏定氮仪 山东海能科学仪器有限公司;A300全自动氨基酸分析仪 德国曼默博尔;Quanta250FEG扫描电子显微镜 美国FEI;DYCZ-24DN电泳仪、DYY-6C型电泳仪电源、WD-9413B型凝胶成像分析系统 北京六一生物科技有限公司;SK-R330-Pro数显型翘板摇床 北京大龙兴创实验仪器有限公司;800Y多功能粉碎机 永康市铂欧五金制品有限公司。
1.2 实验方法
1.2.1 样品脱脂处理 参照MacRitchie等[12]的方法,略有改动。青麦仁冷冻干燥后,用多功能粉碎机粉碎成粉末,过60目筛。称取一定量青麦仁粉和氯仿在室温下按照1∶2混合,电子搅拌器搅拌5 min,悬浮液用布氏漏斗抽滤,残余青麦仁粉重复此程序3次。脱脂青麦仁粉放置通风橱中,室温自然晾干,直至无氯仿气味。
1.2.2 青麦仁分离蛋白的制备 参考Hettiarachchy等[13]、朱科学等[14]和葛毅强等[15]的方法,略有改动。脱脂后的100 g青麦仁粉与0.5 mol/L氯化钠溶液按1∶10的料液比混合,室温搅拌1 h,待粉末充分润湿后用1 mol/L氢氧化钠溶液调pH至9,继续搅拌30 min并保持溶液pH不变。而后在4000 r/min转速下离心30 min,收集上清液,对残渣进行再次提取后与第一次收集的上清液合并,余下残渣弃去。上清液用1.0 mol/L盐酸调pH至蛋白的等电点,室温搅拌30 min,静置20 min,在4000 r/min转速下离心30 min,弃去上清液收集沉淀,冷冻干燥后得到分离蛋白。
1.2.3 青麦仁分离蛋白中四种蛋白测定 根据Osborne[16]的分类法,青麦仁中所含的蛋白质可分为清蛋白、球蛋白、麦醇溶蛋白及麦谷蛋白。结合王艳玲[17]和杨帆[18]的方法,四种蛋白的含量测定方法如下:
清蛋白含量的测定:称取1 g青麦仁蛋白置于烧杯中加入20 mL蒸馏水搅拌均匀,45 ℃搅拌2 h,在4000 r/min条件下离心20 min,收集上清液,于25 mL容量瓶定容后分析蛋白质含量。沉淀物蒸馏水洗涤后作为后续实验的原料。
球蛋白含量的测定:清蛋白提取后的沉淀物加入10 mL 5%亚硫酸钠溶液,45 ℃搅拌1.5 h,在4000 r/min条件下离心20 min,收集上清液,于25 mL容量瓶定容后分析蛋白质含量。沉淀物用蒸馏水洗涤后作为后续实验的原料。
麦醇溶蛋白含量的测定:在球蛋白提取后的沉淀物中加入8 mL的70%乙醇溶液,50 ℃搅拌20 min,在4000 r/min条件下离心20 min,残渣进行再次提取,合并两次离心获得的上清液,于25 mL容量瓶定容后分析蛋白质含量。沉淀物作为后续实验的原料。
麦谷蛋白含量的测定:向麦醇溶蛋白提取后的沉淀物中加入8 mL 0.04%氢氧化钠溶液,50 ℃搅拌1.5 h,在4000 r/min条件下离心20 min,收集上清液,于25 mL容量瓶定容后分析蛋白质含量。
1.2.4 分离蛋白的纯度测定 以脱脂后的青麦仁粉为原料,利用等电点离心沉淀法进行制备,通过蛋白纯度计算公式进行计算。计算公式如下:
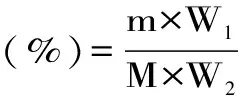
式(1)
式中:m为得到的蛋白的质量,g;W1为得到的蛋白含蛋白量,%;M为提取蛋白消耗的样品粉质量,g;W2为提取蛋白消耗的样品粉含蛋白量,%。
1.2.5 青麦仁分离蛋白微观结构的观察 剪取适量静电双面胶带贴在扫描电镜载物台上,取过100目筛的样品适量,均匀平铺较薄一层于已贴好静双面胶上,放入镀金器中真空镀金。在电压20 kV、15 Pa低真空模式下,用扫描电子显微镜观察分离蛋白在10000倍下的表面形态特征。
1.2.6 青麦仁基本成分的测定 蛋白质的测定方法参照GB/T 5009.5-2016;淀粉的测定方法参照GB/T 5009.9-2016;脂肪的测定方法参照GB/T 5009.6-2016;膳食纤维的测定方法参照GB/T 5009.88-2014;灰分的测定方法参照GB/T 5009.4-2016。
1.2.7 青麦仁分离蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳 采用12%分离胶、5%浓缩胶对青麦仁分离蛋白进行SDS-PAGE电泳分析;1 mg样品溶于1 mL 1(上样缓冲液中,沸水煮8 min,冷却后上样。恒定电流15 mA,电泳约40 min;待溴酚蓝进入分离胶后,恒定电流调至25 mA,电泳约80 min,待溴酚蓝距凝胶边缘约5 mm时,停止电泳;用考马斯亮蓝R250对胶体进行染色2 h后,放到翘班摇床进行均匀脱色,多次更换脱色液,直至蛋白条带清晰,用凝胶成像系统进行电泳图谱拍摄[19]。
1.2.8 青麦仁分离蛋白的氨基酸分析 参考温青玉等[20]方法进行测定。准确称取一定量的样品(100 mg)置安瓿瓶中并加入6 mol/L HCl 10 mL。氮吹仪吹氮5 min左右。手持式喷灯封口,确认密封后置110 ℃烘箱水解24 h。冷却至室温后开封,将水解液转移至50 mL烧杯,超纯水冲洗水解管3次,LiOH调节滤液至pH=2.2后转移至50 mL容量瓶,超纯水冲洗烧杯3次合并滤液,用超纯水定容至50 mL。取容量瓶中溶液用样品稀释液(稀释比例1∶1),后经0.22 μm有机系针头滤膜过滤后,放置A300全自动氨基酸分析仪自动进样器上进样分析。
1.2.9 分离蛋白等电点的测定 结合董银卯等[21]和郭娜等[22]的方法,准确称取青麦仁分离蛋白9份,用去离子水配制1%(m/V)蛋白溶液20 mL,用1.0 mol/L HCl和NaOH调溶液pH为4.0、4.2、4.4、4.6、4.8、5.0、5.2、5.4、5.6、5.8的序列,然后磁力搅拌1 h,4000 r/min转速下离心20 min,称量沉淀的质量,以pH为横坐标,沉淀质量为纵坐标,绘出沉淀质量-pH的关系图。沉淀质量最大pH即为蛋白质的等电点。
1.2.10 青麦仁分离蛋白溶解度的测定 参考朴金苗等[23]测定方法,将1~2 g青麦仁分离蛋白溶于100 mL蒸馏水中,而后用0.5 mol/L氢氧化钠溶液和0.5 mol/L盐酸分别调节pH至2、3、4、5、6、7、8、9、10,室温振荡1 h,4000 r/min离心20 min,取上清液,使用凯氏定氮法测定上清液中氮含量。溶解度表示为上清液中氮含量与样品中总的氮含量的百分比。

式(2)
1.2.11 青麦仁分离蛋白持水性、持油性的测定 参考王振斌等[24]和孙媛[25]测定方法。称取0.25 g青麦仁分离蛋白于离心管中,加入25 mL蒸馏水(食用油),充分振荡、混匀后,置于恒温培养振荡器中,设置温度40 ℃,时间30 min,转速120 r/min。结束后在4000 r/min的离心机离心15 min,倒掉上层未吸附的水(食用油),称重,计算每克蛋白质样品的持水性(持油性)。以小麦蛋白为实验材料进行对照试验,操作方法同上。
式(3)
式中:W0为蛋白样品的质量,g;W1为离心管加样品的总质量,g;W2为离心后离心管加沉淀的总质量,g。
1.2.12 青麦仁分离蛋白起泡性与泡沫稳定性的测定 蛋白液浓度对蛋白起泡性及泡沫稳定性的影响:用pH为7的磷酸盐缓冲液配制浓度分别为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%的蛋白液,测其起泡性及泡沫稳定性。pH对蛋白起泡性及泡沫稳定性的影响:将浓度为0.2%的蛋白液调pH至2、4、6、8、10、12,然后测起泡性及泡沫稳定性。
参考李涛[26]的方法。用青麦仁分离蛋白配制一定浓度的蛋白液100 mL,用迷你辅食料理机搅打1 min后马上倒入250 mL量筒,读取泡沫体积V0后计算起泡性,静置60 min后读取体积V60后计算泡沫稳定性。

式(4)

式(5)
式中:V0为0 min的泡沫体积,mL;V60为60 min的泡沫体积,mL。
1.2.13 青麦仁分离蛋白乳化性与乳化稳定性的测定 蛋白液浓度对蛋白乳化性及乳化稳定性的影响:用pH为7的磷酸盐缓冲液配制浓度分别为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%的蛋白液,测其乳化性及乳化稳定性。pH对蛋白乳化性及乳化稳定性的影响:将浓度为0.2%的蛋白液调pH至2、4、6、8、10,12,然后测乳化性及乳化稳定性。
参考Pearce等[27]的方法,用青麦仁分离蛋白配制一定浓度的蛋白液20 mL,与25 mL食用油在迷你辅食料理机中乳化1 min。制备好的乳化液迅速倒入小烧杯中,立即从烧杯底部取100 μL乳化液于试管中,加入 4.9 mL 0.1%(w/v)SDS稀释,混匀后测量500 nm的吸光值(A0)。静置10 min重新取样测定吸光值(A10)。
乳化性(EC)=A0
式(6)

式(7)
式中:A0为0 min的吸光度值;A10为10 min的吸光度值。
1.3 数据处理
所得试验数据均为3次实验的平均值,实验数据采用SPSS statistics 16.0进行统计处理,显著性比较采用单因素方差分析,当P<0.05时表示数据间具有显著性差异。采用Origin 8.0进行绘图处理。
2 结果与分析
2.1 青麦仁分离蛋白基本成分分析
小麦蛋白分为清蛋白、球蛋白、麦醇溶蛋白及麦谷蛋白,由表1可以看出,青麦仁和小麦分离蛋白的纯度分别为纯度82.87%和83.24%,各组分含量分别为清蛋白60.1%和16.0%、球蛋白3.7%和11.2%、麦醇溶蛋白2.9%和27.4%、麦谷蛋白3.2%和36.8%、其它蛋白30.1%和8.6%。通过对比分析,青麦仁分离蛋白和小麦分离蛋白在四种蛋白组成上存在不同,这说明其理化性质和功能特性具有一定的差异性。
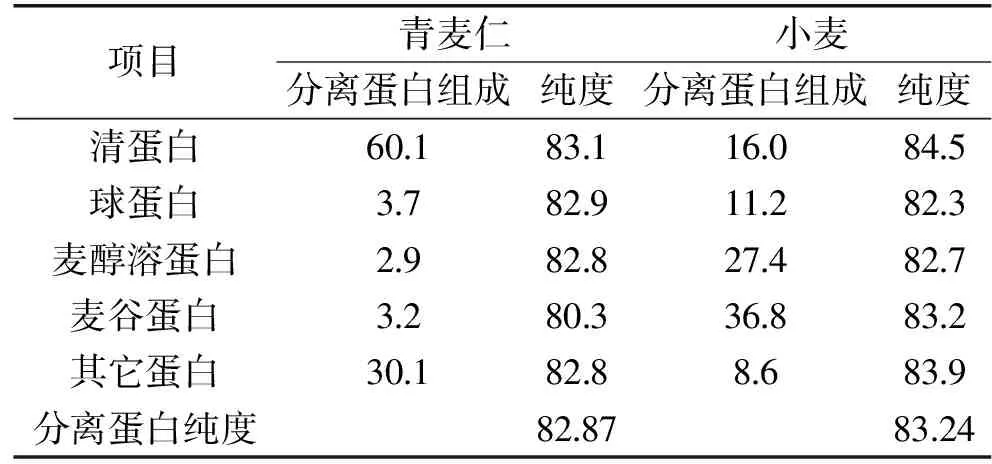
表1 青麦仁分离蛋白的组成(%)Table 1 Composition of protein isolatedfrom green wheat kernel(%)
2.2 青麦仁分离蛋白电镜分析
青麦仁分离蛋白中的清蛋白、球蛋白、麦醇溶蛋白和麦谷蛋白的颗粒表面形态存在较大差异,利用扫描电子显微镜在10000倍数下观察,结果显示见图1。清蛋白呈山脊状,表面细致多层,局部有小孔;球蛋白表面疏松,构象无规则;麦醇溶蛋白表面凸起,由结构紧密的多层片状构成;麦谷蛋白表面光滑,表现为多孔的片状结构。

图1 青麦仁分离蛋白的环境扫描电镜图(10000×)Fig.1 ESEM images of protein isolatefrom green wheat kernel(10000×)
2.3 青麦仁基本成分分析
青麦仁和小麦中蛋白、淀粉、脂肪、膳食纤维及灰分等组分含量见表2。青麦仁和小麦的总蛋白含量分别为11.21%和11.70%,基本无差别,这说明乳熟后期、蜡熟期的青麦仁蛋白表达基本完成;青麦仁和小麦的淀粉含量分别为55.86%和59.25%,这说明青麦仁后期脱水过程中淀粉含量会继续增加;青麦仁和小麦的脂肪含量分别为1.15%和1.43%,这说明小麦胚的形成及脂肪的富集都在小麦成熟的后期完成;青麦仁和小麦的膳食纤维含量分别为11.79%和11.24%,说明乳熟后期的青麦仁的膳食纤维还没有完全木质化;青麦仁和小麦的灰分含量分别为1.30%和1.48%,说明在小麦脱水过程中仍然会有矿物质的富集。通过和成熟小麦组成的对比分析,青麦仁可以作为一种新型优质蛋白质资源进行开发。
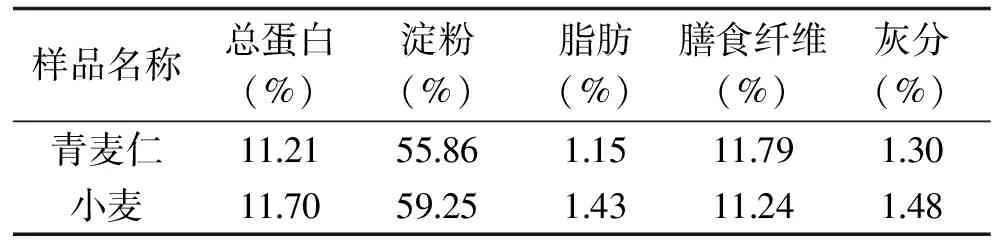
表2 青麦仁和小麦的基本成分Table 2 Basic components of greenwheat kernel and wheat table
2.4 青麦仁分离蛋白SDS-PAGE电泳分析
SDS-PAGE电泳采用12%分离胶、5%浓缩胶对青麦仁分离蛋白进行分析,用Alphalmager HP凝胶成像系统拍照得到的电泳图谱如图2所示。
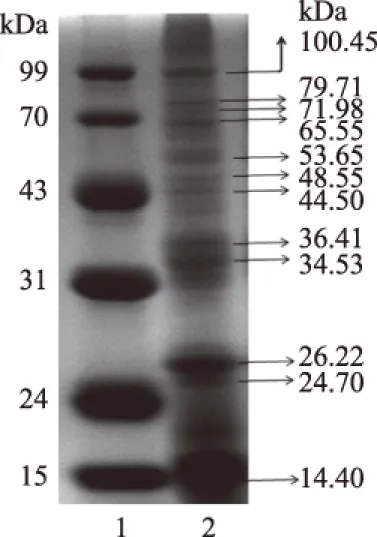
图2 青麦仁分离蛋白的电泳图Fig.2 Electrophoretogram of protein isolatefrom green wheat kernel注:1:蛋白Marker;2:青麦仁分离蛋白。
青麦仁分离蛋白共呈现12条谱带。由蛋白Marker分子量对数与相对迁移率(此处相对迁移率指电泳谱带到电泳前沿的距离,清蛋白谱带相对迁移率与之相同)作标准曲线,蛋白Marker分子量对数与相对迁移率关系式y=-0.0048x3+0.0717x2-0.4235x+5.4152,R2=0.9985。将青麦仁分离蛋白条带相对迁移率带入公式,得到青麦仁分离蛋白分子量对数,进而得到青麦仁分离蛋白分子量见表3。青麦仁分离蛋白12条谱带分子量由小到大排列分别为14.40、24.70、26.22、34.53、36.41、44.50、48.55、53.65、65.55、71.98、79.71、100.45 kDa。

表3 SDS-PAGE青麦仁分离蛋白分子量表Table 3 SDS-PAGE protein isolate molecular weight of green wheat kernel table
2.5 青麦仁分离蛋白的氨基酸分析
由于本实验采用酸水解法,因此色氨基酸含量无法进行分析检测,其它种类的氨基酸含量测定结果如表4所示。青麦仁分离蛋白中氨基酸含量丰富,种类齐全,其中谷氨酸的含量最高,达38.3%。谷氨酸不仅属于鲜味氨基酸,在医学上谷氨酸还用于治疗肝性昏迷,改善儿童智力发育。亮氨酸、缬氨酸和异亮氨酸统称支链氨基酸(BCAA),一起合作修复肌肉,控制血糖,并给身体组织提供能量,是最重要和最有效的营养补剂。青麦仁分离蛋白必须氨基酸中亮氨酸含量最高,占总氨基酸的8.3%,异亮氨酸为3.4%,蛋氨酸最少为1%,缬氨酸未检出。青麦仁分离蛋白中必需氨基酸占总氨基酸的比例为24.2%,必需氨基酸与非必需氨基酸的比值为29∶83。

表4 青麦仁分离蛋白的氨基酸组成和含量Table 4 Amino acid composition andcontent of isolated protein table
表5结果显示,青麦仁分离蛋白氨基酸含量丰富。从评分来看,根据氨基酸评分,青麦仁分离蛋白中第一限制性氨基酸为缬氨酸,第二限制性氨基酸为赖氨酸。蛋氨酸和半胱氨酸、苯丙氨酸和酪氨酸含量较高,其它接近FAO/WHO计分模式,说明青麦仁分离蛋白中必需氨基酸含量基本符合FAO/WHO模式。从化学评分看,第一限制性氨基酸为缬氨酸,第二限制性氨基酸为赖氨酸。
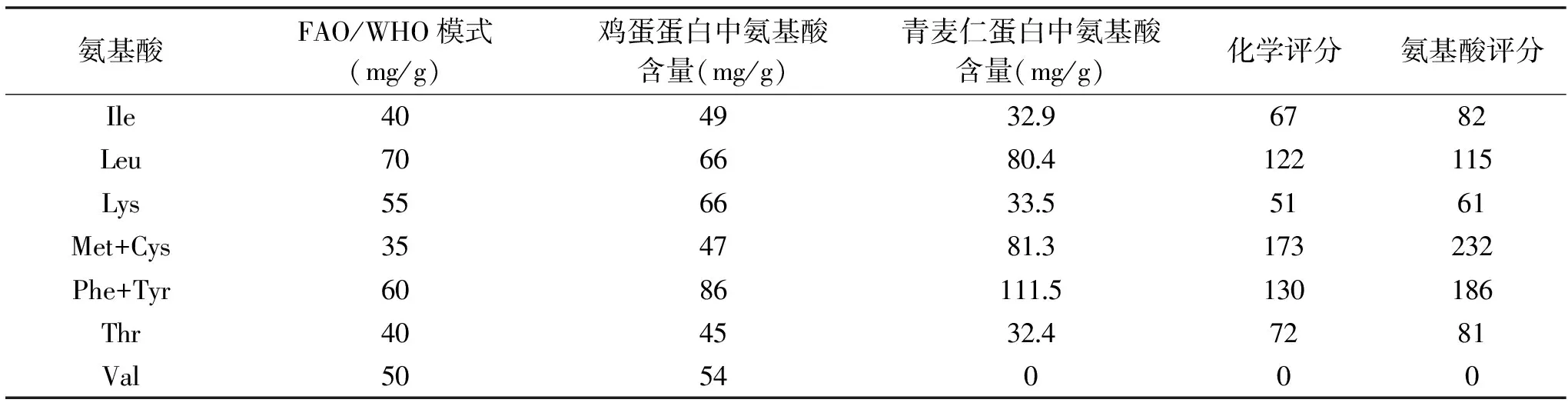
表5 分离蛋白中必须氨基酸含量及评分Table 5 Essential amino acid composition and scoring of isolated protein table
2.6 青麦仁分离蛋白的等电点
蛋白质是两性物质,在等电点时,蛋白质聚集、沉淀,因此常选取蛋白质等电点处pH来进行蛋白质沉淀[18]。实验结果如图3所示,青麦仁分离蛋白沉淀质量呈现先上升后下降趋势,在pH4.8~5.4之间,沉淀质量并无显著差异(P>0.05)。在pH5.0左右沉淀质量最大,为0.381 g,此时蛋白质的静电斥力最小,有尽可能多的蛋白质发生凝聚而沉淀,有此可以推断青麦仁分离蛋白的最佳沉淀点在5.0左右,这与小麦分离蛋白等电点(pH5.2)具有一定的差异性[20]。等电点的差异性也可以解释它们各自组分的差异性,并在实验中也证实了青麦仁分离蛋白中没有面筋蛋白,这说明青麦仁分离蛋白是具有一定特殊性的优质蛋白来源。

图3 分离蛋白的等电点Fig.3 Isoelectric point of the isolated protein
2.7 青麦仁分离蛋白的功能特性
2.7.1 青麦仁分离蛋白的溶解度 溶解度是考察蛋白质溶解性的一个重要的功能性指标,受pH、离子强度、有机溶剂等因素的影响[27]。实验结果如图4所示,青麦仁分离蛋白溶解性先降低后升高,在pH6溶解度最低,与其它pH的溶解度存在显著差异(P<0.05),这与它们的等电点比较接近有很大关系;在蛋白质的等电点处,正负电荷数相等,静电斥力降低,蛋白质发生凝聚而沉淀,溶解度最小;离开等电点,蛋白的溶解度都明显增加,当pH小于2或者大于8时,大部分蛋白成溶解状态。
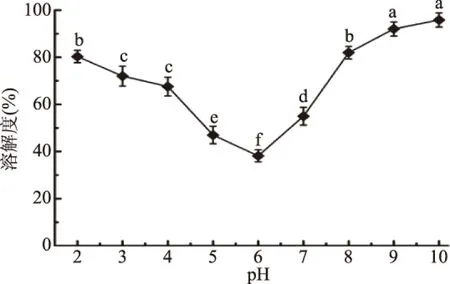
图4 分离蛋白在不同pH下的溶解度Fig.4 Solubility of isolated protein at different pH
2.7.2 青麦仁分离蛋白的持水性和持油性 蛋白的持水性是指蛋白与水分子的结合能力,在蛋白食品的加工过程当中起着非常重要的作用。实验结果如表6所示,青麦仁分离蛋白的持水性为2.02 g·g-1,持油性为7.18 g·g-1;通过和小麦分离蛋白的持水性和持油性进行对比分析能够看出,青麦仁分离蛋白持油性较好,持水性稍差。据此可将其应用到肉制品、烘焙制品、油炸食品等食品的生产中。

表6 分离蛋白的持水性和持油性Table 6 Water holding capacity andoil holding capacity of the isolated protein
2.7.3 起泡性与泡沫稳定性 蛋白浓度对青麦仁分离蛋白起泡性和泡沫稳定性的影响见图5所示。青麦仁分离蛋白的起泡性和起泡稳定性随蛋白液浓度(0.2%~0.6%)的增大而增强,存在显著差异(P<0.05);当蛋白浓度达到0.6%时,蛋白的起泡性最大,稳定性最佳,随后差异不显著(P>0.05);这是由于蛋白液浓度增大,溶解的蛋白质增多,蛋白发泡力呈现增加的趋势,起泡性也就随之增强,维持泡沫稳定的蛋白量增多,泡沫稳定性增强。

图5 蛋白浓度对起泡性和泡沫稳定性的影响Fig.5 Effect of protein concentrationon foaming properties and foam stability
pH对蛋白起泡性和泡沫稳定性的影响如图6所示。随pH增大,青麦仁分离蛋白的起泡性和泡沫稳定性先减小后增大,在pH为6时起泡性最低,和其他pH时存在显著差异(P<0.05);而起泡稳定性在pH4、6、8无显著差异(P>0.05)。蛋白的起泡性与其溶解度有关,溶解度在pH为6时较小,可溶性蛋白量最小,不溶性蛋白较多,起泡性就差,蛋白维持泡沫稳定的能力也就差一些。在远离pH6的酸性和碱性范围内,起泡性都较好,主要是因为pH高于或低于等电点,蛋白质在溶液中是处于伸展状态,有利于其快速分散到空气与水界面包埋空气颗粒,从而改变蛋白质的起泡性。
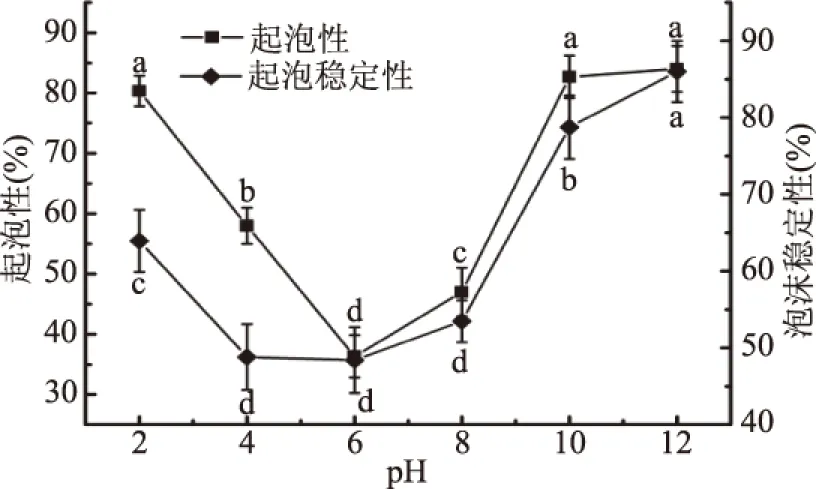
图6 pH对蛋白起泡性和泡沫稳定性的影响Fig.6 Effect of pH on foaming propertiesand foam stability of protein
2.7.4 乳化性与乳化稳定性 分离蛋白液浓度对蛋白乳化性和乳化稳定性的影响结果如图7所示。青麦仁分离蛋白的乳化性随蛋白浓度增加而增加,主要因为随着蛋白液浓度增大会使界面膜的厚度增大,膜的强度也因此提高,乳化性也就越来越大;青麦仁分离蛋白的乳化性随蛋白浓度增大而增加,达到0.8%后,蛋白乳化性变化不大,蛋白浓度在0.2%~0.6%和0.6%~1.4%时均没有显著差异(P>0.05)。青麦仁分离蛋白的乳化稳定性随着蛋白浓度增大而增强,达到0.8%之后,蛋白的乳化性稳定性变化不大,无显著差异性(P>0.05);这说明在一定范围内,蛋白液浓度越大,蛋白的乳化稳定性就越大。

图7 蛋白浓度对乳化性和乳化稳定性的影响Fig.7 Effect of concentration on emulsifyingand emulsifying stability of protein
不同pH对蛋白乳化性和乳化稳定性的影响结果如图8所示。青麦仁分离蛋白的乳化性先下降后上升趋势,在pH4、6、8时乳化性差异不显著(P>0.05);在pH6时乳化性最差,在pH12时的乳化性较好,说明碱性条件下蛋白的乳化性较好。这与蛋白的溶解性有密切关系,许多蛋白均有“等电点附近乳化性差,偏离等电点乳化性增强”的规律。这是因为蛋白质在它的表面性质起作用之前必须先溶解和移动到表面,不溶性的蛋白对乳化作用的贡献很小,因此蛋白质的乳化性质和溶解度之间通常呈正相关。青麦仁分离蛋白的乳化稳定性随pH的增大先下降后上升,在pH为6时最差,与pH2、10、12存在显著差异(P<0.05);pH低于6时,蛋白的乳化稳定性随pH的增加而减少;pH高于6时,蛋白的乳化稳定性随pH的增加而增加;这是因为pH首先影响了蛋白的溶解性,而溶解的蛋白的乳化性质又依赖于乳化液中的亲油-亲水基的动态平衡[28]。
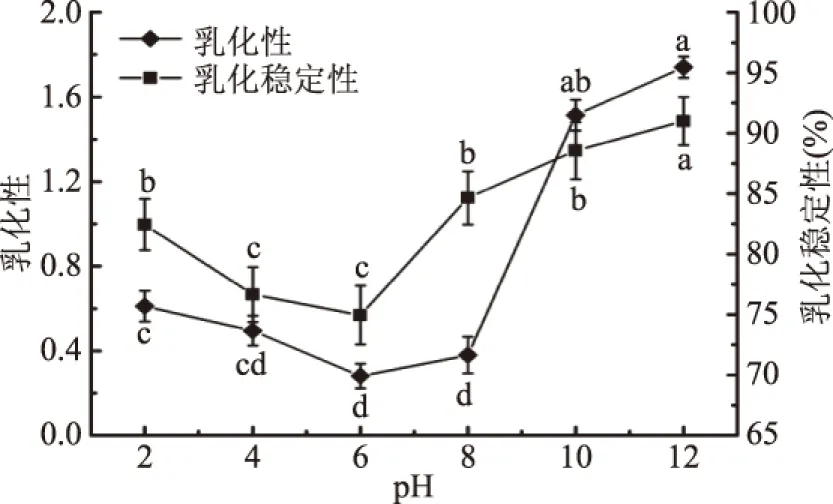
图8 pH对蛋白乳化性和乳化稳定性的影响Fig.8 Effect of pH on emulsifyingand emulsifying stability of protein
3 结论
青麦仁中清蛋白、球蛋白、麦醇溶蛋白、麦谷蛋白及其它蛋白的含量分别为60.1%、3.7%、2.9%、3.2%、30.1%,其中麦醇溶蛋白和麦谷蛋白远远低于成熟小麦,导致后期加工过程中无法形成面筋网络。扫描电镜分析表明:清蛋白呈山脊状,表面细致多层,局部有小孔;球蛋白表面疏松,构象无规则;麦醇溶蛋白表面凸起,由结构紧密的多层片状构成;麦谷蛋白表面光滑,为多孔片状结构。通过青麦仁的蛋白、淀粉、脂肪、膳食纤维及灰分等组分分析,说明小麦在乳熟后期、蜡熟期基本上是灌浆完成,此时青麦仁分离蛋白中有分子量为14.40、24.70、26.22、34.53、36.41、44.50、48.55、53.65、65.55、71.98、79.71、100.45 kDa的12种蛋白和蛋白亚基。青麦仁中谷氨酸含量为38.3%,必需氨基酸占总氨基酸的比为24.2%,必需氨基酸与非必需氨基酸的比值为29∶83。
青麦仁蛋白的等电点为5.0,pH6时溶解度最低,持水性为2.02 g·g-1,持油性为7.18 g·g-1,说明青麦仁分离蛋白持油性较好,持水性稍差,可以将其应用到肉制品、烘焙制品、油炸食品等食品的生产中。青麦仁分离蛋白浓度0.6%时,起泡性最大,泡沫稳定性最佳;浓度达到0.8%之后,蛋白的乳化性和乳化稳定性变化不大,无显著差异性(P>0.05);pH6时,起泡性最小,泡沫稳定性最差;pH为6时乳化性和乳化稳定性均最差;这些结果可以为下一步青麦仁分离蛋白的应用提供基础数据支撑。
综合分析,青麦仁分离蛋白是一种优良的植物蛋白资源,和其它谷物混合食用可以起到营养互补作用,提高营养价值;具有优良的持油性、乳化性、起泡性、稳定性等特殊的功能特性,为其进一步应用开发提供广阔的市场前景。

