MMP-2、MMP-9在恶性黑色素瘤中的表达及预后意义
万梦弟,尤艳
(哈尔滨医科大学附属第四医院,黑龙江哈尔滨150001)
恶性黑色素瘤(Malignant melanoma,MM)简称恶黑,是来源于黑色素细胞、恶性度极高的疾病,其五年生存率从Ⅰ期的95%降至Ⅳ期的不足10%[1]。恶黑已成为皮肤癌致死疾病的首位,其中浸润和转移是导致患者死亡的主要因素。目前研究表明,MM发病有多因素、多步骤、逐步变化的特征:由正常上皮黑色素细胞增殖,继而向真皮层侵袭,最后发展为MM,其中分子水平的变化是关键[2]研究显示基质金属蛋白酶(MMP)显著促进癌细胞的迁移[3],MMP-2与MMP-9是MMP家族中的重要成员,对癌细胞的侵袭和转移发挥着重要作用。因此,本研究应用免疫组化方法观察MM组织中MMP-2和MMP-9的表达情况以及结合统计学分析其阳性表达与患者生存期的关系。
1 材料与方法
1.1 研究对象 52例MM患者(试验组)、20例色素痣患者(对照组)标本均来自于2010~2015年哈尔滨医科大学肿瘤医院病理科确诊的石蜡包埋组织块,全部病例术前均未采取放、化疗等任何干预措施,且全部经过皮肤科2位病理医师共同确认,所有病例从术后随访至2018年9月1日记录其生存期,期间患者死亡随访停止,收集52例MM患者的生存时间、生存结局及影响因素(性别、年龄、MMP-2、MMP-9)。试验组其中男 29 例,女 23 例,年龄25~78岁,平均58岁;对照组男8例,女12例,年龄21~76岁,平均52岁。
1.2 主要试剂及仪器 兔抗人MMP-2、MMP-9单克隆抗体购自武汉博士德公司,SP试剂盒、DAB显色试剂盒购自北京中山生物公司,石蜡切片机为上海美盛生产的LEICA RM 2125,摄影显微镜为日本光学工业株式会社生产。
1.3 实验方法及步骤 免疫组化SP法检测MMP-2、MMP-9。实验步骤:石蜡切片脱蜡至水,切片放入缓冲液中微波炉加热15 min进行抗原热修复,加3%H2O2孵育20 min阻断内源性过氧化物酶,分别滴加 MMP-2、MMP-9 一抗工作液(工作浓度 1∶100)4℃冰箱过夜,然后按说明书进行DAB显色,显微镜下双蒸水终止显色,苏木素复染3 min,梯度酒精脱水后树胶封片,上镜读片。
1.4 结果判断 MMP-2和MMP-9表达于细胞浆和细胞膜上,随机选取5个高倍镜(40×)视野阅片,采用免疫反应积分法(Immuno-reactive score,IRS)[4]进行综合判断,IRS=阳性细胞百分比积分×阳性细胞染色强度积分,阳性细胞百分比积分标准:根据显微镜下阳性细胞所占百分比积分,未着色0分,1%~10%为 1分,11%~25为 2分,26%~50%为 3分,>50%为4分;阳性细胞染色强度计分标准:无着色为0分,黄色为1分,棕黄色为2分,棕褐色为3分。IRS>4为阳性,≤4为阴性。所有结果都由2位皮肤病理医师双盲阅片。
1.5 统计学处理 应用SPSS 19.0对实验数据进行统计学分析。MMP-2和MMP-9在MM与色素痣中表达差异采用χ2检验,P<0.05为差异有统计学意义;性别、年龄、MMP-2和MMP-9在MM表达与预后关系采用多变量Cox回归分析,校正性别、年龄因素后应用Kaplan-Meier法绘制MMP-2与MMP-9生存率曲线,之间的差异应用Log-rank检验,P<0.05为差异有统计学意义。
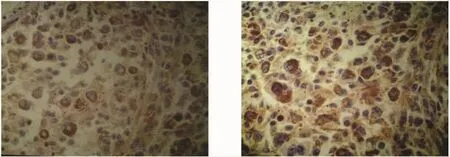
图1A MMP-2在MM组织中的表达
2 结果
2.1 MMP-2、MMP-9在MM、色素痣中的表达 MMP-2在MM组织中阳性表达率为80.8%(42/52),色素痣为 10%(2/20),二者差异有统计学意义(χ2=30.440,P<0.01),见表 1,图 1A;MMP-9 在 MM 组织中阳性表达率为 76.9%(40/52),色素痣为 15%(3/20),二者差异有统计学意义(χ2=23.025,P<0.01),见表 1,图1B。
2.2 MMP-2和MMP-9在MM中表达率的差异性 MM中组织中MMP-2和MMP-9双阳性表达为34例,双阴性为4例,配对四格表资料比较二者在MM中的表达率差异无统计学意义(χ2=0.07,P>0.05),见表2。
2.3 将性别、年龄、MMP-2、MMP-9进行多变量Cox回归分析,结果显示只进行了MMP-2和MMP-9两步回归,说明年龄和性别与MM生存时间无明显相关性;MMP-2(B=1.879)、MMP-9(B=1.489)阳性二者的回归系数 B>0,MMP-2(HR=6.546,95%置信区间为 1.543~27.774)、MMP-9(HR=4.434,95%置信区间为1.623~12.114)蛋白阳性二者的风险比HR>1,说明二者是威胁MM患者死亡的危险因素;在MMP-9表达相同的情况下,MMP-2表达会使MM患者死亡率提高6.564倍;在MMP-9表达相同的情况下,MMP-2表达会使MM患者死亡率提高4.434倍,见表3。
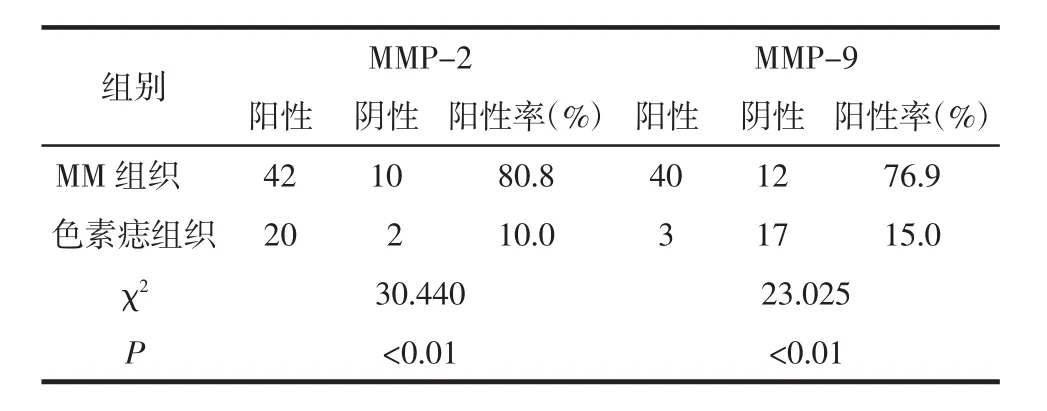
表1 MMP-2、MMP-9在MM及色素痣组织中的表达情况

图1B MMP-9在MM组织中的表达

表2 MMP-2和MMP-9在MM中表达的差异 例
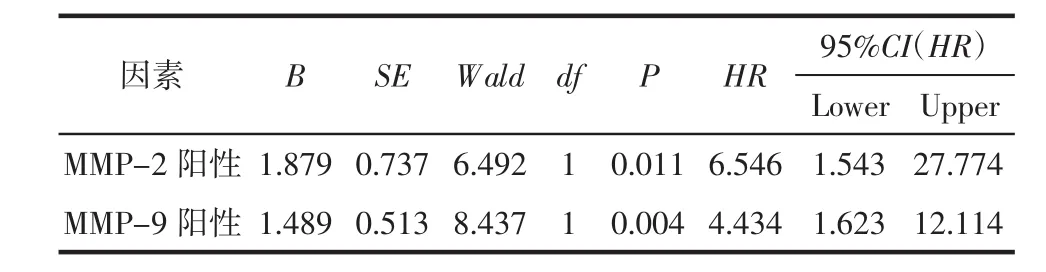
表3 MMP-2、MMP-9与MM患者预后的多变量Cox回归分析
2.4 单因素Kaplan-Meier法分析显示MMP-2阳性表达的MM患者的生存期显著低于阴性者(均P=0.004),生存曲线如图 2A;同样,MMP-9 阳性表达的MM患者的生存期也显著低于阴性者(均P<0.001),生存曲线如图 2B。
3 讨论
MMP-2和MMP-9是2个重要的金属蛋白酶超家族成员,参与广泛的蛋白水解事件,包括肿瘤生长,迁移,转移和血管生成。You等[5]研究显示MMP通过降解细胞外基质从而促进MM细胞的侵袭和转移。本研究显示,在MM组中MMP-2表达率(80.8%)、MMP-9表达率(76.9%)均明显高于色素痣组(P<0.01),提示二者在MM病情发展中发挥着重要作用,这与国内万慧颖等[6]研究报道相一致。但导致基质金属蛋白酶高表达的原因尚无明确报道。国外Preisner等[7]的体外研究表明来源于人类脂肪组织的干细胞可使MMP尤其是MMP-2的表达水平增加,但真正在MM患者体内有怎样的分子生物学变化,现在还不得而知。本实验结果显示MMP-2和MMP-9双阳性表达的病例数高达30例(50.69%),应用配对四格表资料的χ2检验分析其二者在MM中表达的阳性率差异无统计学意义,这不能排除二者之间表达是否有相关性。Jiang等[8]的研究发现乳腺癌细胞通过FAK/Akt/ERK和NF-κB信号通路下调MMP-2/-9的表达。但文献尚无报道二者在基因及分子水平表达过程中是否有交叉。此外,本研究应用多因素逐步Cox相关分析,排除年龄及性别因素后,发现MMP-2与MMP-9是影响MM患者预后的独立危险因素,而且在MMP-9表达相同的情况下,MMP-2表达会使MM患者死亡率提高6.564倍;在MMP-9表达相同的情况下,MMP-2表达会使MM患者死亡率提高4.434倍。而且单因素分析显示,MMP-2与MMP-9阳性表达患者的生存期明显短于阴性者,其表达显著增加患者死亡风险,提示MM患者MMP-2和MMP-9的表达水平在评估患者预后中可能有潜在价值,有望成为临床医师评估患者预后的重要指标。本研究样本量偏小,今后需要更大的数据去验证本次实验结果的准确性。另一方面,病例资料全部来源于黑龙江省,因MM发病有遗传因素[9],所以本实验研究不能排除基因易感性造成的偏倚,而且变量较少,应收集更多资料,多因素分析,从而增强预后评估的准确性。
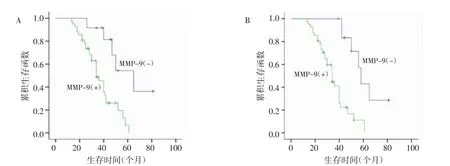
图2 MMP-2、MMP-9生存率曲线
通过本次研究,笔者发现MMP-2及MMP-9在MM组织中高表达,且二者是影响MM患者预后的独立危险因素。Ahmad等[10]研究报道了肾癌患者MMP-2、MMP-9血清学的变化可以用作早期疾病诊断的生物标志物,也可用于监测疾病复发。所以下一步计划应用前瞻性研究,收集MM以及色素痣患者术前、术后MMP-2、MMP-9血清学数据,分析其用作早期疾病诊断以及监测疾病复发的可行性;继续深入探究MMP高表达的原因及途径有望为治疗MM提供新的思路及靶点。

