清肺透邪方对肺炎支原体肺炎小鼠Notch信号通路的影响
魏巍, 王雪峰, 吴振起, 岳志军, 张秀英, 王子,张童, 李庆焕, 赫昊, 邱功瀚, 杨东睿
(1.辽宁中医药大学,辽宁沈阳 110032;2.辽宁中医药大学附属医院,辽宁沈阳 110032;3.石家庄医学高等专科学校,河北石家庄 050599)
风温之邪首见于《温病条辨》,其是因冬季气候异常,应寒反暖,或春季气候晴燥,温风过暖,形成风热之邪而发生温病。病邪从口鼻、皮毛侵犯肺卫,若邪热入里,则见邪热壅肺、热结胃肠及气分热盛证,亦可逆传心包,入营入血或损伤肝肾之阴[1]。导师王雪峰教授在临床上发现肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)的发病特点、感邪途径及病程与风温发病相似,病理变化及临床表现过程与风温之邪致病过程相符,认为其病机为风温之邪内伏于肺,肺气闭塞,肺失宣肃,肺络受损,进而确立了清肺透邪之法,拟清肺透邪方,取得明显疗效。在本课题组前期研究中证实,清肺透邪方可以有效调控MPP 小鼠Th17/Treg 细胞以及IL-17、IL-10 因子的表达,减轻其炎症反应[2]。
研究表明,MPP 与肺炎支原体呼吸道上皮的粘附、肺炎支原体的直接损伤或间接损伤、呼吸窘迫综合征(CARDS)毒素等引起的细胞损伤、免疫功能损害机制密切相关。其中免疫发病机制与T淋巴细胞关系密切。Notch 信号通路是调控胚胎发育和多种成体组织器官体内稳态和细胞分化的重要信号途径,同时参与多种免疫细胞功能的调控[3],于哺乳动物各类免疫细胞内广泛表达,尤其在T淋巴细胞发育与分化中发挥重要作用。已有相关研究证实MPP 患儿外周血中Notch1 受体mRNA表达高于健康儿童[4]。本研究以Notch 通路为切入点,观察MPP小鼠肺组织Notch受体的蛋白及基因表达,探讨清肺透邪方的作用机制,为临床治疗MPP 提供新思路及理论依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物及饲养SPF级BALB/c小鼠144只,4 ~6 周龄,雌雄各半,体质量(20±3)g,购自辽宁中医药大学实验动物中心,许可证号:SCXX(辽)2015-0001。饲料及垫料均购自辽宁长生生物技术有限公司。在辽宁中医药大学病毒实验室,室温20 ~22 ℃,湿度(50 ± 2)%,12 h/12 h 明暗周期的环境下分笼饲养。每日更换垫料,提供充足的水和饲料。
1.2 实验药物及制备清肺透邪方由炙麻黄、石膏、炙桑白皮、黄芩、麦冬、虎杖、苏子、炒杏仁、桔梗等中药组成。中药材均购自辽宁中医药大学附属医院中药局,为江阴颗粒剂。每付中药中加入温水(80 ~90 ℃)77 mL 混匀,使药物浓度达到0.975 g/mL。将阿奇霉素片(利普奇)研磨,用温水将其浓度调整为2.6 mg/mL。
1.3 主要试剂胎牛血清、PPLO培养基(美国BD公司);青霉素(华北制药股份有限公司);二喹啉甲酸(BCA)蛋白定量试剂盒、RIPA 裂解液、苯甲基磺酰氟(PMSF)、十二烷基硫酸钠(SDS)—聚丙烯酰胺凝胶电泳(PAGE)蛋白上样缓冲液(1×)、SDS-PAGE 凝胶配制试剂盒、超敏电化学发光(ECL)试剂盒(上海碧云天公司);聚偏氟乙烯(PVDF)膜(美国Millipore公司);蛋白marker(美国Thermo 公司);羊抗兔二抗(美国Earthox 公司);Notch1 抗 体、Notch2 抗 体、Notch3 抗 体(美 国Abcam 公司);TRIzol、SYBR®Premix EX TaqTMⅡ200 Rxns、RT reagent Kit with gDNA Eraser(Perfect Real Time 100 Rxns,日本TaKaRa公司)。
1. 4 主要仪器及设备EG1150 石蜡包埋机、RM2135 精密转轮切片机、CF16RX11 低温高速离心机、LEIT20-MIL倒置荧光显微镜(德国Leica公司);BX50F4 系统生物显微镜(日本Olympus 公司);ZMN-6802 烘漂处理仪(常州市华利电子公司);A110132酶标仪、Trans-Blot SD 半干转印系统(美国Bio-Rad 公司);FlourChem Q 蛋白印记成像系统(美国ProteinSimple 公司);DNA测序仪(美国ABI 公司);DU-600 蛋白核酸分析仪(美国Bechman 公司);PE-9600 聚合酶链反应(PCR)仪(美国Perkin Elmer公司);LCII实时荧光定量PCR仪(瑞士罗氏公司);EPS-300 电泳仪及天能凝胶分析系统(上海天能科技有限公司)。
1. 5 肺炎支原体毒株及培养肺炎支原体标准株,由辽宁中医药大学附属医院儿科吴振起主任提供,冻存于辽宁中医药大学附属医院病毒室。将解冻的肺炎支原体接种至PPLO培养基中,并在37 ℃,含体积分数5%CO2、饱和氮的厌氧培养箱中孵育,培养液颜色由红变黄时进行连续传代,取第3代。以培养基由红色变为黄色时的最高稀释度作为颜色改变单位(colour change unite,CCU),取菌液浓度1×107CCU/mL 备用。
1.6 MPP小鼠模型构建方法先将小鼠放置于含乙醚的麻醉缸中,待小鼠麻醉后取出,然后左手抓住小鼠的耳颈部及背部皮肤,使其头部上扬腹部朝上,右手持微量加样枪向小鼠鼻腔缓慢接种肺炎支原体菌株,剂量为100 μL/只,连续接种3 d,并观察7 d,建立MPP小鼠模型。造模方法参考前期相关研究[5]。
1. 7 分组与给药将144 只幼龄BALB/c 小鼠按照随机数字表随机分为6组,分别为正常组,模型组,西药组,中药大、中、小剂量组,每组24只。造模结束后,西药组小鼠给予阿奇霉素片(剂量为2.6 mg/mL)灌胃5 d,5 d后继续灌胃等体积生理盐水,中药组大、中、小剂量组分别予清肺透邪方颗粒剂(剂量分别为1.950 0、0.975 0、0.487 5 g/mL)灌胃,正常组与模型组小鼠给予等体积生理盐水灌胃。均每次0.2 mL,每日1次灌胃。共灌胃14 d。
1.8 观察指标与方法
1. 8. 1 取材 各组实验小鼠分别于给药后第3、7、10、14天断颈处死取材,每组每个时间点各取6 只,处死前4 h 禁食禁水。用体积分数为75%的酒精喷洒消毒小鼠后,在无菌操作台上用眼科剪子沿前正中线剪开腹、胸部皮肤,使其胸腔充分暴露,取出整个肺组织。将取出的肺组织用无菌生理盐水洗净表面血迹,用滤纸吸干残留水分,将小鼠右侧肺叶放入40 g/L多聚甲醛标本瓶中4 ℃冰箱保存,用于病理切片苏木素—伊红(HE)染色;左侧肺叶放入EP 管中暂存于-80 ℃冰箱,用于PCR及蛋白免疫印迹(Western Blot)检测。
1. 8. 2 小鼠肺组织HE 染色与病理学评分 将40 g/L 多聚甲醛固定的肺组织进行常规石蜡包埋,切片,HE 染色,在光学显微镜下观察肺组织病理学改变。并采用组织病理学评分系统[6]来评价,每张切片通过5个分类评价系统(细支气管/支气管腔周围浸润的数目、细支气管/支气管腔周围浸润的程度、细支气管/支气管腔内渗出的严重度、血管周围浸润的频度、实质性肺炎的严重度)合并后进行评分。
1.8.3 Western Blot法检测肺组织Notch1、Notch2、Notch3 蛋白表达 用总蛋白提取试剂提取总蛋白,离心取上清液,-20 ℃冰箱中保存。BCA 蛋白定量试剂盒测定蛋白浓度,用蒸馏水调整到统一浓度,提取液中加入5×SDS 上样缓冲液,100 ℃变性10 min,蛋白上样,10% SDS- PAGE 分离,转膜30 min,2% BSA 室温封闭2 h。一抗室温孵育2 h,4 ℃过 夜,TBST 每 次10 min 洗 膜(3次),二抗室温孵育1 h,TBST 每次10 min 洗膜(3次)。ECL 发光,应用Fluor Chem Q 凝胶成像系统采像、数据分析。
1.8.4 定量逆转录聚合酶链反应(qRT-PCR)法检测肺组织Notch1、Notch2、Notch3 mRNA表达 取肺组织制备细胞悬液,用TRIzol 提取细胞总RNA,分析RNA 的纯度及完整性。检测RNA 质量合格后,进行反转录,以反转录产物为模板,加入待测指标的引物,进行qRT-PCR 检测。各引物由北京六合华大基因合成。Notch1上游引物序列为5’-GAGGGTTTCAAAGTGTCAGA-3’,下游引物序列为5’-CTCAGGTCAGGGAGAACTAC-3’,扩增长度213 bp。Notch2 上游引物序列为5’-GATGC AAATGCCCAGGAC-3’,下游引物序列为5’-TGG AGGGCAGATTTTCCA-3’,扩增长度261 bp。Notch3上游引物序列为5’-CTTGGGAAATCTGCCTTAC-3’,下游引物序列为5’-CCAAGTGATCTGTGATCTCC-3’,扩增长度183 bp。GAPDH 上游引物序列为5’-GGCATTGTGGAAGGGCTCAT-3’,下游引物序列为5’-GGCAGCACCAGTGGATGCAG-3’,扩增长度181 bp。
1.9 统计方法采用SPSS 20.0统计软件进行数据处理,计量资料以均数±标准差(±s) 表示,各组病理评分比较采用秩和检验,不同时间点不同组别的Notch 含量比较采用重复测量的方差分析,组间两两比较采用LSD方法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般状态比较正常组:一般情况好,毛发有光泽,无竖毛,活动自如,进食及排便正常,体质量增长正常。模型组:从造模第3天开始部分小鼠出现较为明显的症状,主要表现为精神萎靡,活动减少,竖毛无光泽,喜蜷缩,呼吸短促,进食及排便减少,体质量增长速度减慢。西药组、中药大、中剂量组:给药3 d后,小鼠症状均有不同程度的改善,活动增多,毛发光泽较前改善,呼吸平稳,进食及排便增加。中药小剂量组一般状态与模型组相比,变化不大。
2.2 各组小鼠肺组织病理变化比较图1 结果显示:模型组气管管壁及周围间质充血,肺泡、肺泡囊、肺泡隔等结构不完整,肺泡间隔增厚,周围炎细胞浸润,毛细血管扩张,符合肺炎表现,西药组、中药大、中剂量组肺部炎症症状较轻,肺泡结构相对完整,肺组织实变不明显,轻度肺间质水肿,仅有少量炎性细胞浸润和少量分泌物。中药小剂量组肺泡结构较完整,中度肺组织淤血、水肿,在细支气管和血管周边见有中等量淋巴细胞、浆细胞、中性粒细胞等浸润。
2.3 各组小鼠肺组织病理学评分比较表1 结果显示:与正常组比较,模型组小鼠肺组织病理学总分显著增高(P <0.01),中药大、中、小剂量组和西药组小鼠肺组织病理学总分显著降低(P <0.05或P <0.01),且中药大剂量组效果更明显。
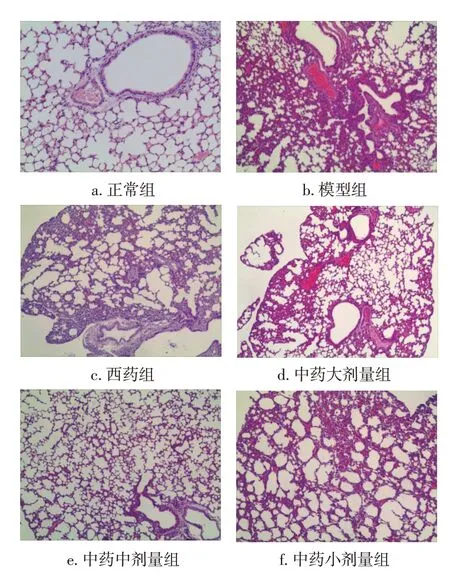
图1 各组小鼠肺组织病理变化比较(HE染色,×40)Figure 1 Comparison of the pathological features of lung tissues in mice of various groups(by HE staining,×40)
表1 各组小鼠肺组织病理评分比较Table 1 Comparison of the scores of pathological features of lung tissues in mice of various groups (±s,s/分)
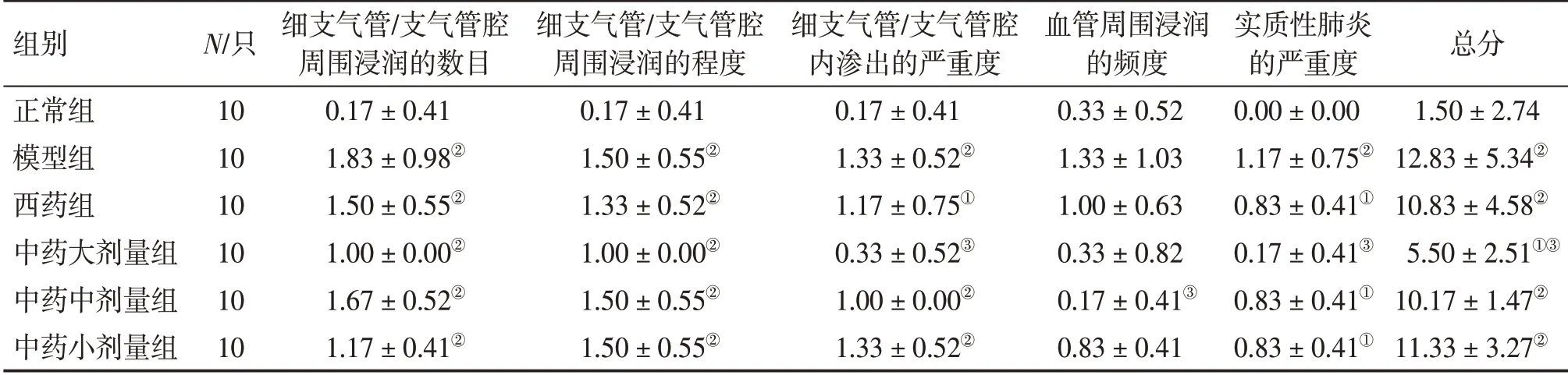
表1 各组小鼠肺组织病理评分比较Table 1 Comparison of the scores of pathological features of lung tissues in mice of various groups (±s,s/分)
①P <0.05,②P <0.01,与正常组比较;③P <0.05,与模型组比较
组别正常组模型组西药组中药大剂量组中药中剂量组中药小剂量组N/只10 10 10 10 10 10细支气管/支气管腔周围浸润的数目0.17±0.41 1.83±0.98②1.50±0.55②1.00±0.00②1.67±0.52②1.17±0.41②细支气管/支气管腔周围浸润的程度0.17±0.41 1.50±0.55②1.33±0.52②1.00±0.00②1.50±0.55②1.50±0.55②细支气管/支气管腔内渗出的严重度0.17±0.41 1.33±0.52②1.17±0.75①0.33±0.52③1.00±0.00②1.33±0.52②血管周围浸润的频度0.33±0.52 1.33±1.03 1.00±0.63 0.33±0.82 0.17±0.41③0.83±0.41实质性肺炎的严重度0.00±0.00 1.17±0.75②0.83±0.41①0.17±0.41③0.83±0.41①0.83±0.41①总分1.50±2.74 12.83±5.34②10.83±4.58②5.50±2.51①③10.17±1.47②11.33±3.27②
其中,模型组小鼠肺组织细支气管/支气管腔周围浸润的数目、细支气管/支气管腔周围浸润的程度、细支气管/支气管腔内渗出的严重度、血管周围浸润的频度、实质性肺炎的严重度较正常组显著增加(P <0.01),中药大剂量组小鼠肺组织细支气管/支气管腔内渗出的严重度与实质性肺炎的严重度较模型组显著降低(P <0.05)。
2. 4 各组小鼠肺组织Notch1、Notch2、Notch3 的蛋白相对含量比较图2 及表2 ~4 结果显示:肺炎支原体感染后,与正常组比较,模型组小鼠肺组织中Notch1、Notch2 的蛋白相对含量明显增高(P <0.05)。给药第3、7、10、14天,与模型组比较,中药大、中、小剂量组肺组织Notch1、Notch2的蛋白相对含量和西药组Notch2 的蛋白相对含量均降低(P <0.05),其中中药大剂量组效果最明显。各组Notch3 蛋白相对含量比较,差异均无统计学意义(P >0.05)。重复测量比较不同时间点Notch1 蛋白相对含量,差异有统计学意义(P <0.05),且含量与病程长短成正比。
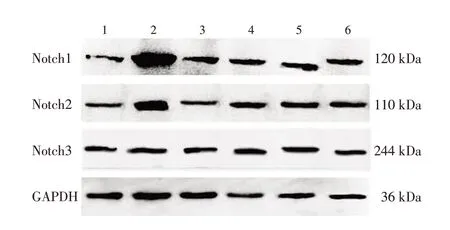
图2 各组小鼠肺组织Notch1、Notch2、Notch3的蛋白表达情况Figure 2 Comparison of the protein expression levels of Notch1,Notch2 and Notch3 in mouse lung tissues of various groups
2. 5 各组小鼠肺组织中Notch1、Notch2、Notch3 mRNA 表达水平比较表5 ~7 结果显示:肺炎支原体感染后,与正常组比较,模型组小鼠肺组织中Notch1、Notch2 mRNA 表达水平明显增高(P <0.05)。给药第3、7、10、14 天,与模型组比较,中药大剂量组Notch1、Notch2 及中药中剂量组和西药组Notch1 mRNA 表达水平显著降低(P <0.05),其中中药大剂量组效果最明显。各组Notch3 mRNA 表达水平比较,差异均无统计学意义(P >0.05)。Notch1、Notch2、Notch3 mRNA表达在重复测量比较中,不同时间点之间差异无统计学意义(P >0.05)。
表2 各组小鼠肺组织Notch1蛋白相对表达水平比较Table 2 Comparison of the relative protein expression level of Notch1 in mouse lung tissues of various groups (±s,p)

表2 各组小鼠肺组织Notch1蛋白相对表达水平比较Table 2 Comparison of the relative protein expression level of Notch1 in mouse lung tissues of various groups (±s,p)
①P <0.05,与正常组比较;②P <0.05,与模型组比较;③P <0.05,与中药大剂量组比较
组别正常组模型组西药组中药大剂量组中药中剂量组中药小剂量组N/只10 10 10 10 10 10给药第3天0.43±0.15 1.52±0.05①0.79±0.08①③0.45±0.12②0.67±0.16①②1.02±0.11①②③给药第7天0.61±0.14 1.54±0.21①0.83±0.16①③0.65±0.12②0.83±0.24①②0.98±0.38①②③给药第10 天0.29±0.08 1.92±0.65①0.82±0.08①③0.97±0.29②0.80±0.15①②1.36±0.26①②③给药第14天0.89±0.05 2.38±0.39①1.00±0.19①③0.92±0.41②1.19±0.55①②1.48±0.30①②③
表3 各组小鼠肺组织Notch2蛋白相对表达水平比较Table 3 Comparison of the relative protein expression level of Notch2 in mouse lung tissues of various groups (±s,p)
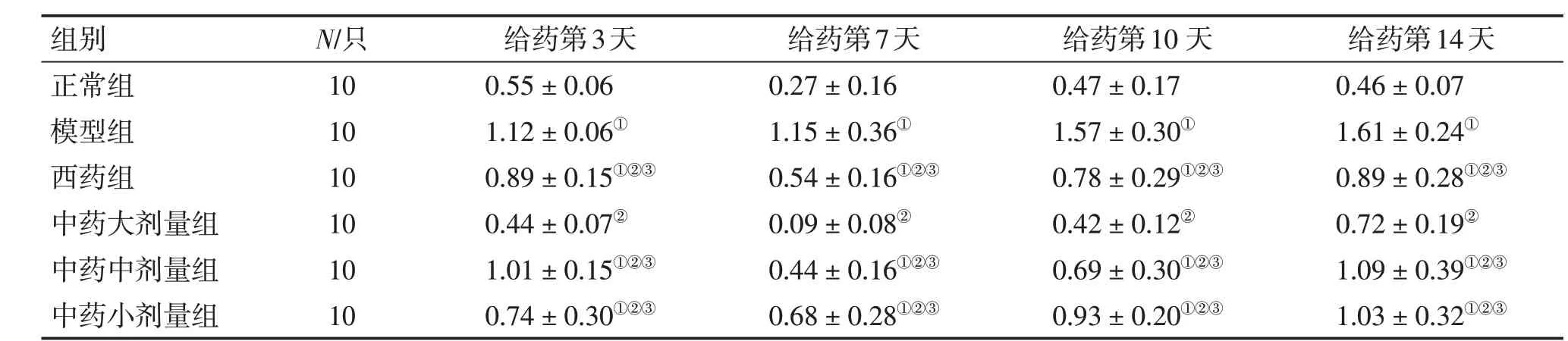
表3 各组小鼠肺组织Notch2蛋白相对表达水平比较Table 3 Comparison of the relative protein expression level of Notch2 in mouse lung tissues of various groups (±s,p)
①P <0.05,与正常组比较;②P <0.05,与模型组比较;③P <0.05,与中药大剂量组比较
组别正常组模型组西药组中药大剂量组中药中剂量组中药小剂量组N/只10 10 10 10 10 10给药第3天0.55±0.06 1.12±0.06①0.89±0.15①②③0.44±0.07②1.01±0.15①②③0.74±0.30①②③给药第7天0.27±0.16 1.15±0.36①0.54±0.16①②③0.09±0.08②0.44±0.16①②③0.68±0.28①②③给药第10 天0.47±0.17 1.57±0.30①0.78±0.29①②③0.42±0.12②0.69±0.30①②③0.93±0.20①②③给药第14天0.46±0.07 1.61±0.24①0.89±0.28①②③0.72±0.19②1.09±0.39①②③1.03±0.32①②③
表4 各组小鼠肺组织Notch3蛋白相对表达水平比较Table 4 Comparison of the relative protein expression level of Notch3 in mouse lung tissues of various groups (±s,p)
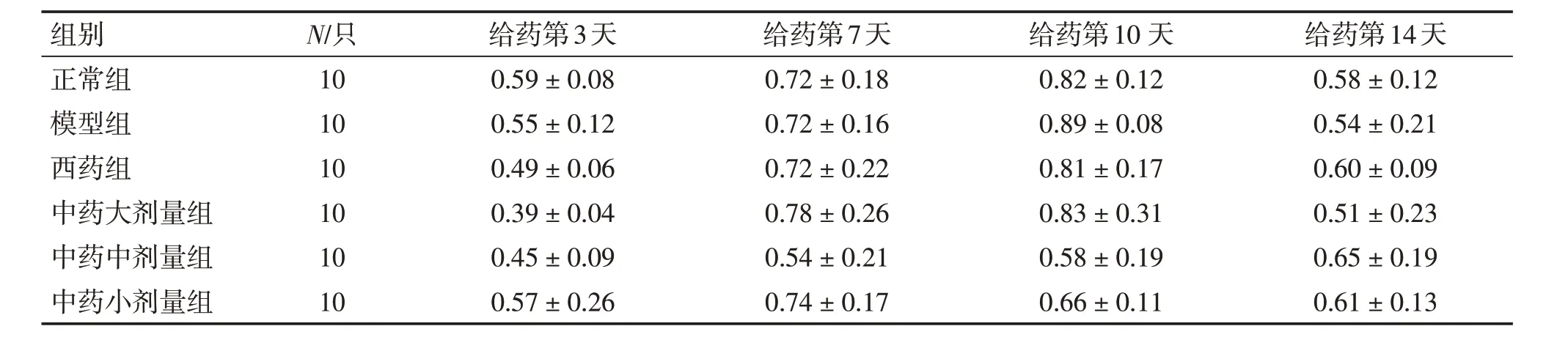
表4 各组小鼠肺组织Notch3蛋白相对表达水平比较Table 4 Comparison of the relative protein expression level of Notch3 in mouse lung tissues of various groups (±s,p)
组别正常组模型组西药组中药大剂量组中药中剂量组中药小剂量组N/只10 10 10 10 10 10给药第3天0.59±0.08 0.55±0.12 0.49±0.06 0.39±0.04 0.45±0.09 0.57±0.26给药第7天0.72±0.18 0.72±0.16 0.72±0.22 0.78±0.26 0.54±0.21 0.74±0.17给药第10 天0.82±0.12 0.89±0.08 0.81±0.17 0.83±0.31 0.58±0.19 0.66±0.11给药第14天0.58±0.12 0.54±0.21 0.60±0.09 0.51±0.23 0.65±0.19 0.61±0.13
表5 各组小鼠肺组织Notch1 mRNA表达水平比较Table 5 Comparison of the mRNA expression level of Notch1 in mouse lung tissues of various groups (±s)
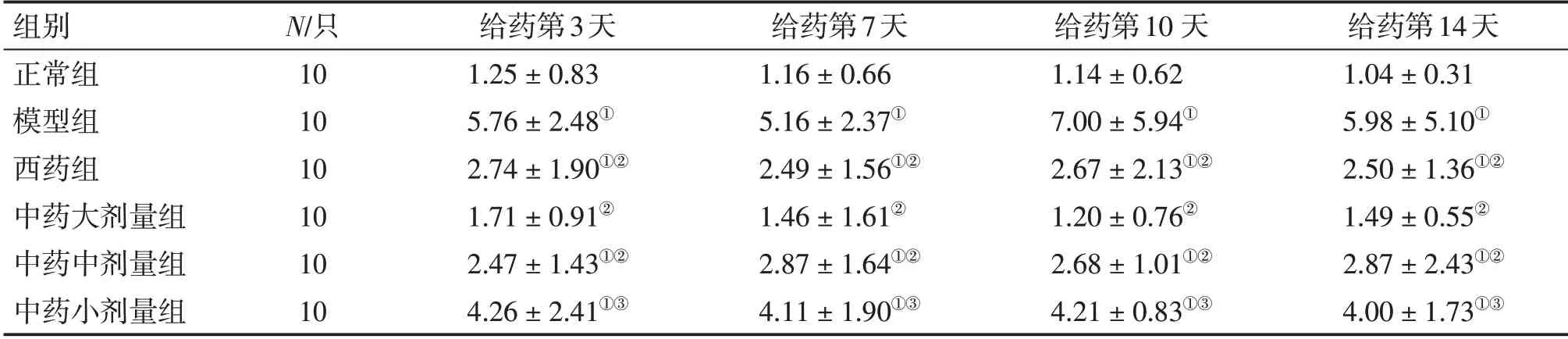
表5 各组小鼠肺组织Notch1 mRNA表达水平比较Table 5 Comparison of the mRNA expression level of Notch1 in mouse lung tissues of various groups (±s)
①P <0.05,与正常组比较;②P <0.05,与模型组比较;③P <0.05,与中药大剂量组比较
组别正常组模型组西药组中药大剂量组中药中剂量组中药小剂量组N/只10 10 10 10 10 10给药第3天1.25±0.83 5.76±2.48①2.74±1.90①②1.71±0.91②2.47±1.43①②4.26±2.41①③给药第7天1.16±0.66 5.16±2.37①2.49±1.56①②1.46±1.61②2.87±1.64①②4.11±1.90①③给药第10 天1.14±0.62 7.00±5.94①2.67±2.13①②1.20±0.76②2.68±1.01①②4.21±0.83①③给药第14天1.04±0.31 5.98±5.10①2.50±1.36①②1.49±0.55②2.87±2.43①②4.00±1.73①③
表6 各组小鼠肺组织中Notch2 mRNA表达水平比较Table 6 Comparison of the mRNA expression level of Notch2 in mouse lung tissues of various groups (±s)
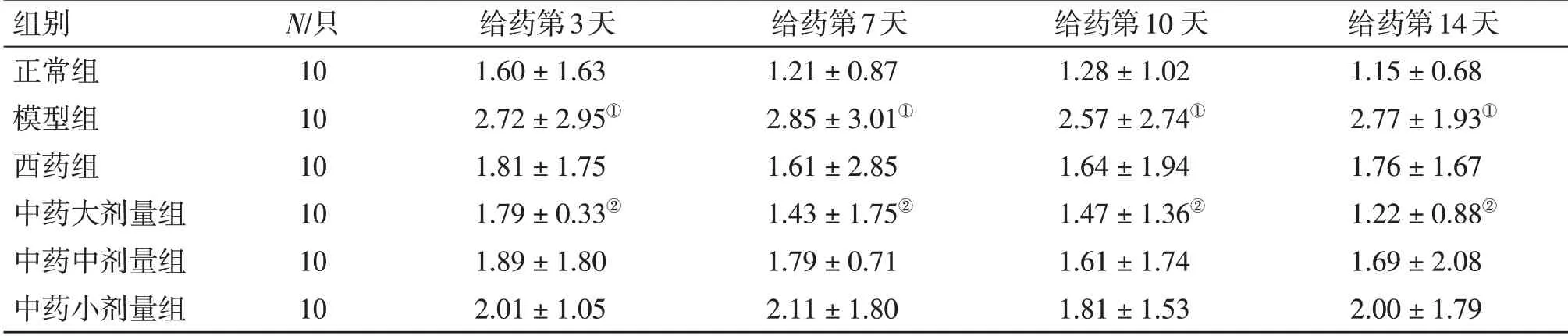
表6 各组小鼠肺组织中Notch2 mRNA表达水平比较Table 6 Comparison of the mRNA expression level of Notch2 in mouse lung tissues of various groups (±s)
①P <0.05,与正常组比较;②P <0.05,与模型组比较
组别正常组模型组西药组中药大剂量组中药中剂量组中药小剂量组N/只10 10 10 10 10 10给药第3天1.60±1.63 2.72±2.95①1.81±1.75 1.79±0.33②1.89±1.80 2.01±1.05给药第7天1.21±0.87 2.85±3.01①1.61±2.85 1.43±1.75②1.79±0.71 2.11±1.80给药第10 天1.28±1.02 2.57±2.74①1.64±1.94 1.47±1.36②1.61±1.74 1.81±1.53给药第14天1.15±0.68 2.77±1.93①1.76±1.67 1.22±0.88②1.69±2.08 2.00±1.79
表7 各组小鼠肺组织中Notch3 mRNA表达水平比较Table 7 Comparison of the mRNA expression level of Notch3 in mouse lung tissues of various groups (±s)
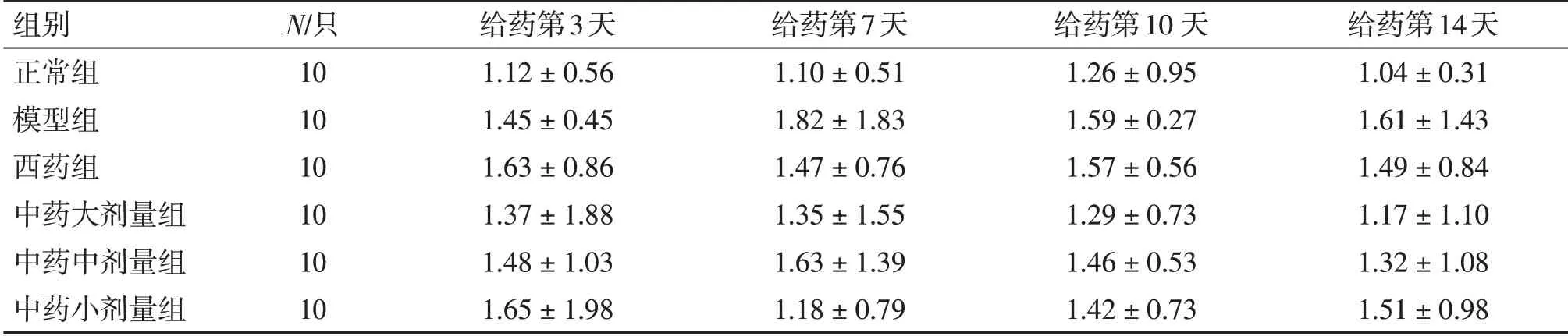
表7 各组小鼠肺组织中Notch3 mRNA表达水平比较Table 7 Comparison of the mRNA expression level of Notch3 in mouse lung tissues of various groups (±s)
组别正常组模型组西药组中药大剂量组中药中剂量组中药小剂量组N/只10 10 10 10 10 10给药第3天1.12±0.56 1.45±0.45 1.63±0.86 1.37±1.88 1.48±1.03 1.65±1.98给药第7天1.10±0.51 1.82±1.83 1.47±0.76 1.35±1.55 1.63±1.39 1.18±0.79给药第10 天1.26±0.95 1.59±0.27 1.57±0.56 1.29±0.73 1.46±0.53 1.42±0.73给药第14天1.04±0.31 1.61±1.43 1.49±0.84 1.17±1.10 1.32±1.08 1.51±0.98
3 讨论
肺炎支原体肺炎(MPP)是一种儿童常见的病程长、病情重、易反复发作的肺部疾病,可以出现多系统的肺外并发症,累及心血管、神经、消化、血液、肌肉骨骼等多个系统[7],使病程延长,病情加重,甚至死亡。中医学并无“肺炎支原体”之说,而是将其引起的MPP 纳入“喘嗽”的范畴[8],认为其主要的病因病机为外邪侵袭肺卫,肺失宣降,肺卫郁闭,导致肺气上逆,从而表现出发热、咳嗽、气促、喉间痰鸣等症状[9]。因其具有一定的流行性和传染性,中医又将其归为“温病”的范畴[10]。
王雪峰教授根据MPP 致病特点、感邪途径、病程,以“清解肺热,开闭透邪”为治则拟定清肺透邪方。该方以麻黄、石膏、桑白皮、黄芩共为君药,桑白皮、黄芩、石膏清解肺胃之热,麻黄开闭透邪,清中寓透,透中有清,使邪热得出,风温之邪得解;以麦冬、虎杖共为臣药,虎杖止咳化痰,活血化瘀,既入气分又可入血分,兼有清气凉血活血之长,同时能利小便通肠腑,导湿热痰火下趋,麦冬清肺生津,使肺热清而不伤阴;杏仁、苏子降气共为佐药,气降则热自消,桔梗载诸药上行为使,一上一下,使肺气通而咳喘止。本方清透与清润并用,透邪与通络并举,以清肺透邪为主,共同发挥止咳退热的功效。
本研究成功地对肺炎支原体进行传代并构建出MPP小鼠模型。结果显示,模型组从造模第3天开始部分小鼠出现较为明显的MPP 症状,经药物干预后,西药组、中药大剂量组、中药中剂量组小鼠MPP 症状均有不同程度的改善,表明阿奇霉素、清肺透邪方对MPP 有明显疗效,且清肺透邪方疗效呈时间、剂量依赖性。
Notch 信号通路主要包括4 种受体(Notch1、Notch2、Notch3、Notch4)和5 种 配 体(Jagged1、Jagged2、Delta1、Delta3、Delta4)[11],主要在正常机体的细胞识别、凋亡、增殖和分化中起重要作用。目前,发现其在细胞免疫及呼吸道疾病中也发挥了重要作用[12],可影响免疫细胞的分化发育,主要针对T 淋巴细胞,参与抗原呈递细胞介导的免疫应答[13-14],调节Th1/Th2、Th1/Th7 的平衡[12]。不同的Notch 信号传导可能指导不同的Th 细胞增殖。Notch3 和Delta1/4 配体相互作用有助于向Th1的发育[15-17],Notch1 受体和Notch2 受体在与Jagged配体作用后可诱导Th2 细胞发育[18-20]。研究表明Notch1 直接与RORγt 和IL-17 启动子结合并调节Th17 分 化[21]。MPP 的 发 病 与Th1/Th2 失 衡、Treg/Th17失衡密切相关,而Notch通路对MPP的发病有重要意义[4,22]。本研究结果显示,模型组小鼠肺组织Notch1、Notch2蛋白及mRNA表达水平均较正常组不同程度地上调,中药大、中剂量组和西药组均可有效降低Notch1、Notch2蛋白及mRNA表达水平,且清肺透邪方疗效呈时间、剂量依赖性。但Notch3 各组分布差异不显著,其具体机制尚待进一步深入研究。
综上所述,清肺透邪方可抗肺炎支原体感染,其机制可能与抑制Notch 信号通路中Notch1、Notch2的表达从而调控免疫平衡有关。

