磁共振与乳腺钼靶检查对乳腺癌的影像学诊断价值比较研究
四川省宝石花医院放射科(四川 成都 610213)
凌 洪
乳腺癌是女性常见的恶性肿瘤之一,近年来我国乳腺癌发病率逐渐升高,且发病年龄越来越趋向于年轻化[1]。乳腺癌发病隐匿且预后较差,据统计,全球范围内每年约有120余万女性患乳腺癌,且约有50万妇女死于乳腺癌,迄今为止,尚没有有效的一级预防措施控制乳腺癌的发病,早发现、早治疗是乳腺癌治疗的关键,对降低患者死亡率,提高生存率具有重要意义[2]。医学影像学技术是乳腺癌征象以及病灶检测的主要手段,钼靶X线摄影技术(Mammary gland molybdenum target,MG)操作方便简单,可显示肿块的大小、形态、密度和内部结构等,在微钙化检测中具有独特的优势[3]。近年来磁共振成像(Magnetic Resonance Imaging,MRI)也越来越广泛应用于乳腺癌的鉴别和诊断中,其无辐射损伤,对软组织具有高分辨率,可多参数、多方位进行成像,观察病变血流灌注情况[4]。本研究分析90例乳腺肿块患者MRI与MG诊断结果,并以病理诊断结果为金标准,对比MRI与MG在乳腺癌中的诊断效能,报告如下。
1 资料与方法
1.1 一般资料 回顾性分析我院2015年7月至2018年9月收治的90例乳腺肿块患者临床资料,年龄34~78岁,平均(53.75±6.54)岁;发生于左乳49例,右乳41例;病理诊断结果显示90例患者共90个病灶,其中恶性52例(乳腺浸润性导管癌39例,导管原位癌10,黏液癌2例,髓样癌1例),良性38例(纤维瘤23例,乳腺腺病11例,导管内乳头状瘤2例,浆细胞性乳腺炎1例,脂肪坏死结节1例)。
1.2 纳入标准 (1)通过普通超声检查发现乳腺肿物,伴随局部的腺体紊乱或无肿块微钙化现象;(2)患者年龄18~80岁;(3)女性;(4)乳腺完整且无破溃、红肿和化脓等症状;(5)通过术后病理结果证实。(6)临床资料完整。
1.3 排除标准 (1)乳腺肿物突出于患者皮肤表面;(2)乳腺表面的皮肤存在破溃或化脓现象;(3)具有乳腺假体患者;(4)影像学或病理检查前通过抗肿瘤先期化疗患者;(5)妊娠或哺乳期患者;(6)影像学图像资料不清晰,影响结果判断。
1.4 检查方法
1.4.1 MG检查:使用Siemens Mammomat数字化乳腺钼靶X射线系统,胶片距为65cm,焦点为0.5,以乳腺IP板采集数字信号,通过柯达6580激光相机打印。患者取站立位或坐位,调整影台以及加压器,将乳房组织压扁,保证有足够的射线可均匀地透过患者乳房组织。常规取患者双侧乳房的轴位及侧位片,增加病变切线和斜位及局部放大相,观察患者乳腺病灶的位置、大小、边缘、形态以及密度及钙化情况。
1.4.2 MRI检查:通过GE EXCITE HD 1.5T超导MRI扫描仪以及乳腺专用的相控阵表面线圈。检查时患者取俯卧位,双乳自然下垂悬于线圈洞穴内,首先进行常规T1WI和抑脂T2WI扫描,T1WI参数设置为TR=4.9ms,TE=2.0ms,翻转角=12°,T2WI扫描通过精准频率反转恢复,TR=3500ms,TE=90ms,视野260mm×320mm,回波链长度为19,层间距为0.3mm,层厚3mm,矩阵346×300。动态增强扫描:于注药前进行平扫1次,通过高压注射器经患者肘静脉快速团注钆喷替酸葡甲胺(Gd-DTPA),对比剂用量为0.1mmol/kg,注射完毕后继而快速注射生理盐水20ml,以快速梯度回波序列进行动态增强MRI扫描,参数设置为TR=5ms,TE=2.3ms,翻转角=15°,平均次数为1,矩阵300×320,视野300mm×320mm,层厚设置为1mm。
1.5 图像处理方法:MRI图像后处理于Aurora后处理工作站完成,自动获得减影图像和伪彩图像,制作时间-信号-强度曲线(TIC),选取任意期相进行多平面的重组(MPR),于同一个界面观察冠状位、矢状位和轴位的图像,并进行评估。MG图像分析指标包括病灶的数目、形态、病灶边缘、密度、含脂肪密度、钙化情况以及是否存在扭曲和局灶性不对称等变化。所有影像学资料诊断均由两名具有高年资的诊断医师达成一致意见后确定,当出现意见不同时,则由第三名高年资诊断医师进行图像分析后确定诊断结果。
1.6 统计学方法:采用SPSS22.0统计学软件进行数据分析,计数资料比较通过χ2检验,以穿刺或术后病理检验结果为金标准,计算MRIS与MG对乳腺肿块诊断效能,P<0.05表示差异有统计学意义。
2 结 果
2.1 MRI与MG乳腺肿块检出情况比较 MRI共检测出乳腺良性肿块43例,恶性肿块47例,MG共检测出乳腺良性肿块45例,恶性肿块45例,两种检测方法恶性肿块检出情况比较差异无统计学意义(P>0.05)。见表1。
2.2 MRI与MG乳腺肿块诊断效能比较 MRI乳腺肿块良恶性诊断敏感度80.77%,特异度81.58%,准确度81.11%,阳性预测值85.71%,阴性预测值75.61%高于MG乳腺肿块良恶性诊断敏感度59.62%,特异度63.16%,准确度61.11%,阳性预测值68.89%,阴性预测值53.53%,差异有统计学意义(P<0.05)。见表2。
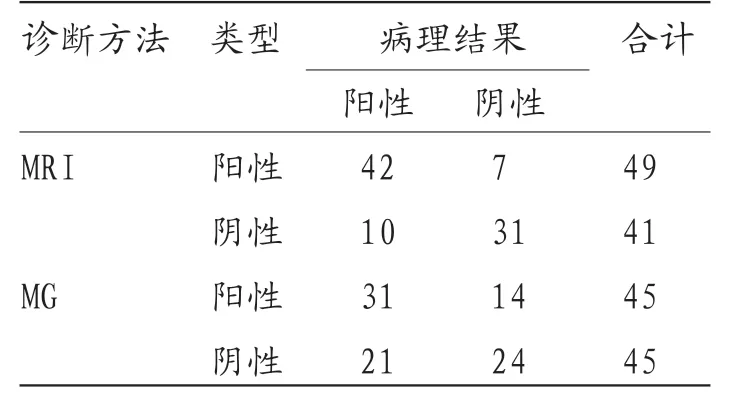
表1 ABVS与MG乳腺肿块检出情况比较

表2 MRI与MG乳腺肿块诊断效能比较
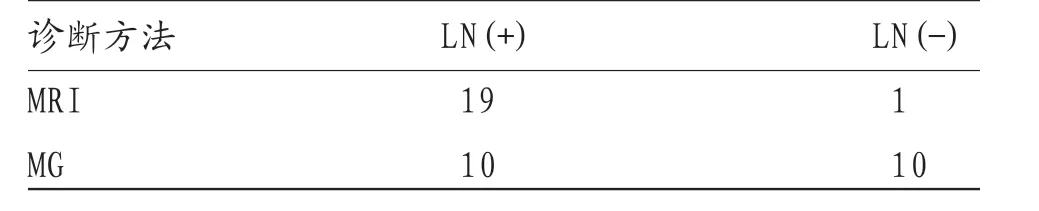
表3 MRI与MG诊断乳腺癌患侧腋窝淋巴结转移结果比较

图1 MG图像,显示患者右乳未见确切肿块影或钙化灶;图2 为MRI动态增强扫描图像显示右乳内下条状强化灶;图3 为MIP显示右乳内下节段性强化病灶;图4 为镜下显示导管上皮异型增生,导管充实,中央坏死细胞核浆比大,且多见核分裂。
2.3 MRI与MG评价乳腺癌病变范围大小 MG诊断31例真阳性患者中,有2例患者由于钼靶片仅出现恶性钙化而未见钙化影,因此共发现29个乳腺癌病灶,术前诊断肿瘤大小为(1.73±0.79)cm小于术后病理诊断(2.49±0.66)c m , 差异有统计学意义( P<0.05);MRI诊断42例真阳性患者中,术前诊断肿瘤大小为(2.40±0.75)cm与术后病理结果(2.45±0.81)cm,比较差异无统计学意义(P>0.05)。
2.4 MRI与MG诊断乳腺癌患侧腋窝淋巴结转移结果比较 经病理诊断52例乳腺癌患者中共有20例伴患侧腋窝淋巴结转移,MRI诊断淋巴结准确性为95.00%高于MG诊断淋巴结转移准确性为50.00%,差异有统计学意义(P<0.05)。见表3。
2.5 病例分析 患者女性,75岁,已绝经,由于右乳肿块入院,确诊为右乳腺癌,进行右乳癌改良格根治术,术后病理结果显示为右乳导管内癌Ⅱ级,肿瘤大小3.1×2.3×1.2cm,未累及乳头皮肤和胸肌筋膜,腋窝淋巴结为0/16,前哨淋巴结转移2/3。见图1-4。
3 讨 论
据2011年美国肿瘤协会统计显示乳腺癌为女性常见癌症,新发病例数占所有女性癌症患者的30%,死亡率仅次于肺癌[5]。许多患者发现乳腺癌时已经是疾病晚期,错失治疗良机,早期对乳腺疾病进行正确诊断对患者的治疗和预防具有重要意义。
随着现代影像学技术和影像学设备的发展,极大程度地丰富和改善了影像学诊断手段与方法。乳腺X线摄影曾被认为是检测乳腺癌的首选检查方法,可检出以钙化点为主要表现的钙化病灶影,能够发现波长较小,超声未能显示的病灶,而MG相对于普通的X线摄影,大幅度降低了X线照射剂量,有效减少患者辐射损伤,有利于疾病的早期诊断[6]。然而对于腺体较为致密的患者,MG诊断敏感性降低,对多灶癌发现能力有限,检测出浸润性小叶癌能力不足,具有一定的局限性[7]。 MRI具有较强的软组织分辨力,其动态增强扫描检查对乳腺癌的诊断具有较高的敏感性及特异性,MRI实现了多平面多参数成像的目标,其三维成像使病灶定位更为准确和直观,对于乳腺高位和深位病灶显示良好,同时对于多中心和多灶性病变、临近胸壁的侵犯以及淋巴结转移显示较为敏感,为乳腺癌的分期及治疗提供了可靠依据,在疾病确诊、肿瘤范围评估以及疗效评价中具有重要作用[8-9]。然而MRI也有一定的局限性,比如价格相对较为昂贵、操作过程较为复杂且检查时间较长,同时其影像易受到呼吸心脏搏动伪影影响[10]。
本研究以病理结果作为金标准,发现MRI判断乳腺肿块良恶性效能明显高于MG,表明在乳腺疾病诊断中,MRI相对MG具有一定的优势。沈恩超等[11]研究结果显示MG检测对于脂肪性腺体病变敏感性较高,但对于致密性腺体内的病变显示率较低。同时MG无法准确鉴别病变术后病灶是疤痕还是复发,而MRI多方位多序列立体成像,不受致密型腺体影响[12]。本研究中MRI诊断仍有10例乳腺癌患者出现漏诊情况,这可能是由于MRI不能发现微小的钙化,而细小针尖样以及砂砾样钙化是乳腺癌的主要征象之一,据研究结果表明大约有4%-11%的乳腺癌患者,钙化是其唯一的诊断依据,而钼靶摄影则可显示出1.6mm以上的所有钙化[13]。因此后期进一步研究过程中,可结合使用MRI与MG对乳腺肿块进行判定,以期提高乳腺癌检出率。
薛晨晖等[14]研究中发现MRI在病灶大小评价方面相对于MG具有明显的优势,本研究中MRI 检测病灶大小与术后病理结果无明显差异,而MG检测病灶大小相对于术后病理结果明显偏小,与其研究结果一致,这主要是由于MRI 的高软组织分辨力,其可清晰显示乳腺癌组织向周围浸润实质成分[15]。 MRI检测结果与病理分期结果更为接近,有利于治疗方案的制定。本研究分析对比两种检测方法对于淋巴结转移的判断情况,MG只能显示部分腋下淋巴结,同时对于乳腺内部转移性淋巴结显示不佳,而MRI对于乳腺癌腋下和乳内淋巴结转移的检出率均较高。
综上所述,MRI诊断乳腺癌效能高于MG,对乳腺癌病灶大小的判断更接近于术后病理诊断,判断淋巴结转移准确率高。
——献礼新中国成立70周年
——献礼新中国成立70周年

