水杨酸钠致耳鸣大鼠下丘GDNF的表达*
周爽 廖华 王文静 杨琨 汪雷 杨希林
研究显示听觉通路的任何部位,包括蜗神经、听神经或中枢听觉传导通路等的异常均可导致耳鸣[1]。下丘作为一个中脑结构,将绝大多数呈递的听觉信息和物质整合到听觉皮层,也参与到耳鸣的发生发展及持续过程中[2]。下丘内多巴胺水平的显著性降低可能与水杨酸钠所诱导的耳鸣产生有关。既往有学者研究显示,噪声刺激下耳蜗内多巴胺含量降低;还有研究显示长时间强噪声暴露下大鼠脑内多巴胺的含量也是降低的[3,4]。新近研究表明多巴胺能通路可能参与了耳鸣情感调控,多巴胺能药物能提高丘脑感觉信号放电,同时耳蜗内多巴胺有抑制作用,可能参与早期耳鸣形成[5]。
胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor,GDNF) 是神经营养因子中的一种,也是一种蛋白质,GDNF是中脑多巴胺能神经元发育、存活和维持的重要生长因子,它对中枢和外周神经系统的运动神经元和其他神经元亚群有很强的存活作用[6]。此外,GDNF对于神经细胞的增殖、迁移和分化是必不可少的,如海马神经元轴突生长、海马和皮层神经元突触的形成等;GDNF 在全身各种组织中均有表达,在脑组织中广泛分布,通过其受体复合物介导生物学效应[7]。RET是一种原癌基因,当其与细胞外信号分子家族的GDNF结合时,可引起RET蛋白受体磷酸化并使RET进入激活状态,致其下游信号通路激活。GDNF可通过与其受体RET结合后,激活PI3激酶/Akt(PI3K/Akt)途径,从而有效调控内源性神经干细胞的增殖、分化与迁移[8]。然而下丘内GDNF及其介导的信号通路是否参与耳鸣发生发展过程尚未见报道。本研究拟探讨GDNF及其介导的信号通路在慢性水杨酸钠注射致耳鸣大鼠下丘中的作用及可能机制。
1 材料与方法
1.1实验动物及分组 8周龄SPF级健康雄性SD大鼠(维通利华公司,北京)24只,体重180~250 g,耳郭反应灵敏,无强噪声暴露及耳毒性药物使用史。适应性喂养1周后,随机分为4组:急性组(AS组,水杨酸钠200 mg/kg腹腔单次注射)、慢性组(SS组,水杨酸钠200 mg/kg腹腔注射,每天2次、两次注射时间间隔大于8小时,持续14天)、恢复组(RS组,注射方式及时间同SS组,14天注射完毕后停止,并继续正常喂养14天)、对照组(NS组,腹腔注射等量生理盐水,注射剂量、方式及时间同SS组),每组6只;水杨酸钠购于上海Sigma-Aldrich 公司,以生理盐水溶解为100 g/L溶液。
1.2听觉惊跳反射前刺激抑制试验(gap-prepulse inhibition of the acoustic startle reflex,GPIAS)[9]对照组、慢性组在第15天上午(距末次给药间隔大于8小时)、急性组在单次给药后8小时、恢复组在注射完毕后第15天上午分别行GPIAS检测,检测各组大鼠是否有耳鸣样行为,所有大鼠在检测前均禁食8小时。
检测前,先将大鼠置于透明有孔的树脂玻璃制动物固定装置内,限制其活动,然后将其放入载有敏感压电转换器的隔音箱内(MED-ASRPRO1,美国MED公司);声刺激信号由TDT(RZ6,美国Tucker Davis Technologies公司)产生,通过悬挂在固定器侧方10 cm的高频喇叭传出。当动物发生惊跳反射后,身体的重力改变会通过压电传感器传入系统,产生相应波形,并自动记录和计算峰值。GPIAS实验中不同时程的间隙空白插在刺激噪声前100 ms,刺激噪声为100 dB SPL的白噪声,上升/下降时间5 ms,持续时间50 ms,背景噪声为65 dB SPL的3个不同频率(6、12、16 kHz)纯音。实验间隔为30~35 s,以避免前面刺激产生的不应期而影响动物对后面刺激的反应;无间隙空白的实验与上述顺序一样,间隙空白设为0 ms;每只大鼠实验时间约为30 min。GPIAS主要检测指标是前刺激抑制率(%),表示听觉惊跳反射间隔前刺激对惊跳反射的抑制程度,公式为GPIAS% =(1-gap/no gap)×100%,其中gap表示有间隙空白作为前刺激时诱发的波幅,no gap表示没有空白仅有惊跳刺激时所诱发的波幅。
1.3各组动物下丘组织取材 各组大鼠分别完成GPIAS检测后,断头处死并迅速分离下丘,立即置于液氮中,并转移至-80 ℃冰箱中保存。
1.4Western Blot 法检测各组动物下丘GDNF、RET、P-PI3K p85α、P-AKT蛋白表达量 组织块用预冷的PBS缓冲液漂洗2~3次,去除血污,剪成小块置于匀浆器中;加入10倍于组织体积的组织蛋白提取试剂,冰浴彻底匀浆。将匀浆液转移至离心管中,振荡,冰浴30 min,期间用移液器反复吹打,确保匀浆液完全裂解;4 ℃ 12 000 rpm离心5 min,收集上清液,即为总蛋白溶液,使用BCA蛋白质浓度测定试剂盒检测样品蛋白浓度。Western blot检测蛋白定量,分别用8%分离胶和5%浓缩胶、10%分离胶和5%浓缩胶进行电泳,于PVDF膜上进行转膜,5%脱脂奶粉室温封闭1小时,分别用GAPDH多克隆抗体(稀释度1∶10 000,abcam)、GDNF多克隆抗体(稀释度1∶1 000,abcam)、RET多克隆抗体(稀释度1∶1 000,abcam)P-PI3K p85α多克隆抗体(稀释度1∶500,abcam)、P-AKT多克隆抗体(稀释度1∶1 000,CST)进行4 ℃过夜孵育;TBST洗涤3次,每次10分钟,用山羊抗兔多克隆荧光二抗(稀释度1∶10 000,KPL)室温孵育1小时,TBST洗涤3次,每次10分钟,根据不同的光强度调整曝光条件,显影、定影,将胶片进行扫描存档,用AlphaEaseFC软件处理系统分析目标带的光密度值。
1.5荧光定量PCR(RT-qPCR)检测各组动物下丘GDNF、RET、PI3K、AKT1 mRNA表达量 采用Trizol法分别提取总RNA,紫外分光检测其浓度纯度。第一链cDNA的合成采用EntiLinkTM1st Strand cDNA Synthesis Kit试剂盒进行(ELK Biotechnology,EQ003),在Life technologies公司的StepOneTMReal-Time PCR仪上完成实时荧光定量PCR,每个样品均作3个复孔,使用EnTurboTMSYBR Green PCR SuperMix试剂盒进行(ELK Biotechnology,EQ001)。引物与探针的设计与合成 在Genbank数据库中查找大鼠GDNF、RET、PI3K、AKT1基因序列,使用primer 5.0软件设计大鼠目的基因及内参,见表1。

表1 引物与探针的设计与合成
1.6统计学方法 采用SPSS19.0统计学软件进行分析,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠GPIAS结果 与对照组相比,SS组大鼠GPIAS值在12和16 kHz明显下降,差异有统计学意义(P<0.05),说明SS组大鼠出现耳鸣样行为,耳鸣模型建立成功。AS组和RS组各频率GPIAS值差异均无统计学意义(P>0.05),说明单次注射水杨酸钠未引起大鼠耳鸣样行为,而大鼠耳鸣样行为在停止水杨酸钠注射14天后消失(表2)。
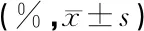
表2 四组大鼠不同频率纯音背景声下的GPIAS值
注:*与同频率其他组比较,P<0.05
2.2Western Blot法检测四组动物下丘GDNF、RET、P-PI3K p85α、P-AKT蛋白表达 与其他组大鼠相比较,SS组大鼠下丘GDNF、RET、P-PI3K p85α、P-AKT蛋白表达量均降低,差异有统计学意义(P<0.05)(表3)。

表3 各组大鼠下丘GDNF、RET、P-PI3K p85α、P-AKT蛋白表达水平的比较 (n=6)
注:*与NS组比较,P<0.05;△与RS组比较,P<0.05
2.3RT-qPCR法检测四组动物下丘GDNF、RET、PI3K、AKT1 mRNA表达 与其他三组相比,SS组大鼠下丘GDNF、RET、PI3K、AKT1mRNA表达量均降低,差异有统计学意义(P<0.05)(表4)。

表4 各组大鼠GDNF、RET、PI3K、AKT1 mRNA表达水平的比较(n=6)
注:*与NS组比较,P<0.05;#与AS组比较,P<0.05;▲与RS组比较,P<0.05
3 讨论
目前常用的耳鸣行为学模型为听觉惊跳反射刺激前抑制试验(GPIAS)[9]。本研究通过对大鼠行慢性腹腔注射水杨酸钠,运用GPIAS试验验证其发生了耳鸣样行为,说明成功建立了大鼠耳鸣模型。
耳鸣发生机制的复杂性决定了对其治疗的困难程度[10],因此,对于耳鸣发病机制的研究具有重要意义。耳鸣的病变部位包括外周和中枢,听觉通路的任何部位异常均可能导致耳鸣[11]。下丘在上行听觉通路中几乎是强制性转换器,几乎涵盖了所有丘系和外侧丘系上行传入信息[2]。因此,下丘中的病理生理变化几乎可以改变听觉感知的所有方面,下丘被推定为构成主观耳鸣中心机制的重要结构[12]。研究显示耳鸣大鼠下丘内多巴胺水平显著降低,多巴胺能通路可能参与了耳鸣的情感调控,多巴胺能药物可提升丘脑内感觉信号放电[13]。体内外实验均证明GDNF对多巴胺能神经元有高度亲和力,是多巴胺能神经元高度特异性神经营养因子,对其有明显的营养、支持、保护和分化作用,使神经元胞体增大,可诱导其轴突出芽和重建[13],且对黑质、纹状体多巴胺能系统亦具有保护和修复作用。GDNF通过二聚体的形式与受体GFRα结合后触发其与跨膜蛋白Ret结合,并引起Ret活化,形成GDNF/GFRα/Ret复合物[14],从而引起特异性底物磷酸化,介导激活细胞内信号转导通路。GDNF结合受体后可介导PI3K/Akt信号通路并对其基因表达产生影响,在PI3K/Akt信号通路中,PI3K激活后,在质膜上产生第二信使PIP2,PIP2磷酸化成为PIP3,再由PIP3与细胞内信号蛋白Akt结合,使Akt活化,活化的Akt通过磷酸化作用进一步激活下游的mTOR信号通路,最终实现基因表达,并起到神经营养、支持、保护和分化作用[14]。
本研究结果表明,SS组大鼠下丘GDNF及其受体RET,P-PI3K p85α、P-AKT蛋白表达量较其他组大鼠均降低,提示长期慢性水杨酸钠注射可引起GDNF表达量降低,导致其受体RET磷酸化减少,激活态降低,从而抑制其下游PI3K/Akt信号通路,GDNF、RET、PI3K、AKT1 mRNA表达量亦减少,最终导致GDNF神经营养作用受抑制,多巴胺能神经元发育、存活和维持受抑制。本研究中,GPIAS检测结果表明AS组、RS组大鼠均未引出耳鸣样行为,但AS组、RS组大鼠下丘GDNF及其下游受体各蛋白、mRNA表达量较NS组均显著降低,推测水杨酸钠急性注射AS组大鼠可引起GDNF蛋白及mRNA表达量降低,但单次注射不足以引起耳鸣实质性病理生理的改变;而RS组大鼠随水杨酸钠注射停止,GDNF及其下游受体蛋白表达量逐渐回升,耳鸣样行为随GDNF及其下游受体对机体的保护作用增强而消失;此结果也证实了GDNF对于耳鸣的抑制作用。
综上所述,水杨酸钠所致耳鸣大鼠通过抑制GDNF表达,抑制其受体RET的活化,从而抑制其下游PI3K/Akt信号通路,抑制了下丘及下丘内多巴胺能神经元的神经营养作用,从而在耳鸣的发生发展中起重要作用。因此,通过进一步研究GDNF激动剂对水杨酸钠所致耳鸣大鼠中下丘内GDNF及其下游信号通路的影响,可更加深入探究下丘中GDNF对耳鸣发生发展及持续的作用机制,从而为临床治疗耳鸣提供新的方向。

