甲状腺结节钙化的超声分类表现及钙化与病理组织学结果的关系*
王 羽,王文利,张晓东
1.厦门市第一医院超声科,福建 厦门 361003;2.厦门长庚医院超声科,福建 厦门 361028
甲状腺结节是常见的临床疾病,高频超声检出率达19%~68%[1],钙化是甲状腺结节超声检查中很常见的一种表现,不同类型的钙化其发生率各不相同[2]。甲状腺结节钙化与甲状腺癌有一定的相关性,但钙化的分类方法差异较大[3],标准并不统一[4],本研究旨在探讨甲状腺结节内钙化的超声分类表现及钙化与病理组织学结果的关系。
1 资料与方法
1.1 一般资料
收集于2016年6月—2018年5月间厦门市第一医院接收的手术治疗491例甲状腺患者的甲状腺结节共665个,其中甲状腺单侧结节261个,双侧结节398个,峡部结节6个;单发结节210个,多发结节455个。491例患者中男79例,女412例,年龄15~71岁,平均年龄(37.5±22.1)岁。所有患者术前均行彩色多普勒超声检查(彩超检查)显示对应结节,所有结节均行手术切除治疗,术后均行病理组织学检查,回顾性分析病理组织学检查结果与术前钙化结节的超声声像图表现及它们之间的关系。
1.2 仪器与方法
使用Toshiba Aplio 500型和GE Logiq E9型彩色多普勒超声诊断仪,线阵探头频率为7.5 MHz~12 MHz。患者仰卧位,采用直接法进行甲状腺彩色多普勒超声扫查,按照厦门市甲状腺超声检查规范指南(2016版)的要求留取甲状腺结节的图像,重点观察记录甲状腺结节的大小、形态及结节内钙化的有无及其大小、数目、形态、分布、位置等,观察双侧颈部淋巴结的声像图表现,注意淋巴结内是否有钙化及钙化的声像图表现。
甲状腺结节钙化根据声像图表现,参考Kobayashi K[5]的方法进行改良分类,根据大小、形态、区域分为六种超声类型:Ⅰ型:微钙化(点状<1 mm);Ⅱ型:小钙化(斑点状≥1 mm,<2 mm);Ⅲ型:不规则粗大钙化(斑块状≥2 mm);Ⅳ型:规则粗大钙化(圆形、椭圆形、弧形或蛋壳样≥2 mm);Ⅴ型:实质内(非结节内)微钙化(<1 mm);Ⅵ型:混合型钙化(Ⅰ型~Ⅳ型中两种或者两种以上类型)。
根据病理组织学检查结果,分析比较各种甲状腺结节的良恶性钙化发生情况,对各种超声类型的钙化发生率进行分析及比较。
1.3 统计学方法
数据采用IBM SPSS 24.0软件进行统计分析,计数资料以例数和百分比(%)表示,比较行Pearson χ2检验,当期望值小于10时采用Yates’连续校正法,期望值小于5时采用Fisher精确检验,以P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺结节各种病理组织学类型及钙化超声检出结果
病理组织学检查结果显示665个甲状腺结节中,良性439个(66.0%),恶性226个(34.0%);473个结节(71.1%)无钙化,192个结节(28.9%)有钙化。有5个结节彩超检查考虑为钙化而病理学检查未见钙化,这5个结节彩超均表现为点状强回声无声影无“彗星尾”征,位于结节内实性区边缘或囊实性交界处;有24个结节病理学检查提示有钙化而彩超检查未提示,彩超提示甲状腺钙化的敏感性为87.5%(168/192),特异性为98.9%(468/473)。不同病理组织学类型的钙化检查结果见表1。
2.2 甲状腺结节钙化的超声类型及在良恶性结节中钙化发生率
良性结节中钙化发生率为17.3%(76/439),恶性结节中钙化发生率为51.3%(116/226),两者差异有统计学意义(P<0.001),可以认为钙化的发生率在恶性结节中比例较高。彩色多普勒超声检查显示部分甲状腺结节的钙化呈多种类型混合出现,即Ⅵ型,此类结节中,良性结节多为以III型为主的混合型结节,而恶性结节多为以Ⅰ型或Ⅱ型为主的混合型钙化。不同钙化类型的甲状腺结节其良恶性比例情况见表2,表中可以看出Ⅰ型和Ⅱ型钙化在良、恶性甲状腺结节中的钙化发生率差异有统计学意义,可以认为Ⅰ型和Ⅱ型钙化在恶性甲状腺结节内发生率比较高(均P<0.001),主要发生在甲状腺乳头状癌中。
2.3 甲状腺周边淋巴结转移及淋巴结钙化超声检出结果
甲状腺引流区颈部淋巴结转移的情况。226个恶性结节患者有798个清扫淋巴结,其中有153个(19.2%)淋巴结有转移,在这153个转移性淋巴结中,Ⅰ型钙化46个,Ⅱ型钙化51个,Ⅲ型钙化17个,Ⅵ型钙化5个,未发现Ⅳ型钙化,未发生钙化的34个。
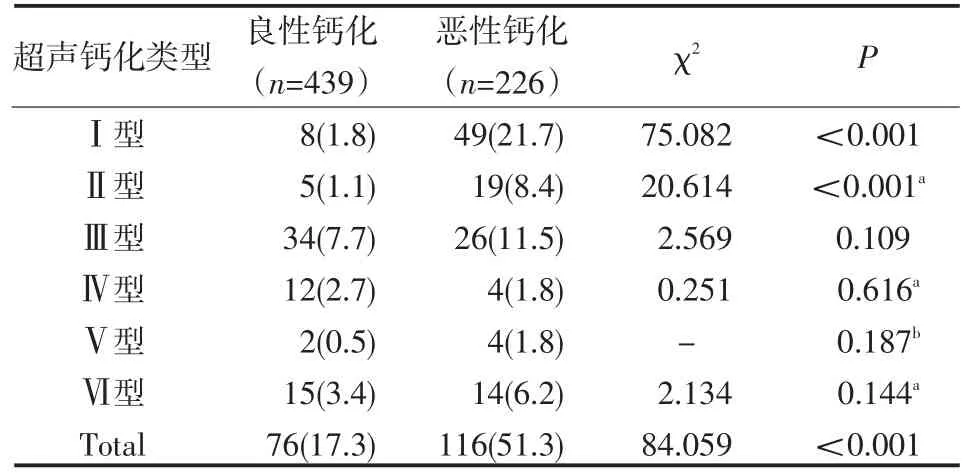
表2 不同甲状腺结节钙化超声类型甲状腺良、恶性结节的发生率比较 例(%)
3 讨论
甲状腺超声检查常可发现钙化,甲状腺结节及实质内[5]均可见多种类型的钙化,随着超声仪器的不断发展进步,超声探头的分辨力不断提高,常规彩超检查诊断甲状腺结节钙化的敏感性和特异性均较高[6-7],本研究中其钙化检查的敏感性为87.5%,特异性为98.9%。由于较小的钙化呈点状,当钙化位于甲状腺结节实性边界处或囊实性交界处,有时难以与甲状腺胶质囊肿形成的浓缩胶质中无“彗星尾”征象的强回声点鉴别,因此存在着一定的假阳性[8],而当强回声点位于实质部位时,钙化的判断往往不容易出错。甲状腺疾病的病理学特征中,砂粒体是最受关注的钙化结构,存在于近50%的甲状腺乳头状癌中[9],砂粒体为微钙化的重要病理基础之一,在200倍的高倍镜视野中,至少含有5个砂粒体才能构成一枚超声可见的微钙化[10],因此必然存在一定程度的病理组织学上的钙化无法被超声检出,超声检出钙化的敏感性必然也受其分辨力的影响[8,11]。
不同研究对于微钙化的大小定义有所不同[12-13],由于超声波的分辨力限制,本研究将微钙化定义为<1 mm的难以测量的点状强回声,而将≥1 mm、<2 mm可测量的最小分辨力定义为小钙化,比较符合实际应用情况,可能更方便于临床描述[14-16]。2017美国放射学会甲状腺影像报告及数据系统(ACR TI-RADS)公布了关于甲状腺结节分类诊断的白皮书[3],ACR TI-RADS从5个特征类别来给予甲状腺结节评分,分值越高其恶性风险越大,其中在钙化评分中分为4个级别评分分别为0分:无或大的彗星尾征;1分:粗钙化;2分: 周边钙化;3分:点状强回声[17-18]。本研究显示了钙化的发生率在恶性结节中比例较高,在更为详尽钙化分型中,提示微钙化和小钙化在恶性结节中发生率比较高,在较大钙化中,钙化的发生率在良恶性结节中差异无统计学意义,这样的结果在某种程度上与ACR TI-RADS白皮书中关于钙化的评分方法是一致的。本研究尚无法评价粗钙化和周边钙化在甲状腺良恶性结节中的发生率比较,这可能与本研究的样本量比较小、资料没有进行随机化研究有关,这有待于以后累积更大样本量后再深入研究验证。
甲状腺结节钙化的确切机制尚不清楚,可能与甲状腺癌的血管及纤维组织增生、钙盐沉积有关[19],也可能是肿瘤本身分泌一些物质如糖蛋白和黏多糖导致钙化[9],这与甲状腺良性疾病形成的结节壁钙化或纤维隔带钙化不同[9,20],因此,甲状腺钙化对于鉴别诊断甲状腺结节良恶性具有重要临床意义,其中甲状腺砂粒体形成的微钙化、小钙化,是甲状腺恶性肿瘤尤其是甲状腺乳头状癌的特征性超声表现之一。

