白鲢肌原纤维结合型丝氨酸蛋白酶单域抗体文本库构建及淘选
周文锦, 屈跃宽, 张 䶮, 林 洪, 隋建新
(中国海洋大学 食品科学与工程学院,山东 青岛266003)
鱼糜制品是我国淡水鱼加工的一个重要的方向,而凝胶劣化是当今影响鱼糜制品质量的主要因素之一[1-3]。 最早日本学者研究发现[4],鱼类肌肉组织中的肌原结合型丝氨酸蛋白酶 (myofibril-bound serine proteinase,MBSP)是鱼糜制品在50~65 ℃下长时间加热而引起凝胶强度下降的主要原因。 MBSP 在一定的温度条件下可降解肌原纤维中的肌球蛋白重链,同时对α-辅肌动蛋白、肌动蛋白和原肌球蛋白产生降解现象。 由于MBSP 广泛存在与鱼类肌肉组织中,鱼糜生产过程中经漂洗也无法去除,严重制约了鱼糜制品行业的发展,目前针对MBSP 抑制的研究主要分两类:1)针对MBSP 所在丝氨酸蛋白酶家族的抑制:如卵清蛋白[5]、动物血浆蛋白[6]、马铃薯淀粉[7]、豆类胰蛋白酶抑制剂[8]等均能显著抑制丝氨酸蛋白酶活性,但由于其成本高、影响鱼糜制品颜色和风味,不利于人体消化吸收等缺陷限制了其在实际生产中的应用;2)针对MBSP 特异性抑制剂:此类抑制剂研究较少, 主要是鱼体内的内源性葡萄糖-6-磷酸异构酶(GPI)对MBSP 的抑制作用[9-11],这些GPI 只对同类鱼的MBSP 具有抑制作用,不具备广谱特异性。 由于MBSP 抑制剂的匮乏,现阶段鱼糜生产大都采用添加谷氨酰胺转氨(TG)酶[12]的方式提高鱼糜制品的凝胶强度, 但TG 酶催化作用对加工条件要求较高,还需要添加非肌肉蛋白共同作用以提高效果,影响了鱼糜本身属性[13]。因此研究开发安全、 高效, 可以在加工过程直接作用于MBSP的新型广谱特异性抑制剂,实现对鱼糜制品凝胶劣化的控制,对整个鱼糜制品产业的发展具有重要的推动作用。
单域抗体(single-domain antibody,sdAbs)是近年来通过基因工程技术,从骆驼科动物和软骨鱼类血清中,克隆获得的仅保留重链可变区且仍具有抗原结合活性的新型抗体[14]。 单域抗体的制备不同于传统抗体,存在单域抗体文本库情况下,通过噬菌体展示技术[15](phage display technology)淘选特异性噬菌粒,通过基因工程对特异性噬菌粒插入的基因进行克隆表达,从而获得特异性抗体分子。 与传统抗体相比,除了能与抗原特异性识别外[16-17],单域抗体最大的优点在于其与抗原物质特异性结合后可直接抑制抗原活性。 根据以上特性,单域抗体用于致病菌的抑制、毒素的中和,蛋白酶活性的抑制等方面已有报道并展现出良好的应用前景。Dolk 等在洗发香波中加入抗糠秕马拉色氏霉菌特异性单域抗体可有效治疗由糠秕马拉色氏霉菌引起的皮下感染[18];Hmila 和Anderson 等筛选出针对蓖麻毒素、肉毒梭菌神经毒素的单域抗体后,不仅可以用于检测还可以用于中和毒素[19];Koch-Nolte F 等从驼源抗体库中淘选得到针对毒素相关胞外酶ART2.2 特异性单域抗体, 能在体内直接抑制ART2.2 细胞毒素与酶活性[20]。
根据单域抗体的以上特性,本文作者旨在建立一个抗MBSP 天然单域抗体文本库,借助噬菌体展示技术,通过MBSP 从文本库中淘选得到特异性噬菌粒, 为下一步获得抗MBSP 单域抗体奠定基础,以此抑制或消除MBSP 的活性,解决现有鱼糜制品凝胶劣化的问题。
1材料与方法
1.1 材料
1.1.1 菌种、 噬菌粒 pHEN2 噬菌粒载体、E.coli TG1、E.coli BL21 (DE3)、pET-28a 质粒均由实验室保存。
1.1.2 主要仪器与试剂 JY88-Ⅱ超声波细胞粉碎机,宁波新芝生物科技股份有限公司产品;Tanon-4200SF凝胶成像及分析系统, 上海天能公司产品;Power Wave XS 酶标仪,美国Biotek 公司产品;HZQ-F280全温振荡培养箱公司产品,太仓市华美生化仪器厂制造。
限制性内切酶 (Nde I、Xho I、Nco I 和Not I):NEB 公司产品;QIAGEN 柱式胶回收纯化试剂盒:QIAGEN 公司产品;兔源抗组氨酸多克隆抗体,HRP标记的山羊抗兔IgG:生工生物工程(上海)股份有限公司产品;Taq DNA 聚合酶、T4 DNA 连接酶:TaKaRa公司产品;卡那霉素、氨苄霉素、异丙基-β-D-硫代半乳糖苷(简称IPTG)、咪唑,北京索莱宝生物技术有限公司产品。 其他常规试剂均为国产分析纯。
自配试剂:2xYT/A100/G2: 含有100 μg/mL 氨苄青霉素和质量分数2%葡萄糖的2xYT 培养基;LB/K30/C34: 含有30 μg/mL 卡那霉素和34 μg/mL氯霉素的LB 培养基;2xYT/A100/G1:含有100 μg/mL氨苄青霉素和质量分数1%葡萄糖的2xYT 培养基;2xYT/A100/K50: 含有100 μg/mL 氨苄青霉素和50 μg/mL 卡 那 霉 素 的2xYT 培 养 基;2xYT/A100/K50/G0.1:含有100 μg/mL 氨苄青霉素和50 μg/mL卡那霉素, 质量分数0.1%葡萄糖的2xYT 培养基;Binding buffer:8 mol/L Urea,50 mmol/L Tris,300 mmol/L NaCl,pH 8.0;Elut ion buffer:8 mol/L Urea,50 mmol/L Tris,300 mmol/L NaCl,20/50/500 mmol/L Imidazole,pH 8.0。
1.2 方法
1.2.1 MBSP 表达载体的构建 鱼体肌肉中的MBSP 与肌原纤维结合紧密且含量低, 直接提取困难,相关研究大都采用重组表达的MBSP[21],本实验根据Gen Bank 数据库中白鲢鱼MBSP 的基因序列(核苷酸序列号为EU661606)预测其理论相对分子质量为2.7×104,并以此为模版设计引物(见表1),PCR 扩增目的基因。
将MBSP 目的基因与载体质粒pET-28a 用限制性内切酶Nde I 和Xho I 双酶切, 纯化双酶切产物,通过T4 连接酶16 ℃过夜连接,利用热击法将重组质粒导入Rosetta(DE3)感受态细胞中,在LB/K30/ C43 固体培养基上筛选阳性克隆单菌落,提取质粒,酶切并测序鉴定。
1.2.2 融合蛋白的诱导表达以及纯化 将鉴定正确的阳性单克隆菌株接种于LB/K30/C34 液体培养基,37 ℃过夜振荡培养, 取100 μL 培养液接种到10 mL 的LB/K30/C34 液体培养基中,37 ℃振荡培养至OD600=0.6,添加终浓度为0.5 mmol/L IPTG 分别在20 ℃过夜和37 ℃下4 h 培养诱导,同时以未加IPTG 的作为阴性对照。
离心收集诱导表达的菌体, 用500 μL PBS(pH 7.4)缓冲液悬浮,超声破碎6 min(超声0.5 s间隔1.5 s),离心收集上清液和沉淀,沉淀用500 μL包涵体溶解液 (8 mol/L Urea,50 mmol/L Tris-HCl,300 mmol/L NaCl,pH 8.0) 溶解,12% SDS-PAGE电泳鉴定表达效果,以此确定最佳的诱导条件。

表1 MBSP 基因扩增所需引物Table 1 Primers of target gene
按照上述确定的最佳条件大量表达重组菌pET 28a-MBSP, 将得到的粗蛋白液进行纯化。 取5 mL Ni-IDA 装柱, 用Binding buffer 清洗平衡柱子,将粗蛋白液过0.22 μm 膜后上柱,收集流出液。用Binding buffer 清洗未结合组分,收集流出液。 用不同浓度的Elution buffer 洗脱,收集流出液。 将收集的流出液进行12%SDS-PAGE 鉴定,确定最佳洗脱条件。将纯化后的蛋白液在含有质量分数0.1% SKL的PBS(pH 7.4)中4 ℃透析16 h,再在PBS(pH 7.4)中透析4 h,离心取上清,测定其浓度,经12%SDS-PAGE和Western blot 鉴定后-80 ℃保存。
1.2.3 鲨鱼免疫与免疫应答分析 称取200 μg MBSP 溶解于0.01 mol/L PBS(pH 7.4)中,与等量的弗氏完全佐剂充分混合后,于成年铰口鲨鱼侧鳍处皮下散点注射,每隔2 周更换弗氏不完全佐剂以同样剂量加强免疫1 次,总共加强免疫3 次,取免疫后鲨鱼血浆进行间接ELISA 分析其对MBSP 的免疫应答情况。
1.2.4 单域抗体文本库的构建与鉴定 鲨鱼免疫应答成功后,提取外周血液淋巴细胞用TRIzol 法提取RNA,逆转录成第一链cDNA,根据引物(表2)扩增鲨鱼新抗原受体 (new or nurse shark antigen receptor,NAR)可变区片段,回收纯化目的片段;将VNAR 片段与载体pHEN2 用Nco I 和Not I 双酶切,经T4 连接酶构建重组噬菌粒,利用电击法将重组噬菌粒pHEN2-VNAR 电转入新鲜制备的感受态大肠杆菌TG1, 梯度稀释后涂步到2xYT/A100/G2固体培养基,计算库容量,随机挑取30 个单菌落进行菌落PCR 鉴定。 刮取培养基上菌落,悬浮于有质量分数15%甘油的2xYT 液体培养基中, 分装-80 ℃保存。

表2 抗体可变区引物Table 2 Primers of target gene
1.2.5 噬菌体展示技术淘选针对MBSP 的特异性噬菌 粒噬菌体展示过程: 将转化菌液接种至2xYT/A100/G2 液体培养基,37 ℃振荡培养至对数生长期,加入M13K07 辅助噬菌体。 37 ℃静置水浴30 min,离心去上清液,用2xYT/A100/K50 液体培养基重悬沉淀,30 ℃振荡过夜培养。离心取上清液,按照4∶1 体积比例加入PEG/NaCl 溶液冰浴至少1 h,离心去上清液并用无菌PBS(pH 7.4)重悬噬菌体沉淀,再次离心去除细菌碎片沉淀,所得上清即得原始噬菌粒文库。
淘选过程: 添加4 mL 的MBSP (PBS 稀释至100 μg/mL)到免疫管中,4 ℃包被过夜。 PBST 洗管后, 用5 mL 含3 g/dL 脱脂奶粉的PBS (MPBS)封闭,37 ℃孵育2 h。 PBST 洗管后, 加入3 mL 的MPBS 和1 mL 原始噬菌粒文本库, 旋转振荡1 h,静置1 h。 弃掉噬菌体文库,PBST 洗管。 用1 mL 的三乙胺(100 mmol/L) 洗脱结合在免疫管上的噬菌粒,并加入0.5 mL 的Tris-HCl(1 mol/L,pH 7.4)中和洗脱液。再加入250 μL 的Tris-HCl(1 mol/L,pH 7.4)溶液于免疫管中,冲洗离心管壁中残留的噬菌体, 合并2 次洗脱噬菌粒溶液, 加入甘油-80 ℃保存。 取750 μL 第1 次洗脱下噬菌粒溶液感染15 mL的TG1 菌液,37 ℃水浴30 min。 取100 μL 梯度稀释后,涂布于2×YT/A100/G2 固体培养基,用于计算滴度。 剩下感染液离心弃上清液,用500 μL 的2×YT 液体培养基悬浮沉淀,涂布于2×YT/A100/G2 固体培养基上,30 ℃过夜培养。
过夜生长后, 向平板中加入5 mL 的2×YT/A100/G2 液体培养基,刮取细菌菌落。 取100 μL 菌液接种于50 mL 的2×TY/A100/G2 液体培养基中,剩余菌液加入甘油-80 ℃保存。 将培养液按照上述噬菌体展示过程操作,得到的噬菌粒溶液即为第1 次淘选噬菌粒文库。 取1 mL 噬菌粒溶液用于下一轮淘选,剩下的加入甘油-80 ℃保存。随后降低包被抗原质量浓度为10、1 μg/mL,分别重复上述淘选过程与噬菌体展示过程,总共进行3 轮淘选。
1.2.6 特异性噬菌粒的多克隆ELISA 鉴定 每孔加100 μL 的MBSP (用PBS 稀释至10 μg/mL)包被96 孔酶标板,4 ℃过夜。 弃包被液,PBST 洗板3次,每孔加入200 μL MPBS,37 ℃封闭2 h。弃封闭液,PBST 洗板3 次,加入100 μL/ 孔MPBS 和10 μL/孔3 轮淘选的噬菌粒文库,37 ℃孵育1 h。PBST 洗板3次,每孔加入100 μL HRP/ anti-M13(用PBS 按1∶5000 稀释),37 ℃孵育1 h。 PBST 洗板3 次,按100 μL/孔加入TMB 显色液,37 ℃孵育10 min 显色,按50 μL/孔加入2 mol/L 硫酸终止反应,酶标仪在450 nm 下读值。 以原始噬菌粒文库作为阴性对照。
1.2.7 特异性噬菌粒的单克隆ELISA 鉴定 单克隆噬菌粒扩增:选择3 轮滴度测定平板,随机挑取96 个单菌落至96 孔细胞培养板, 加入200 μL 2xYT/A100/G2 液体培养基,37 ℃过夜振荡培养。 隔日从培养板每孔取10 μL 菌液转移到新的96 孔细菌培养板对应位置,加入200 μL 的2xYT/A100/G2液体培养基,37 ℃培养2 h。 加入M13K07 辅助噬菌体37 ℃振荡培养至少1 h,离心去上清液,每孔用200 μL 2xYT/A100/K50/G0.1 液体培养基重悬菌液,30 ℃培养过夜。 隔日离心,取上清液。
ELISA 鉴定:每孔加100 μL 的MBSP(用PBS稀释至10 μg/mL) 包被96 孔酶标板,4 ℃过夜。PBST 洗板3 次,每孔加入200 μL MPBS,37 ℃封闭2 h。 PBST 洗板3 次,加入50 μL 的MPBS 和50 μL培养板离心后上清液,37 ℃孵育1 h。 随后步骤与1.2.6 中ELISA 步骤一致,以OD450值是阴性对照的2 倍为标准,挑选阳性噬菌粒。
2结果与分析
2.1 MBSP 最佳诱导条件的确定
经20 ℃和37 ℃诱导表达后,20 ℃诱导条件下没有出现目标蛋白质条带,37 ℃诱导条件下的上清液与沉淀均在2.7×104处均有明显的蛋白质条带,沉淀中的表达量显然多于上清液中,说明目的蛋白质主要以包涵体形式在沉淀中,见图1。为了得到大量的MBSP,选择37 ℃培养4 h 作为诱导表达的条件。
2.2 MBSP 的纯化与鉴定
表达的MBSP 带有his(组氨酸)标签,通过镍离子金属亲和层析柱时能与填料结合,再用高浓度的咪唑洗脱下来。 收集洗脱下的溶液进行SDSPAGE 分析(图2)。由图可见,当咪唑的浓度为500 mmol/L 时,有大量的目的蛋白被洗脱。 将纯化后的MBSP 进行SDS-PAGE 及Western Blot (抗his 标签的兔抗及HRP 标记的羊抗兔抗体)的检测,如图3 所见,得到MBSP 蛋白质。

图2 镍琼脂糖亲和层析纯化SDS-PAGE 分析Fig. 2 Purification of recombinant endolysin by Ni-IDA

图3 纯化后MBSP 蛋白电泳及免疫印迹图Fig. 3 SDS-PAGE and western blot of MBSP
2.3 鲨鱼的免疫应答分析
已有研究证明软骨鱼类与其他下颌脊椎动物有共同的祖先,它们具有包括免疫球蛋白(Ig),T 细胞受体和MHC 的免疫系统。抗原免疫绞口鲨后,会在第一时间产生体液应答,对应的淋巴B 细胞反应产生针对抗原的IgNAR[22]。 如图4 所示,随着铰口鲨的3 次免疫进行, 血浆对MBSP 存在结合反应。这证明MBSP 免疫铰口鲨后,于其体内产生了特异性的抗体。

图4 鲨鱼血清结合反应分析Fig. 4 Analysis of serum binding
2.4 单域抗体文本库的构建与鉴定
噬菌体展示技术常被用于抗体工程中,在噬菌体展示文库中对特定抗原的特异性抗体的筛选。IgNAR 的可变区由于体细胞高突变而高度多样化[23-24],因此已有研究利用铰口鲨、 须鲨(Orectolobusmaculatus)、白斑角鲨(Squalus acanthias)和大星鲨(Mustelus canis)的IgNAR 的可变区,成功构建噬菌体展示文库[25]。 单域抗体文库质量的好坏决定着噬菌体展示能否顺利进行,其质量好坏主要取决于文库库容大小、插入率与文库的多样性。 通过PCR 后电泳结果(图5)显示,30 个单菌落扩增后均得到与插入基因片段大小一致,约400 bp 的产物,说明文本库的正确插入率为100%。 经计算本实验所制备的文库的库容达到4.7×107,达到建库要求(一般为107)。虽然没有深入探究其多样性,但是根据以往研究显示,相对于人工合成库,免疫文库多样性完全能够保障淘选出多样性的抗体,综上所述,得到了一个高质量的针对MBSP 的单域抗体文本库,为接下来的淘选提供了保障。 不仅如此, 鲨鱼的VNAR区和骆驼重链可变区片段(variable domain of heavy chain of heavy-chain antibody,VHH) 虽然都来源于天然存在的重链抗体,但不同于骆驼VHH 结构域,VNAR 结构域与轻链和T 细胞受体比其他的VH结构域更具有相似性和抗原结合能力[26-29]。
2.5 特异性噬菌粒的多克隆ELISA 鉴定
淘选过程是从所制噬菌体展示文库中,固定抗原结合特异性噬菌粒,从而富集特异性单域抗体基因的过程。 为了得到特异性高的噬菌粒,淘选一般进行3 轮,每轮淘选可以纯化约4~10 倍[30]。 淘选过程决定着得到的抗体基因的特异性高低,本文淘选过程采用免疫管代替常用96 孔酶标板, 扩大了淘选的规模,提高了特异性噬菌粒结合的可能性。 间接ELISA 结果显示(图6)相同抗原浓度下,第1 轮淘选后OD450值与阴性对照没有显著差异, 说明噬菌粒结合能力较弱, 但2、3 次淘选后,OD450值明显高于阴性对照, 且3 轮OD450值呈递增趋势, 说明MBSP 结合上的特异性噬菌粒逐渐增多。 这与Jinny L. Liu 等人[31]研究相同,证明伴随淘选过程中抗原浓度的降低,淘选得到的特异性噬菌粒对抗原的结合逐渐增强。

图5 菌落PCR 鉴定初级文库Fig. 5 Colony PCR analyses of randomly picked colonies from NAL
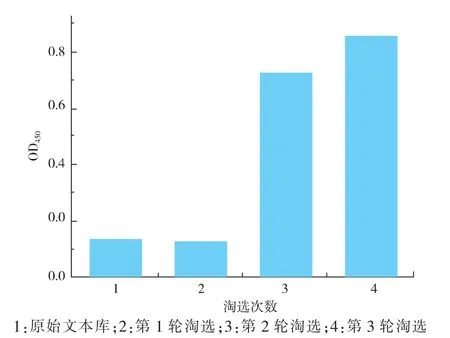
图6 Phage-ELISA 测定噬菌体Fig. 6 Phage-ELISA for amplified phage library from each round of panning
2.6 特异性噬菌粒的单克隆ELISA 鉴定
将MBSP 作为抗原,用间接ELISA 验证96 个噬菌粒的特异性。 以OD450值>阴性对照2 倍(0.4)作为标准,挑选特异性高的噬菌粒,即与抗原结合能力最强的噬菌粒。 由图7 可见,96 个噬菌粒中有31 个OD450值>0.4,阳性率为32.3%,即有31 个对MBSP 有高结合能力的特异性噬菌粒, 为后续分离特异性高的噬菌粒中VNAR 基因,进行表达与纯化,得到针对MBSP 的特异性单域抗体奠定了基础。

图7 Phage-ELISA 测定噬菌体单克隆子Fig. 7 Phage-ELISA for phage clones randomly picked from the panning
3结 语
作者以MBSP 作为抗原免疫铰口鲨,经验证免疫后血浆与抗原具有良好结合反应。 通过PCR 技术从铰口鲨血液淋巴B 细胞中获得单域抗体基因,构建单域抗体文本库。 该免疫文本库通过实验的验证,大小、插入率及多样性良好。 借助噬菌体展示技术,固定MBSP 从单域抗体文本库中淘选出能与其特异性结合的噬菌粒, 为后续快速获得特异性抗MBSP 单域抗体奠定技术与物质基础。 有效扩展了免疫技术的应用范围,又为食品中酶抑制剂的研究开发提供了新思路和新方法。

