经皮胃造瘘术在食管梗阻病人中的应用研究
贾震易, 陈尼维, 朱悦琦, 樊友本, 高 琦, 王志刚
(上海交通大学附属第六人民医院 a.普外科,b.消化内镜中心,c.介入放射科,上海 200233)
食管梗阻病因主要包括食管肿瘤、头颈部肿瘤及食管良性狭窄病变。病人常由于无法进食或进食量急剧下降导致营养状态恶化,严重影响抗肿瘤疗效、生存时间等预后指标。因此,建立合适的肠内营养通道对于开展有效的营养支持及改善临床结局至关重要。传统的置管肠内营养是开腹胃造瘘或空肠造瘘。近年来笔者开展的经皮胃造瘘(percutaneous gastrostomy,PG)使大部分病人不需开腹即可完成置管肠内营养,取得一定疗效。本研究对这一技术进行初步总结,并与传统开腹胃造瘘(open gastrostomy,OG)进行比较,希望为该技术的临床推广提供依据。
资料与方法
一、研究对象
2016年9月至2019年9月,我院食管梗阻病人行胃造瘘术39例。12例PG,男5例,女7例,平均年龄(71.1±11.3)岁;27 例 OG,男 13 例,女 14 例,平均年龄(68.1±7.0)岁。
二、手术方式
PG是在局部麻醉下经口将超细胃镜或单弯导管置入胃内。胃腔注气500~700 mL后,使胃前壁与壁腹膜紧贴。在胃镜或DSA引导下,在左上腹壁确定穿刺部位后插入胃造瘘管(库利艾特医疗株式会社,日本)。球囊注水3~4 mL,联合外垫片固定管道。本研究包含经皮X线引导下胃造瘘(percutaneous radiological gastrostomy,PRG)4例和经皮胃镜胃造瘘 (percutaneous endoscopic gastrostomy,PEG)8例。OG是在全身麻醉或硬膜外麻醉下,通过开腹手术方式放置造瘘管。
三、营养制剂和随访
在医师指导下使用肠内营养制剂“安素”[雅培贸易(上海)有限公司,美国]。两组病人出院后均在外科营养专科门诊随访,监测、处理并发症。每1~2个月测量体重和血清白蛋白,评价营养状况。
四、研究内容
采集研究对象的临床数据,包括一般资料、入院诊断、手术时间、术中出血量、术后疼痛评分(采用视觉模拟评分法评估)(第2、60天)、术后肠内营养启动时间、术后住院时间、术后60 d并发症发生率及术后第60天体重与血清白蛋白。比较两组病人的基线资料和术中、术后指标。
五、统计分析
采用SPSS 23.0软件进行处理。两组计量资料采用均数±标准差。采用t检验比较组间差异。计数资料采用频数(构成比)表示。组间差异采用Fisher精确性检验。所有统计均采用双侧检验。P<0.05为差异有统计学意义。
结 果
一、基线资料
两组病人的年龄、性别、疾病诊断和基线体重与血清白蛋白之间差异无统计学意义(P>0.05)(见表 1)。
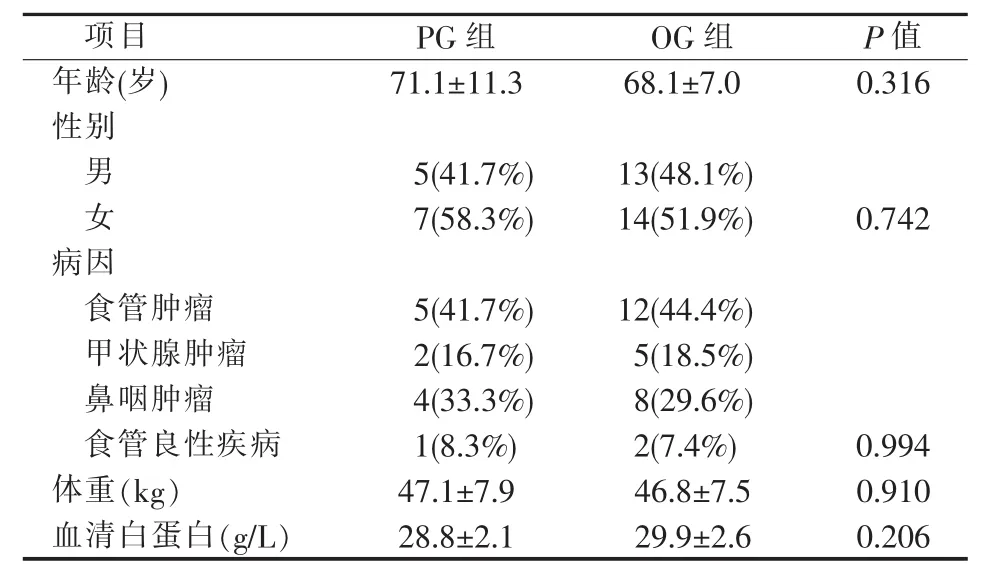
表1 两组基线资料比较
二、术中情况
PG组手术时间和出血量分别为(24.6±9.9)min和(8.8±3.0) mL,均明显低于 OG 组的(61.9±9.1) min(P<0.001)和(26.0±7.8) mL(P<0.001)(见图 1)。

图1 两组病人术中情况比较
三、疼痛评分
PG术后第2、60天疼痛评分分别为1.60±0.50和 0.75±0.50,明显低于 OG术后的 2.3±0.8 (P=0.008)和 2.0±0.5(P<0.001)。 与术后第 2 天比,PG组术后第60天的疼痛评分显著降低(P<0.001),而OG组疼痛评分降低的差异无统计学意义 (P=0.115)(见图 2)。
图2 两组病人术后疼痛比较
四、术后营养启动时间
PG组均在术后24 h内开始肠内营养,平均启动时间为(18.8±4.6)h,OG组则均在术后48 h后开始肠内营养,平均启动时间为(64.3±15.7)h,两组差异有统计学意义(P<0.001)(见图 3)。

图3 两组病人术后情况比较
五、住院时间与并发症
PG 组的术后住院时间为(2.8±1.0)d,明显少于 OG 组的(4.4±1.2) d(P<0.001)(见图 3)。 PG 组有1例(8.3%,1/12)并发症发生,为造瘘口周围感染。OG组有2例失访,余25例中,有6例(24.0%,6/25)并发症发生,2例造瘘口周围感染,2例手术切口感染,1例尿路感染,1例肺部感染,两组相比差异无统计学意义(P=0.389)。
六、术后营养状况
术后第60天PG组体重和血清白蛋白分别为(47.9±7.1) kg 和(30.1±1.6) g/L,与基线即术前相比增加(0.6±0.8) kg和(1.3±0.9) g/L。 OG 组体重和血清白蛋白分别为(46.8±7.5) kg 和(30.0±1.8) g/L,与术前相比增加(0.3±0.7) kg和(-0.1±1.3) g/L。 其中血清白蛋白比较的两组差异有统计学意义(P<0.001)(见图4)。体重增加在两组间差异无统计学意义(P>0.05)。
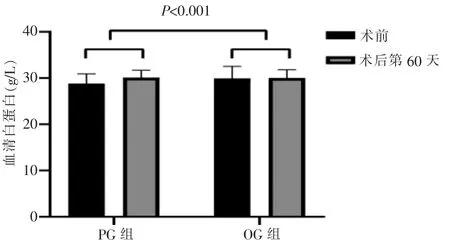
图4 两组病人出院后血清白蛋白比较
讨 论
PG是一项建立肠内营养通路的微创技术,与传统的开腹手术及鼻胃管方式相比有诸多优势,如无需全身麻醉、无需开腹、无口咽部不适感、减少呼吸道感染发生率、可长期放置等[1-2]。该技术根据引导方式的不同分为PEG和PRG,操作手法包括拉出法和插入法。目前,拉出法的PEG技术已在临床普遍应用。有研究显示,对于食管梗阻病人,采用该方法可改善无法行手术切除病人的营养状态和生活质量,提高放、化疗的耐受性和完成率,减轻不良反应并延长生存时间[3-5]。但对于胃镜无法通过食管或无法通过拉出法置管的病人,目前许多单位仍采用OG建立肠内营养通路。
插入法的PEG是中度以上食管梗阻的可选方案,只要超细胃镜进入胃腔即可实施。最近发表的一项临床研究观察该方法在进展期食管肿瘤置管中的应用,并与OG比较。结果显示PEG可显著降低并发症发生率和术后不良事件[6]。2006年,江志伟等[7]在国内率先报道,应用PRG为晚期食管癌及鼻咽癌伴淋巴转移病人建立肠内营养通路。其操作前需先放置超细鼻胃管,与PEG插入法相比,优势并不明显。近年来,随着DSA显影技术的进步,超滑导丝和单弯导管等器材的应用,PRG的适用范围进一步扩大[8]。有研究报道,在神经系统疾病、口咽部肿瘤领域的应用,PRG可有效改善病人营养状况,降低手术风险[9-10]。对于重度食管梗阻病人,只要导丝导管能置入胃腔就可完成置管。
从2018年起,笔者在食管梗阻病人中应用PG置管技术,其中既有因无法手术切除的食管肿瘤、甲状腺肿瘤引起食管中、上段梗阻,也有鼻咽部肿瘤放疗期间或放疗后引起的食管入口梗阻。对于超细胃镜可通过的病人,首选胃镜插入法置管。对于超细胃镜无法通过的重度梗阻病人,选择PRG完成胃造瘘,本研究成功率为100%,平均操作时间(24.6±9.9) min,60 d内仅 1例发生轻度造瘘口感染,经过局部换药及造口护理后痊愈。
本研究将PG与传统OG进行对比。结果显示,PG的微创优势明显,不仅显著减少手术时间和出血量,也减轻了术后第2天的疼痛反应。同时发现由于OG组应用全身麻醉或硬膜外麻醉行开腹手术,对术后肠功能影响大于PG组。临床观察到一些病人术后第1天有腹胀、恶心等消化道症状,因此常规在术后24 h肠内滴注生理盐水500 mL。若无不适,于48 h后启动肠内营养PG组的病人无术后腹胀情况,在排除胃内活动性出血和胃瘘等情况后即启动肠内营养。本研究病人均在24 h内开始肠内营养,明显早于OG。因此,PG组的住院时间也少于对照组。在安全性方面,本研究结果显示PG并不增加术后并发症发生风险,感染并发症发生率略低于OG,与既往研究结果类似。
本研究随访比较两组术后第60天的效果。首先,在疼痛评分方面,PG组较术后第2天进一步降低,而OG组与术后第2天相比则无显著改变。这与PG的伤口较小、造瘘口渗漏较少及并发症发生率较低有关。其次,笔者关注两组的营养指标,发现PG组的血清白蛋白明显增加,而OG组则略有下降,两组差异有统计学意义。而且PG组体重增幅也略高于OG,提示PG的营养支持效果优于OG。推测这一结果是由于OG组较高的感染率和疼痛程度影响了实际的营养摄入量,并导致机体较高的蛋白质分解水平所致。今后通过增加样本量、延长随访时间、调查实际营养摄入量和检测机体蛋白质代谢水平,可进一步验证和阐明这一差异。
综上所述,笔者认为PG安全、有效,可应用于食管梗阻病人肠内营养通路的建立。与传统OG相比,有助于提高病人舒适度、加快康复、改善术后的营养状况和临床疗效。

