老年肌肉衰减症的筛查、评估与干预
孙建琴, 叶梦瑶
(复旦大学附属华东医院临床营养中心,上海 200040)
肌肉衰减症(sarcopenia)是指由一生中不断累积的不良肌肉变化所致肌肉衰减状态,其初期定义由Rosenberg[1]在1989年提出。近10年来,肌肉衰减症的研究成为临床医学的研究热点,国内、外许多学术组织对其定义、筛查评估诊断及干预治疗相继发布了共识及指南。肌肉衰减症常见于老年人、体力活动缺乏者、慢性疾病病人及各种恶性肿瘤病人,与跌倒、失能、生活质量下降、死亡等不良结局风险增加密切相关,并带来高额的医疗费用和经济负担。随着我国人口的老龄化,肌肉衰减症的疾病负担日益加重。因而充分认识肌肉衰减症,开展有效的临床筛查评估并采取积极的防治策略意义重大。本文旨在概述目前肌肉衰减症的筛查诊断流程以及防治策略进展,为其临床管理及进一步研究提供参考。
肌肉衰减症的定义
Rosenberg[1]提出的肌肉衰减症概念狭义地定义为衰老过程中出现的骨骼肌肌量减少。随着研究的深入,其定义也逐步完善。2010年,欧洲老年肌肉衰减症工作组(European Working Group on Sarcopenia in Older People,EWGSOP)发布肌肉衰减症定义及诊断标准共识,将其定义为进行性全身广泛骨骼肌量减少,同时伴有肌力下降和(或)肌肉功能减退的综合征[2]。2018年,EWGSOP对定义和诊断标准进行了更新,强调将低肌力作为肌肉衰减症的关键特征,着重突出肌力在诊断和疾病预后评估中的重要地位[3]。因诊断标准、测量方法及调查人群的差异,不同研究报道的肌肉衰减症患病率从3%到31%不等。年龄越大,伴随的疾病越严重,肌肉衰减症发病率也越高[4]。鉴于其在老年人群中高度流行,对健康的影响重大,肌肉衰减症已于2016年正式入编世界卫生组织国际疾病分类表(ICD-10-CM,代码M62.84)[5]。
老年肌肉衰减症的筛查、评估与诊断
结合我国老年人的定义和亚洲肌肉衰减症工作组 (Asian Working Group for Sarcopenia,AWGS)及EWGSOP的建议,目前推荐60岁以上的老年人每年进行一次肌肉衰减症筛查;同时,每次重大健康事件(如意外跌倒住院)发生时,也建议进行机会性筛查。肌肉衰减症病人的临床表现常缺乏特异性,可表现为虚弱、四肢纤细无力、易跌倒、步态缓慢、行走困难等。实际评估工作仍围绕其定义及诊断标准,综合肌力、肌量以及功能三方面进行。常用的评估工具包括CT、双能X线检查及人体成分仪、身体活动测试等。实践工作中可根据具体要求按需选择。
既往研究推荐肌肉衰减症的临床筛查遵循步速测试-握力评估-肌量测量的模式。建议在出现步速下降(≤0.8 m/s)和(或)优势手握力降低(男性≤25 kg,女性≤18 kg)的情况下,行进一步的肌量检测,以确诊肌肉衰减症[4]。为便于临床及社区筛查,2016年AWGS推荐使用SARC-F量表进行病人自评,用于该病的临床初步诊断[6]。鉴于筛查工作遵循简便易行的原则,国际肌肉衰减症临床实践指南整合上述方法,推荐采用步速或SARC-F进行筛查;经筛查确认为潜在肌肉衰减症的病人接受进一步的肌量、肌力及其他身体活动检测,以确诊和评估严重程度[7]。
为了临床尽早发现和积极防治肌肉衰减症,EWGSOP2(2018)总结了当前的研究证据,推荐使用发现-评估-确认-严重程度(F-A-C-S)的流程,采用具体的指标,由简易到精确,进行肌肉衰减症的临床评估和诊断,为管理实践提供良好的范式(见图1)[3]。
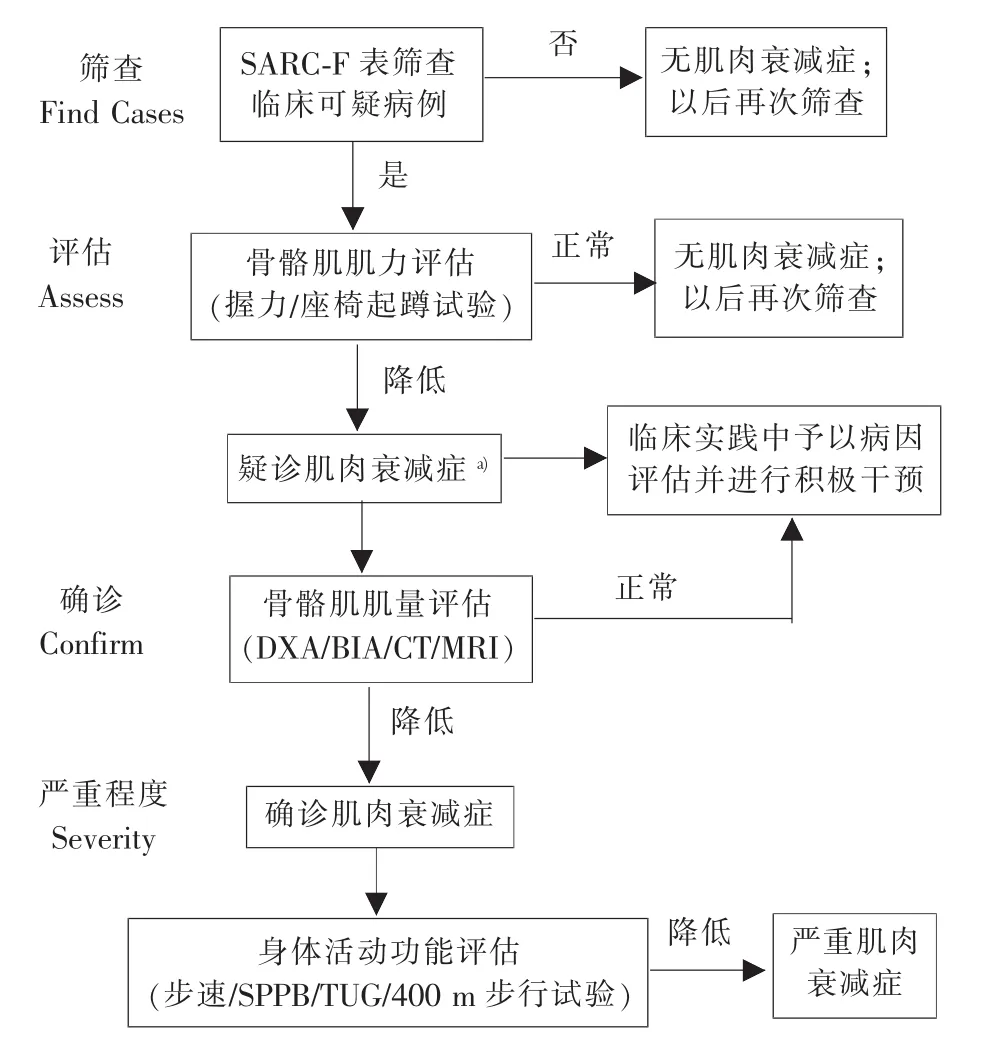
图1 EWGSOP2(2018)推荐的肌肉衰减症F-A-C-S评估流程图
由于研究不断深入,数据更新以及地域/人群异质性等原因,目前肌肉衰减症的诊断标准仍在不断完善中,许多指标的参考切点值也不一致(见表1)。目前我国临床与科研常用的诊断标准主要有两个。一个由AWGS[4]于2014年提出;另一个由EWGSOP[3]于2018年更新。两个诊断标准在实际使用中各有长处。总体而言,EWGSOP2(2018)标准包括简易体能状况量表 (short physical performance battery protocol,SBBP)、起立行走计时试验(timedup-and-go test,TUG)等简易而有效的指标,对身体活动功能进行细致的综合评价。AWGS(2014)标准的优势是基于亚洲的研究数据,推荐的切点值对于亚洲人群肌肉衰减症的诊断更具参考价值。在目前的实际临床工作中,建议结合两者所长,沿用AWGS(2014)的肌量和握力等的诊断切点值,结合EWGSOP2(2018)中的多项身体活动功能评估指标,进行综合评估。考虑到地域和人群的异质性问题,基于EWGSOP2(2018)的诊断评估模式,建立亚洲人群以及中国人群的参考切点值是未来研究工作的方向。
肌肉衰减症的防治策略
肌肉衰减症的传统防治策略主要集中于营养和运动干预。抗阻运动(resistance exercise,RE)与蛋白质补充相结合的干预被认为是预防肌肉衰减症的金标准。随着病因研究的深入,各种新的防治措施也逐渐受到重视。但值得注意的是,由于诊断标准不一、研究设计缺陷、各类偏倚、研究规模偏小、缺乏效益分析等问题,目前绝大多数干预的证据等级偏低,其有效性及可靠性仍有待大样本人群研究进一步验证。
一、营养干预
(一)常见营养干预措施
目前研究较多且形成共识的营养干预措施包括:补充蛋白质、必需氨基酸(亮氨酸)、β羟基-β甲基丁酸(HMB,亮氨酸的生物活性代谢物)、维生素D等。充足的蛋白质供给和合理的摄入模式,有助于延缓肌肉衰减症的发生和进展。推荐老年人蛋白质供给量为 1.0~1.2 g/(kg·d),严重营养不良和急慢性疾病者, 蛋白质摄入量可达 1.2~1.5 g/(kg·d)[11]。优质蛋白质占50%,并平均分配到三餐。必需氨基酸的摄入,尤其是亮氨酸,可启动mTOR信号通路,从而刺激老年人肌肉蛋白质的合成,并克服增龄导致的合成代谢抵抗。亮氨酸的推荐摄入量为3~6 g/d[12]。补充维生素D可改善老年人的肌力下降,预防跌倒。血清25羟维生素D水平缺乏和不足的老年人都应补充维生素D,使其达到适宜的水平(≥75 nmol/L)。建议维生素D的补充剂量≥700 IU[13]。HMB是亮氨酸的生物活性代谢物,通过降低半胱天冬酶活性,减轻分解代谢过程中的细胞凋亡,抑制泛素-蛋白酶表达和活性,缓解全身炎症从而改善蛋白质平衡,减少肌肉蛋白质分解[14]。但值得注意的是,虽然这些干预是目前公认的肌肉衰减症营养防治措施,但其有效性和可靠性有待大样本研究进一步确认。此外,近期也提出一些新颖而有趣的营养干预理念和方法。
(二)能量限制
一般将相对于正常饮食减少20%~40%的热能摄入称为能量限制,是目前公认延缓原发性衰老(年龄相关)及继发性衰老(疾病和不良生活习惯所致衰老加速)最有效的干预措施,可减少包括肌肉衰减症在内的多种增龄相关性疾病的发生,并延长寿命。研究显示,能量限制对肌肉衰减症的保护作用可能与保护细胞线粒体功能、抑制骨骼肌中增龄相关性凋亡信号增加、激活自噬信号以抑制肌肉萎缩等相关,但具体机制有待进一步研究予以阐明[15-17]。此外,目前能量限制对肌肉衰减症保护作用的证据主要来自啮齿类及恒河猴等动物实验,其对人类肌肉衰减症缓解的有效性以及适用于人类的膳食限制程度标准的应用等尚未解决。

表1 肌肉衰减症诊断标准的比较
(三)熊果酸
熊果酸为戊酸三萜类物质,是苹果皮中的主要蜡状成分,具有多种民间降糖草药的活性成分。Kunkel等[18]的研究表明,熊果酸可通过增强骨骼肌胰岛素/胰岛素样生长因子1信号转导并抑制骨骼肌中的萎缩相关基因[如萎缩素第一型基因(Atrogin-1)及肌肉特异性环指蛋白1基因 (MuRF-1)]的mRNA表达来减轻空腹以及去神经所致肌肉萎缩。Yu等[19]针对慢性肾脏病小鼠模型的干预实验结果显示,熊果酸可能通过增加蛋白质合成、减少其水解,来抑制肌生长抑素和炎症细胞因子的表达,进而改善慢性肾脏病诱导的肌量下降症状。但目前缺乏熊果酸补充对骨骼肌和肌肉衰减症影响的直接证据。
(四)益生菌及益生元补充剂
由于营养是肠道菌群构成的主要决定因素之一,又与肌肉衰减症病理机制相关,因而肠道菌群可能是这两个因素间病理生理的交叉点。目前关于肠道菌群对肌肉影响的研究主要集中于动物。对癌症小鼠施用罗伊杆菌的动物实验结果显示,益生菌制剂可有效抑制恶病质的发展,且与肌量的维持密切相关[20]。通过应用抗生素诱导菌群失调的动物实验表明,肠道微生态失调可能通过促进小鼠神经-肌肉传递病变,进而促进肌肉蛋白质分解代谢[21]。Buigues等[22]针对60名65岁以上衰弱老年人进行为期13周的随机对照干预试验结果显示,相比于安慰剂,益生元制剂(低聚果糖和菊粉)可有效改善疲劳状况和握力,提示肠道菌群潜在的肌肉调节作用。现有证据将肠道菌群对肌肉的调节归因于肠道菌群代谢产物,如短链脂肪酸、色氨酸、甜菜碱等对骨骼肌线粒体功能的调节作用、抗炎/抗氧化应激特性和对骨骼肌蛋白质代谢的调节作用等[23]。尽管目前尚缺乏高质量的大型研究证据,但肠-肌轴的存在以及益生菌/益生元制剂作为肌肉衰减症干预的效果评估仍是未来研究的方向。
二、运动干预
运动干预也是肌肉衰减症的重要防治手段。大量研究表明,长期卧床和久坐等身体活动减少状态可引起老年人肌量减少,肌力和运动能力下降以及致残等不良结局增加。运动干预则对抵抗肌肉衰减症具有显著的积极作用。现有证据显示,运动可能通过促进肌星状细胞分化、增殖,促进线粒体产能和代谢效率,改善肌毛细血管氧气输送,调节机体合成代谢以及改善胰岛素敏感性等多种途径,影响肌肉的质量和功能[24]。目前认为,以坐位抬腿、举哑铃、拉弹力带等RE为基础的锻炼是对抗肌肉衰减症最有效的运动干预;其训练强度和训练数量是影响效果的关键因素[25-26]。因此,建议进行规律的RE,每次锻炼累计30~60 min中、高强度的RE,每组局部RE锻炼动作间休息间隔30~60 s,每周频率以2~4 d为佳,最好隔天进行[26]。
三、药物治疗
现有证据提示,除年龄、营养状况及身体活动外,激素变化、代谢稳态、炎症反应等都可能参与肌肉衰减症的发生和发展,因而针对这些病因的药物治疗也是潜在的有效干预措施。但总体来说,这些药物治疗研究仍处于探索阶段。
(一)肌生长抑素抑制剂
肌生长抑素属于转化生长因子β超家族,是肌肉生长潜在的负性调节剂,其对于肌肉增生及增大的抑制作用在肌生长抑素基因敲除/过表达的小鼠模型中得到证实[27]。有研究认为,肌生长抑素可能通过抑制Akt-mTOR信号通路进而抑制肌肉蛋白质的合成。肌生长抑素抑制剂可通过阻断这一过程,抵抗肌生长抑素对肌肉生长的负性作用[28]。有报道研究多种肌肉疾病模型 (如杜氏肌营养不良、肌萎缩侧索硬化症、癌性恶病质等)中肌生长抑素抑制剂的作用。动物模型研究其对肌肉衰减症的抵抗效果,均显示了积极的肌量维持及肌肉功能保护作用[29-31]。Becker等[32]在75岁以上虚弱的跌倒老年人中进行概念验证二期临床试验。结果显示,相比于安慰剂,皮下注射肌生长抑素抗体(LY2495655:LY)(315 mg)24 周,有效改善其四肢瘦体重、肌力以及身体活动表现,提示肌生长抑素抑制剂在治疗肌肉衰减症方面的巨大潜力。
(二)激素
睾酮激素作为一种重要的性激素,可增强肌肉蛋白质的合成,因而或为改善肌肉衰减症的潜在治疗药物。多项研究提示,补充睾酮可有效改善肌肉衰减症肌量减少、握力下降等症状[33-34]。尽管如此,需注意的是,高剂量睾酮补充治疗会发生睡眠呼吸暂停、血栓性并发症发生以及前列腺癌风险增加等不良反应,这些风险可能大于其益处。新型非甾体化合物(选择性雄激素受体调节剂)具有一定的组织选择性。相比睾酮激素,这类药物在不良反应方面得到明显改进,因而可能是很好的替代选择。这些药物是否能有效治疗肌肉衰减症尚有待研究。
(三)血管紧张素转化酶抑制剂
长期以来,血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)常被用于心血管疾病的治疗和继发性卒中的预防。研究显示,相比于其他降压药物,长期使用ACEI可有效减缓老年人肌力及步速下降,并保持更好的下肢骨骼肌肌量,提示ACEI对骨骼肌具有潜在益处[35]。其可能通过改善内皮功能、调节代谢、抗炎等,改善骨骼肌的血流状况,进而提高骨骼肌功能。此外,线粒体数目增加和提高胰岛素样生长因子1是ACIE帮助抵抗肌肉衰减症的潜在机制[36]。虽然ACEI对肌肉衰减症的抵抗作用仍需进一步的研究证据支持,但由于许多老年人都有潜在的心血管问题,而这类药物已普遍应用于老年人临床处方中,因而也为ACEI对肌肉衰减症的疗效研究提供了契机。
小 结
定期严格的临床与社区筛查和评估工作有助于肌肉衰减症病人的早期发现和诊断;而针对性地纠正营养不良状态,合理适量的营养补充结合规律RE是目前肌肉衰减症的最佳防治策略。未来仍需更多的病因机制探索以及针对病因的干预研究,以利于肌肉衰减症的预防和管理,提高老年人的生活质量,延长老年人健康寿命年。

