抗马铃薯Y病毒(PVY)和烟草花叶病毒(TMV)单联弱毒疫苗的研制及防效测定
姜瀚林,田延平,郭兆奎,刘永中,万秀清,刘文涛,李现道,李向东,张永春,孟凡武
1 山东农业大学植物保护学院,山东泰安岱宗大街61号 271018;2 黑龙江省烟草科学研究所,黑龙江哈尔滨哈药路17号 150076;3 山东临沂烟草有限公司,山东省临沂市兰山区北城新区智圣路3号 276003;4 山东省烟草研究院,山东济南舜华东路13号 250098;5 山东潍坊烟草有限公司,潍坊市高新技术开发区健康街678号 261061
病毒病给烟叶安全生产造成了严重威胁,其中马铃薯Y病毒(Potato virus Y,PVY)和烟草花叶病毒(Tobacco mosaic virus,TMV)是危害我国烟草最重要的两种病毒[1-3]。生产中没有同时抗多种病毒的品种,农业防治、物理防治和化学防治等传统方法防效也不理想[4-6]。通过转基因技术将外源片段插入到烟草基因组中虽然可以获得抗性品种,但转基因烟草不能在生产中推广种植[7-9]。本研究筛选PVY和TMV基因组中保守且有表达siRNA潜力的片段,连接到烟草脉带花叶病毒(Tobacco vein banding mosaic virus,TVBMV)弱毒侵染性克隆获得单联弱毒疫苗,借助TVBMV侵染性克隆筛选保护效果最佳的片段,通过山东、黑龙江的田间试验验证其防效,为烟草PVY和TMV的有效防治提供了新途径。
1 材料与方法
1.1 供试材料及试剂
室内试验供试烟草品种为NC89,山东地区田间试验供试烟草品种为中烟101,黑龙江地区田间试验供试烟草品种为龙江911。PVY分离物Harbin(GenBank登录号MH933741)及TMV分离物Harbin-1(GenBank登录号MH595919)采自黑龙江哈尔滨烟草[2-3]。
大肠杆菌菌株DH5α和农杆菌菌株GV3101由本实验室保存,TVBMV弱毒侵染性cDNA克隆载体由本实验室构建[10]。
DNA凝胶回收试剂盒和质粒小提试剂盒均购自北京全式金公司;Phusion超保真DNA聚合酶购自Thermo公司,CutSmart缓冲液和限制性内切酶购自NEB公司;M-MLV反转录酶和T4 DNA连接酶购自TaKaRa公司;Super ScriptTMⅣ反转录酶购自Invitrogen公司;MES和AS购自Solarbio公司;其他试剂均为进口或国产分析纯。
1.2 实验方法
1.2.1 PVY和TMV片段筛选及克隆
使用DNAMAN(version7)分别比对GenBank中的PVY和TMV基因组序列,选取保守序列,再 经 siRNA Direct网 站(http://plantgrn.noble.org/pssRNAit/)筛选具有高效表达siRNA潜力的PVY和TMV基因组片段各3个,分别命名为PVYF1、PVYF2、PVYF3和 TMVF1、TMVF2、TMVF3。 设计引物并通过RT-PCR 获得相应DNA 片段。引物由北京华大基因公司合成,序列见表1。

表1 PVY及TMV片段扩增引物Tab.1 Primers used to amplify PVY and TMV fragments
1.2.2 单联弱毒疫苗构建
PCR产物经1%琼脂糖凝胶电泳分离,紫外灯下切取目的胶条并用EasyPure Quick Gel Extraction Kit回收扩增片段。利用PacI和XbaI进行酶切,酶切体系:10×CutSmart 缓冲液 2 µL,PacI 1 µL,XbaI 1 µL。37℃酶切30 min。使用T4 DNA连接酶将片段分别连接到同样酶切处理的TVBMV弱毒载体(图1)。连接体系为:10×T4 DNA连接缓冲液1 µL,酶切有效片段7 µL,酶切TVBMV弱毒载体1 µL,T4 DNA连接酶1 µL。4℃静置8 h后转化Escherichia coliDH5α感受态细胞。菌落PCR验证后选取阳性菌落接种至含卡那霉素(5 μg/mL)的LB培养基中,37℃摇培12 h。使用EasyPure Plasmid MiniPrep Kit提取质粒,送北京华大基因公司测序并选择正确质粒转化AgrobacteriumGV3101感受态细胞。
1.2.3 弱毒疫苗诱导摇培及重悬
选择阳性菌落接种至含5 μg / mL四环素、50 μg/ mL利福平和5 μg / mL卡那霉素的LB培养基中,28℃振荡培养至对数增长期。取500 μL菌液加至5 mL含10 mmol/L MES 和2 μmol/L AS及上述抗生素的 LB 液体培养基中,28℃振荡培养10~16 h。离心收集菌体并用10 mmol/L 的MgCl2重悬,调整浓度至OD600为 0.5。
1.2.4 室内保护效果测定
选取4~5叶期普通烟植株,针对PVY和TMV各设置Mock组和三个疫苗组,每组12棵,重复3次。用注射器将OD600为0.5的农杆菌重悬菌液注入叶片,每株注射2片叶片。处理植株放置 23 ℃光照培养箱中培养(16 h光照/8 h黑暗交替)。15天后,取PVY-Harbin和TMV-Harbin-1侵染15~21天的烟草植株顶部嫩叶,按照1:20(W/V)加pH7.0磷酸盐缓冲液研磨匀浆,5000 g离心10分钟,取上清通过汁液摩擦进行挑战接种。挑战接种后15天观察症状,统计发病率。每个处理每次重复选取4株代表性植株,采集顶部第一片展开叶,通过间接ELISA法,比较各处理OD405平均值分析病毒积累量[11]。
1.2.5 田间保护效果测定
参照标准NY/T 1464.73—2018[12]进行。2018年4月21日和22日在山东临沂市沂南县双堠镇和潍坊市昌乐县宅科镇进行接种,7月29日和30日调查发病情况。2018年5月4日在黑龙江省哈尔滨市宾县宾西镇接种,8月15日调查。
试验分TVB-PVYF2疫苗处理、TVB-TMVF3疫苗处理和常规对照三组。山东选用中烟101,黑龙江选用龙江911。选取4~5叶期烟草植株,将诱导重悬后、OD600= 0.5的 TVB-PVYF2和 TVB-TMVF3弱毒疫苗菌液分别喷雾至苗床烟草叶面表面,常规对照组喷施清水。每组处理2个育苗大棚,重复3次,完全随机区组设计。处理7~10天后移栽,田间自然发病。三个月后调查发病率,计算防治效果和相对防效。同时以等距取样法采集20个田间样品,利用引物TVBMV-NIB8460-F(AAA ATG CAC TGA GGA GAT TAT ATC TC)和TVBMV-CP8640-R(CCA CTT GCG CAT TTC CTT GT)进行RT-PCR检测,接种成功的植株中能分别扩增出大小为512 bp和608 bp的片段。根据扩增片段的有无计算接种成功率。
烟草病毒病分级标准:
0级:全株无病;1级:心叶脉明或轻微花叶病株无明显矮化;2级:三分之一至二分之一叶片花叶,少数叶片变形,或病株矮化为正常三分之二以上;3级:全株叶片花叶,严重变形或坏死,或病株矮化为正常植株的二分之一以上。
计算公式:
病情指数=[Σ(病级数×病株数)/(调查总株数×3)]×100
防治效果=[(常规对照发病率-疫苗处理发病率)/常规对照发病率]×100%
相对防效=[(常规对照病指-疫苗处理病指)/(常规对照病指)]×100%
2 结果
2.1 单联弱毒疫苗构建
利用PCR技术分别扩增PVY和TMV各3个外源片段(图1),通过PacI和XbaI双酶切,将6个外源片段分别连接TVBMV弱毒克隆并转化农杆菌感受态GV3101,得到了6个单联弱毒疫苗,分别命名为TVB-PVYF1、TVB-PVYF2、TVB-PVYF3和TVB-TMVF1、TVB-TMVF2、TVB-TMVF3。
图1 病毒基因组片段的PCR扩增Fig.1 PCR amplification of viral genomic fragments
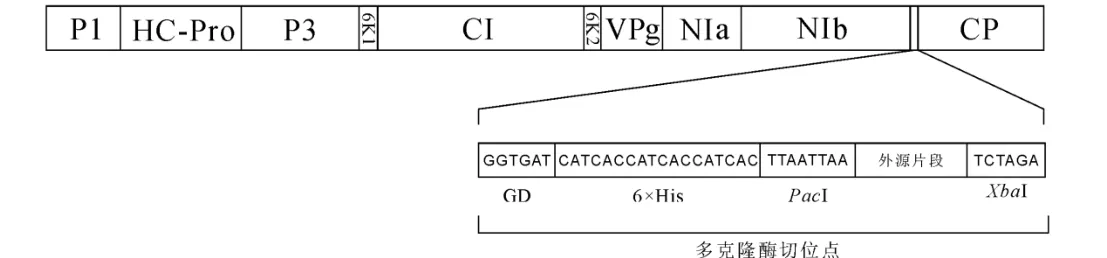
图2 单联弱毒疫苗载体示意图Fig.2 Schematic diagram of mild vaccine vector
2.2 弱毒疫苗室内保护效果
2.2.1 对PVY保护效果
挑战接种后第15天,直接接种PVY的烟草植株(Mock组)发病率为97.2%,叶脉坏死严重,植株矮化,仅为正常株高的1/3;接种TVB-PVYF1的烟草株高正常,下部叶片出现花叶和叶脉坏死症状,发病率为47.2%,防治效果为51.4%;接种TVB-PVYF2烟草株高正常,下部叶片出现轻微的叶脉坏死症状,发病率为22.2%,防治效果为77.2%;接种TVB-PVYF3烟草株高矮化至正常株高的2/3,下部叶片出现严重花叶和叶脉坏死症状,发病率为69.4%,防治效果为28.6%。与Mock组相比,接种单联弱毒疫苗的植株症状明显减轻。ELISA检测12株代表性烟草的病毒积累量,结果表明,弱毒疫苗保护的烟草植株中病毒积累量明显降低,其中TVB-PVYF2保护的烟草植株中病毒积累量降低89.27%(图3)。
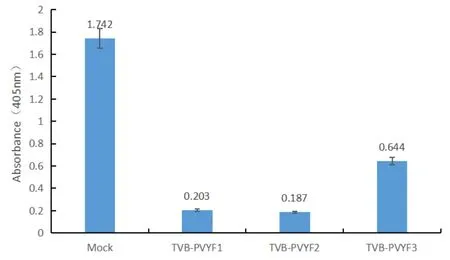
图3 不同弱毒疫苗处理后烟草中PVY积累量Fig.3 Accumulation levels of PVY in Nicotiana tabaccum plants protected with different mild vaccines
2.2.2 对TMV保护效果
挑战接种15天后,Mock组烟草发病率均为100%,上部叶片表现出严重的花叶和畸形疱斑症状;TVB-TMVF1保护的烟草顶端叶片出现花叶和畸形疱斑症状,发病率为88.9%,防治效果为11.1%;TVBTMVF2保护的烟草心叶出现花叶和畸形疱斑症状,发病率为83.3%,防治效果为16.7%;TVB-TMVF3保护的烟草仅心叶出现轻微疱斑,发病率为69.4%,防治效果为30.6%。ELISA检测代表性植株内病毒含量,结果表明,3个疫苗保护的植株中病毒积累量均有所降低,其中TVB-TMVF3保护的植株中病毒积累量降低67.20%(图4),说明TVB-TMVF3的保护效果最好。
2.3 单联弱毒疫苗的田间保护效果
2.3.1 单联弱毒疫苗接种率

图4 不同弱毒疫苗处理后烟草中TMV积累量Fig.4 Accumulation levels of TMV in Nicotiana tabaccum plants protected with different mild vaccines

表2 弱毒疫苗三次室内保护效果验证Tab.2 Protective effects of different mild vaccines in green house
RT-PCR检测结果表明,临沂烟田TVB-PVYF2和TVB-TMVF3的接种成功率分别为80%和90%,潍坊烟田TVB-PVYF2和TVB-TMVF3的接种成功率分别为50%和60%,黑龙江烟田TVB-PVYF2和TVB-TMVF3的接种成功率分别为85%和90%。
2.3.2 单联弱毒疫苗TVB-PVYF2对PVY的保护效果
TVB-PVYF2保护的烟草植株发病率和病情指数明显低于常规对照组,说明TVB-PVYF2疫苗在田间有显著防效,其中山东临沂烟田的保护效果最好,保护率为69.34%,相对防效为76.64%;在黑龙江哈尔滨烟田的保护效果次之,保护率为56.48%,相对防效为66.88%;山东潍坊烟田的保护效果较差,保护率为46.28%,相对防效为60.71%(表3)。
2.3.3 单联弱毒疫苗TVB-TMVF3对TMV的保护效果
TVB-TMVF3保护的烟草发病率和病情指数明显低于常规对照组,其中山东临沂烟田TVB-TMVF3的保护效果最好,保护率为83.06%,相对防效为87.34%;黑龙江哈尔滨烟田TVB-TMVF3的保护效果次之,保护率为77.61%,相对防效为80.74%;山东潍坊烟田TVB-TMVF3保护效果最次,保护率为64.01%,相对防效为74.40%(表4)。
3 讨论
TVBMV弱毒突变体对野生型TVBMV有良好的保护效果[10]。本研究以TVBMV弱毒突变体为骨架,通过比较PVY和TMV不同基因组片段诱导的保护效果,筛选到了对PVY和TMV保护效果最好的片段,进而获得了能抗PVY或TMV的单联弱毒疫苗。利用这种策略,可以进一步研发双联或多联弱毒疫苗,扩大TVBMV弱毒突变体的交叉保护谱,弥补弱毒突变体保护谱窄的缺陷。

表3 单联弱毒疫苗TVB-PVYF2对PVY的田间防效Tab.3 Protective effect of mild vaccine TVB-PVYF2 against PVY

表4 单联弱毒疫苗TVB-TMVF3对TMV的田间防效Tab.4 Protective effect of mild vaccine TVB-TMVF3 against TMV
从临沂和潍坊两地疫苗接种率检测结果来看,临沂的接种成功率远高于潍坊地区,潍坊烟田发病最重,保护效果最差,主要原因是潍坊地区为下午接种,此时苗棚内温度较高,影响了农杆菌侵染活性[13]。因此,提高接种率应选择四至五叶期幼苗,于清晨或傍晚时分接种,此时棚内温度凉爽,适宜农杆菌侵染。
交叉保护效果在病害发生轻时效果好,如果发病严重,则保护效果偏低[14]。本研究的室内试验中,TVB-TMVF3保护的烟草发病率很高,只是症状较轻,病毒积累量较低,这与接种TMV的浓度高有关。TMV的稀释限点可以达到1:10-6,但我们挑战接种所用TMV病汁液是按照1:20(W/V)制备的。TVB-TMVF3在田间的表现明显好于室内试验。
4 结论
(1)弱毒疫苗TVB-PVYF2和TVB-TMVF3分别对PVY和TMV的保护效果最好。保护间隔期为15天时,TVB-PVYF2的保护率为75%,可使PVY强毒株系积累量降低89.27%;TVB-TMVF3可减轻TMV症状并使其积累量降低67.20%。
(2)TVB-PVYF2对黑龙江哈尔滨、山东临沂和潍坊烟田PVY的相对防效分别为66.88%、76.46%和60.71%,TVB-TMVF3对黑龙江哈尔滨、山东临沂和潍坊烟田TMV的相对防效分别为80.74%、87.34%和74.40%。
(3)基于农杆菌喷雾的弱毒疫苗接种应选择清晨或傍晚进行,避开育苗棚内的高温时段。

