原发性闭角型青光眼行小梁切除术中应用可调整缝线的对照研究
谢瞻 张娇 杜牧龙 陈琴
小梁切除术是临床中经典的抗青光眼手术,但是术后常见低眼压、浅前房、滤过道瘢痕化等并发症。可调整缝线技术是青光眼医生用于改良小梁切除术的常规技术,通过调整拆除缝线的就医时间和数目,达到调整房水滤过量,使其形成理想的功能性滤过泡。随着大范围推广和应用,一定程度上降低了术后早期滤过过畅、浅前房及脉络膜脱离等并发症的发生。但可调整缝线实际上只是单向调整,在滤过量过大时并不能通过调节来减少滤过;而且术后需要根据患者眼压、前房深度、滤过泡情况适时拆线,增加了滤过泡维护的治疗时间和难度,也增加了患者的就医时间和经济、精神负担等。因此,近年来有学者提出可调整缝线是否必须,对术后控制眼压和减少并发症方面是否具有优势提出质疑。如果医师在术中能对滤过量做出准确判断并合理调整巩膜瓣缝合的松紧度,实现有效安全的滤过,则没有必要在术后对可拆除缝线进行调整,可简化手术及随访过程,有效改善手术效果和患者主观满意度[1]。基于以上疑问,本研究对原发性闭角型青光眼(primary angle-closure glaucoma,PACG)患者行改良小梁切除术,即通过术中调节巩膜瓣缝线的松紧度而调控滤过量,探索术中调整滤过量在小梁切除术中的应用和疗效,以期为临床治疗的选择提供依据。
资料与方法
一、研究对象
2016年1月至2017年12月于江苏省人民眼科住院治疗的PACG患者50例(50只眼)。纳入标准[2]:(1)年龄≥40岁;(2)眼压>21 mmHg(1 mmHg=0.133 kPa);(3)前房角粘连关闭超过1/2圆周[PAS(peripheral anterior synechiae)≥6个钟点];(4)有青光眼视神经损害表现:C/D≥0.7或双眼C/D差值≥0.2;(5)有青光眼性视神经损害;(6)眼轴≥21 mm。排除标准:(1)既往曾有眼科手术史或外伤史;(2)有严重系统性疾病可能影响随访者;(3)不愿参与此研究者。
根据随机数字表,将所有符合条件的患者随机分成2组:接受改良小梁切除术组(实验组)和接受联合可调整缝线的小梁切除术组(对照组)。
二、手术方法
对照组采用筋膜囊下浸润麻醉,做以穹隆为基底的结膜瓣,充分电凝止血。在12点做约4 mm×4 mm大小的方形巩膜瓣,巩膜瓣向前剖入透明角膜缘内约1 mm,深度约1/3~1/2巩膜厚度。将氟尿嘧啶原液浸湿的棉片放置于板层巩膜瓣及邻近结膜瓣下5 min,取出棉片后用100 ml生理盐水冲洗巩膜床、结膜囊及角膜表面。于3点位或9点位角膜缘内1 mm处,用15°穿刺刀平行虹膜面向前房内做穿刺切口,轻压切口后唇,缓慢放出少量房水,切除约2 mm×1 mm小梁组织,并做周边虹膜切除。10-0尼龙线缝合巩膜瓣两后角各1针,巩膜瓣两侧切口缝合1对可调整缝线。从前房穿刺口注入平衡盐溶液重建前房,以不渗漏或微渗漏视为前房形成良好。在眼压调至正常后,10-0尼龙线缝合眼球筋膜及球结膜。
试验组手术操作接基本同对照组,但术中不做可调整缝线。在用10-0尼龙线缝合巩膜瓣鼻上及颞上各1针后,从角膜穿刺切口向前房内匀速、缓慢注水,观察前房1 min,如果停止注水后前房缓缓变浅,但不消失,说明滤过强度适宜;如果注水时前房深度持续加深,说明滤过不足;如果注水时前房深度不足或停止注水后迅速变浅,说明滤过过强。如果滤过不足,简单地松解缝线并不可靠,需查看滤过口的情况,看是否存在内口过小或是色素组织碎屑残留堵塞滤过口,需及时处理;另外,虹膜切口前唇粘附于小梁切口缘,注水时虹膜随水流推向滤过口亦可造成堵塞,应将其分开复位。若不存在以上情况,可考虑松解缝线。若滤过强,可抽紧或增加缝线,直至产生适度的房水滤过。10-0尼龙线缝合球结膜及筋膜。
三、术后治疗及随访
所有患者于术前、术后1 d、1周、1个月、3 个月、6 个月行LogMAR 视力表、Goldmann 压平眼压计、裂隙灯和直接检眼镜下视神经和黄斑检查。术后并发症、增用的降眼压药物、手术治疗史等临床数据均记录在病例报告表中。
手术标准[3]:不使用抗眼压药物术后眼压控制在6~21 mmHg范围内为完全成功;术后加用抗青光眼药物眼压控制在6 ~21 mmHg范围内,为条件成功;术后使用降眼压药物后,眼压高于21 mmHg或眼压低于6 mmHg则为失败。
因滤过过强造成浅前房的判断标准[4]:眼压明显偏低、前房浅、滤过泡过度隆起弥散,甚至下垂。浅前房定义:I级:全部前房变浅,周边前房呈裂隙状;IIa:仅虹膜小环以内存有极浅前房,IIb:仅瞳孔区内有极浅前房;III:虹膜、晶状体全部与角膜相贴,前房完全消失。
滤过泡形态按照Krofeld分型法[5],I型(微小囊状型),Ⅱ型(扁平弥散型),Ⅲ型(瘢痕型),Ⅳ型(包裹型)。
四、统计方法

结 果
一、一般情况
术后6个月中实验组有6例失访,对照组有9例失访。实验组和对照组人口统计学和临床特征的基线比较,包括性别、年龄、眼别、治疗前裸眼视力、治疗前眼压、治疗前抗青光眼用药种类等见表1。
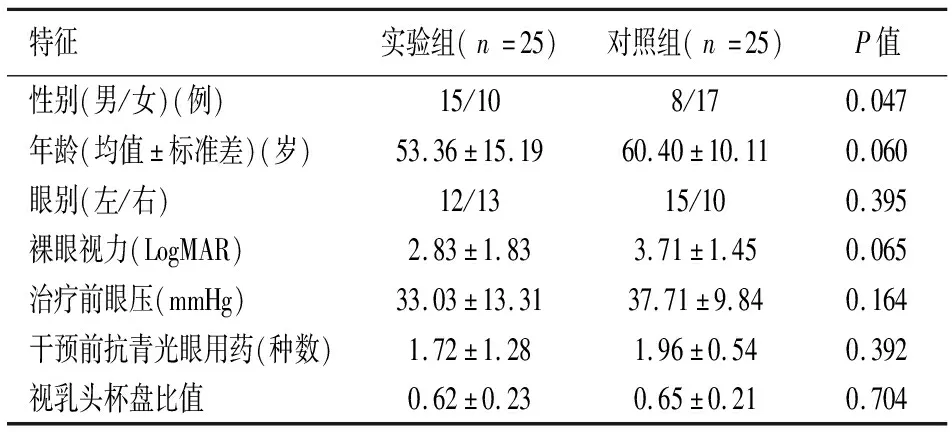
表1 实验组和对照组患者基线资料
二、术后视力
在术后6个月时,视力下降2 行或以上的患者实验组有3例,占12.0%,对照组有5例,占20%,两组之间差异无统计学意义(P>0.05)。术后6个月,实验组及对照组视力与术前比较,差别无统计学意义(均P>0.05)(见表2)。

表2 两组患者术前与术后6个月视力的组内比较
三、术后眼压
两组患者在术前、术后1 d、术后1周、术后1个月、术后3个月及术后6个月眼压比较,未见显著性差异(P>0.05)(见表3,图1)。
四、两组患者术后并发症的比较
两组患者术后早期浅前房的发生率相当(均P>0.05),暂时性低眼压发生率实验组(12%)高于对照组(8%),但该差异无统计学意义。脉络膜脱离的发生率两组亦未见著性差异(见表4)。
五、两组患者 术后6个月滤过泡形态比较

表3 两组患者不同时间点的眼压比较
图1 两组患者不同时间点眼压曲线
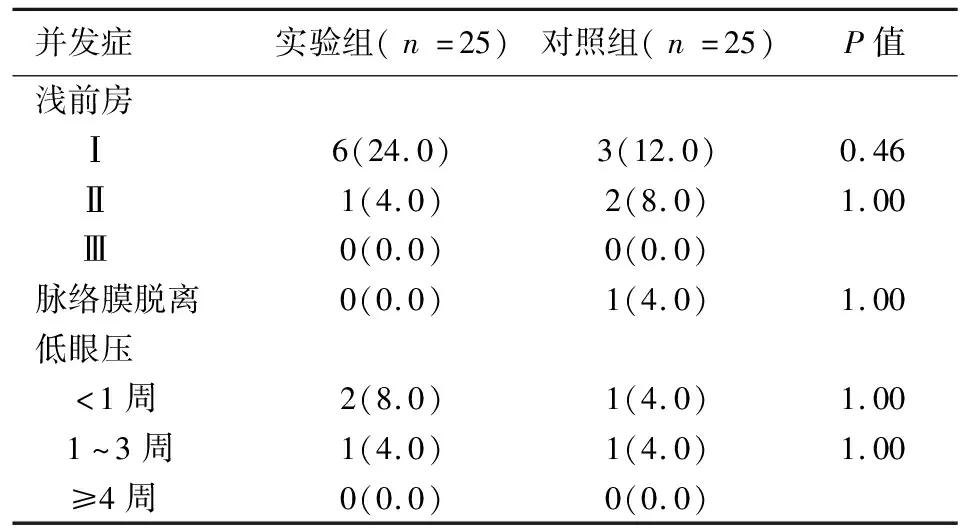
表4 2组患者的术后并发症[n(%)]
术后6个月试验组I、Ⅱ型滤过泡19只眼,占76.0%(19/25),Ⅲ、Ⅳ型滤过泡6只眼,占24%(6/25)。对照组I、Ⅱ型滤过泡14只眼,占56%(14/25),Ⅲ、Ⅳ型滤过泡11只眼,占44%(11/25)。两组滤过泡形态情况比较,差异未见统计学意义(χ2=2.228,P>0.05)。
六、小梁切除术后6个月两组患者手术成功率比较
术后6个月时,两组患者手术成功率比较,差异未见统计学意义(P>0.05)(见表5)。
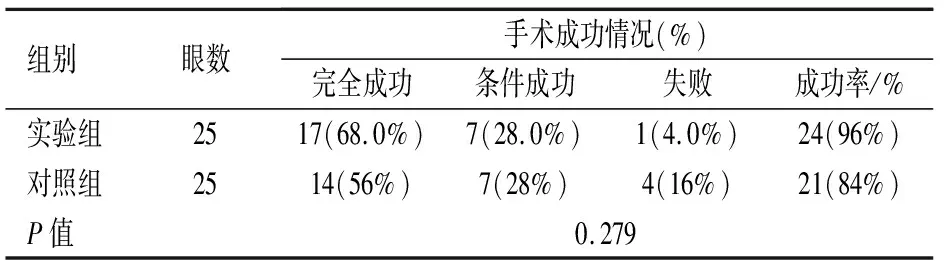
表5 术后6个月两组患者手术成功率比较[n]
注:对照组:联合可调整缝线的小梁切除术组;观察组:改良小梁切除术组;总成功率=(完全成功+条件成功眼例数)/每组总眼数P值:Mann-Whitney testP值
七、术后用药情况
实验组6 例随访中增用了抗青光眼药物,5例为1 种药物,1 例为2种药物;对照组12 例使用抗青光眼药物,5例为1 种药物,4例为2种药物,3例为3种药物。实验组平均用药(0.28±0.54)种,对照组(0.88±1.09)种,差异有统计学意义(t=-2.460,P<0.05)
八、术后再手术情况
实验组有1 例在术后3 d行前房成形术,有1例术后3个月眼压控制不佳,入院行白内障超声乳化摘除术联合人工晶状体植入术,术后6个月随访时眼压控制不佳,眼部予降眼压药物治疗后眼压控制。对照组有4例在术后1个月时眼压控制不佳,有1例于术后3个月始出现眼压控制不佳,以上患者联合降眼压药物治疗,术后6个月时有4例仍眼压控制不佳。建议患者行白内障超声乳化摘除术联合人工晶状体植入术,因患者不愿意而实际上对照组病例均无1例于6个月内再次行手术治疗。
讨 论
POAG是我国最常见的青光眼类型,传统的小梁切除术是经典治疗方法, 但由于术后早期滤过较强、浅前房及晚期滤过泡纤维包裹对手术治疗效果影响较大[2]。相较于开角型青光眼患者,闭角型青光眼患者在小梁切除术中及术后更容易出现低眼压、浅前房、恶性青光眼、脉络膜脱离等并发症[6,7]。较多学者将可调整缝线技术运用于小梁切除术中,认为通过术中紧密缝合巩膜瓣及术后适时拆线以期降低术后与滤过过畅相关的低眼压、浅前房等并发症发生率[7-11]。可拆除缝线技术在我国诸多文献中均有报告,张青等[10]于2016年针对372名眼科医生的问卷调查显示,77.17%的患者在小梁切除术中使用巩膜瓣可调节缝线,未使用者达22.58%,38.98%的人使用调节缝线的时间<5年,76.88%的人认为,复合式小梁切除术巩膜瓣可调节缝线的使用降低了小梁切除的并发症,66.4%的人认为可调缝线的使用提高了小梁切除术后远期成功率。
目前可调整缝线技术有多种,均为术后根据患者眼压、前房深度、滤过泡情况适时拆线,对患者术后随访依从性以及临床医生对拆线时机的把握都有一定要求。近年来,国内外部分学者针对可调整缝线在降低小梁切除术后并发症、术后眼压控制等方面是否具有优势进行了研究,相关文献报道开始出现争议。1994年尹金福[12]等在一个小样本(每组10只眼)的随机对照研究中发现,巩膜瓣可调整缝线组较对照组术后平均8个月内的随访眼压控制更好(12.5±2.85 vs.17.8±2.6)mmHg,对照组发现了4只眼脉络膜脱离,而可拆除缝线组无并发症发生。Kolker等[13]认为,联合可调整缝线的滤过手术对原发性开角型青光眼患者术后1 年的平均眼压或眼压控制成功率上没有作用。梁凌毅[14]等回顾分析中山眼科中心1990~2000年由同一名医生手术的原发性开角型青光眼或原发性闭角型青光眼而首次接受小梁切除术的病例329例(408只眼),发现可调整缝线可以明显减少术后浅前房的发生率,由未使用可调整缝线时的40%降低到25%。来自国内4个眼科中心小梁切除联合可调整缝线治疗原发性闭角型青光眼的随机对照临床试验显示,术后2周到18个月,不同时间点眼压可调整缝线组与对照组相比差异无统计学意义,两组间条件成功率基本相当(91.9% vs. 88.2%),可调整缝线组的绝对成功率(92%)高于对照组(84%),差异无统计学意义,并发症发生率两者相当[15]。梁远波等可调整缝线联合小梁切除术治疗原发性闭角型青光眼的随机对照临床试验结果显示,可调整缝线组在术后3个月内的眼压控制和术后并发症方面优势不明显。且该研究使用的可调整缝线法由于可能导致的角膜屈光改变加重了早期视力下降或波动以及不适感[2]。
本研究中,实验组采用改良小梁切除术,仅通过术中准确调整巩膜缝线松紧度调控滤过量,未予以可调整缝线,对照组采用可调整缝线技术,两组患者术后1周、1个月、3个月、6个月时间点眼压未见统计学差异(均P>0.05),手术成功率基本相当(P>0.05);两组滤过泡形态情况比较,差异未见统计学意义(P>0.05);实验组术后6个月并发症发生率与对照组相近,未见显著性差异(均P>0.05);术后平均抗青光眼药物种数,实验组低于对照组,差别具有统计学意义(P<0.05)。以上提示,改良小梁切除术组,在术后6个月眼压控制、术后并发症、术后功能性滤过泡发生率及手术成功率方面与联合可调整缝线技术的小梁切除术组相当,在减少术后抗青光眼药物数量及简化治疗过程方面具有一定优势。
联合可调整缝线技术的小梁切除术中,虽然术者在缝合巩膜瓣时会尽可能尝试达到滤过平衡,但是仍有部分患者会因为巩膜瓣所提供的压力过弱而使房水的滤过量超过预期;如术者担心滤过过强,可能会缝合巩膜瓣针数较多或结扎过紧,导致滤过不足,术后持续观察眼压,酌情拆除可调整缝线,但过量或者不足的滤过都会影响治疗及预后;此外临床中发现,部分联合可调整缝线的小梁切除术后患者或因经济、交通等问题,术后复诊不及时甚至失访,导致医师无法及时拆除可调缝线,眼压再次升高,贻误病情。因此,如何术中对滤过量进行准确调控,简化术后治疗及随访过程,是本研究关注的焦点。目前国内有部分学者提出,是否眼科医生可选择不使用可调整缝线,而是通过调节巩膜瓣缝线的松紧而调控滤过量[15-17]。基于以上思路我们进行了改良小梁切除术治疗PACG的随机对照临床试验。在改良小梁切除术中,术者在巩膜瓣两针缝合后,自辅助切口向前房内缓慢匀速注水形成前房,如果前房不能形成,或注水后迅速变浅,考虑滤过过畅,需要适度收紧线结后再向前房内注水测试;如果前房缓缓变浅后维持适当深度而不消失,房水自巩膜瓣下向外缓慢渗漏,观察1 min后前房稳定,则表明缝线松紧合适。剪线埋线结,密球筋膜及结膜。这种技术操作步骤明确,通过术中预调整巩膜瓣缝线的松紧度调控滤过,缝合后线结不外露,无明显眼表刺激症状,术后不需要调整缝线松紧度,亦不需要拆线或者激光断线,简化了治疗及随访过程,值得在临床中推广。
本研究中研究人群排除了眼轴小于21 mm的患者,对于这部分具有浅前房高风险的人群,可拆除缝线是否在控制眼压及减少并发症等方面更具有独特优势,需要进一步随机对照研究;本研究中的手术医生为有经验的青光眼专科医生,手术操作严格标准化,而对于经验较少的年轻医生,术中对滤过量的把控可能存在较大的操作难度,因而推测可拆除缝线技术对于具有浅前房高风险的患者或者经验不足的初学者可能具有优势。本研究仅随访至术后6个月,这种新型手术方法对患者术后长期眼压的控制、手术并发症的发生率等影响,尚需要进一步追踪观察。

