一株荒漠产油微藻的筛选及其生长和产油的pH响应
戴文娜,童 旭,张 琴,蒋 卉,李艳宾
(1.安徽工程大学 生物与化学工程学院,安徽 芜湖 241000; 2.塔里木大学 生命科学学院,新疆 阿拉尔 843300)
微藻具有光合作用效率高、生长周期短、不占用耕地、可利用废水生长、油脂含量高等优点,近年来微藻生物柴油作为第三代生物质能源备受国内外广泛关注[1-2]。据估计,自然界有5万多种微藻,但只有百余种得到较好的开发利用[3],从自然界筛选高产油藻株仍是微藻生物柴油研究开发的重点和基础[4]。特殊环境往往蕴藏着特殊的生物资源,近年来从荒漠等极端环境中筛选抗逆藻株逐渐受到研究者的重视。荒漠恶劣的生存环境使得该地区微藻通常具有抗辐射、抗盐碱、耐受温度变化等高抗逆性和较好地适应环境变化的特点[5-6],与其他微藻相比,更适合于大规模室外培养,特别是在利用不能耕种的荒漠和盐碱滩涂地作为培养基地方面有重要的应用潜力[5-7]。
微藻生长与油脂积累受光照、温度、营养、pH等诸多环境因素的影响[8-9],其中pH是微藻培养中最关键的环境条件之一,其决定了CO2和营养物质的溶解度和可利用性,对微藻生长和胞内产物的形成有重要影响[10-11]。有研究指出,一些小球藻、栅藻等在高pH下培养,胞内油脂积累得更快[12-13],在此环境中微生物的多样性也相对较低,因此有利于对耐高pH产油微藻进行室外开放培养[14]。但另一方面,高pH也将一定程度限制CO2的可利用性,从而抑制细胞生长[10]。每种微藻都有一个最佳的pH范围适于细胞生长和油脂积累,且该pH范围较窄,并具有菌株特异性,难以得出最优pH的一般规律[10]。因此,对于特定的微藻,探明pH对其生长和油脂积累的影响,并合理控制藻液pH,是促进微藻快速生长并大量积累油脂的重要保证。
新疆是典型的大陆性干旱气候区,吴蕾等[15]曾对该地区的微藻进行了广泛调查,共鉴定出陆生藻77种、水生藻272种,表明该地区有丰富的藻类资源。目前为止,针对我国荒漠地区微藻的研究,大多仍集中在微藻资源的收集[16]、鉴定[17]、群落分析[15,18]等阶段,也有少数以荒漠化治理为目的开展了相关研究[19-20],但将荒漠微藻用于开发生物能源相关的系统研究仍鲜有报道。积极开展荒漠产油微藻资源的收集与筛选,对微藻生物柴油的开发应用将起到重要的推动作用。本研究从新疆塔里木盆地荒漠盐碱水滩中分离得到一株产油微藻,在分析其生长与产油特性的基础上,进一步对该藻株进行了鉴定,并探讨了pH对微藻生长和油脂积累特性的影响,以期为荒漠产油微藻资源的开发利用提供参考。
1 材料与方法
1.1 实验材料
1.1.1 水样
本实验分离微藻所用水样采自新疆塔里木盆地荒漠盐碱水滩(N40°38.198′,E81°53.145′),该水滩为地下渗水,地表无注入水源,水面有少许油膜,水滩周围有少量芦苇,测得该水pH为7.8。用25号浮游生物网将表层水进行浓缩,置于30 mL水样瓶保存。
1.1.2 培养基及培养条件
藻种分离及培养所用培养基以BG11培养基为基础加以改良:葡萄糖10 g、KNO31.25 g、KH2PO41.25 g、MgSO4·7H2O 1 g、FeSO4·7H2O 0.05 g、CaCl2·2H2O 0.111 g、EDTA 0.5 g、H3BO30.114 2 g、MnCl2·4H2O 0.014 2 g、Na2MoO40.007 1 g、CuSO4·7H2O 0.015 7 g、CoSO40.001 g、水1 000 mL,pH 7.0,115℃灭菌20 min。固体培养基添加琼脂粉18 g/L,藻种分离培养基加30 μg/mL硫酸链霉素。
微藻基本培养条件:温度28℃,光照强度5 000 lx,光照周期12 h/12 h。
1.1.3 试剂与仪器
葡萄糖、KNO3、KH2PO4、MgSO4·7H2O、FeSO4·7H2O、CaCl2·2H2O、EDTA、H3BO3、MnCl2·4H2O、Na2MoO4、CuSO4·7H2O、CoSO4、NaOH、HCl、DMSO、甲醇、氯仿,均为分析纯;尼罗红(≥98%),Sigma公司。
AR1140电子天平,奥克斯国际贸易(上海)有限公司;PHS-3C精密pH计,上海虹益仪器仪表有限公司;SW-CT-CF超净工作台,上海博讯实业有限公司医疗设备厂;TD6M低速离心机,湖南凯达仪器科学仪器公司;DK-8D数显恒温水浴锅,金坛市医疗仪器厂;DM1000 双目正置生物显微镜,徕卡;BX53荧光数码显微镜,奥林巴斯;GZX-80B光照培养箱,上海力辰邦西仪器科技有限公司;DHG-9053A鼓风干燥箱,上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 微藻分离与产油微藻筛选
采集的水样经6 000 r/min离心10 min,弃上清液,于液体分离培养基中富集培养3~5 d,每天定期摇晃1次。而后在固体培养基上进行划线培养,并挑取单藻落反复划线纯化,在光学显微镜下检测微藻形态,同时采用尼罗红染色法[21]对微藻细胞油脂含量进行定性检测,选择生长良好、产油量高的纯藻株,接种至斜面,4℃下保藏。
1.2.2 产油微藻的培养
将配制好的培养基分装至150 mL培养瓶中,每瓶装30 mL,灭菌后进行微藻活化与培养。用接种环挑取4~5环藻细胞至培养基中进行微藻活化,培养 7 d 后按10%(体积比)接种量接种至新鲜培养基中培养,每2 d取样用血球计数板计藻细胞数,并测定微藻细胞油脂含量。
1.2.3 尼罗红染色法定性检测微藻细胞油脂含量[21]
挑取适量微藻细胞悬于200 μL无菌生理盐水中,依次加入尼罗红染液3 μL、二甲基亚砜(DMSO)75 μL,振荡混匀,40℃下恒温保持10 min,然后6 000 r/min离心10 min,去掉上清液,以无菌生理盐水混匀后离心,反复洗涤4次,最后加入200 μL生理盐水,混匀后制片,在荧光显微镜下观察。荧光强弱可反映微藻细胞内油脂含量的高低。
1.2.4 微藻细胞油脂含量定量测定及油脂产量、油脂产率计算
取两瓶培养至一定时间的培养液,均以6 000 r/min离心10 min,沉淀用蒸馏水反复洗涤3次,得到湿藻体,其中一瓶的湿藻体烘干至恒重,另一瓶的湿藻体用于油脂含量的测定。采用氯仿-甲醇法测定油脂含量:向湿藻体中添加盐酸(按每克湿藻体加10 mL 4 mol/L的盐酸),振荡混匀,室温下处理一定时间后,沸水浴3~5 min,立即置于-20℃速冷,冷却后,加入与盐酸等体积的甲醇,振荡2 min混匀,再加等体积氯仿,振荡2 min,6 000 r/min离心10 min,收集下层氯仿层,再加入等体积的 0.15%氯化钠溶液,混匀后6 000 r/min离心10 min,收集下层氯仿层,在旋转蒸发仪上蒸除氯仿,于80℃烘至恒重,记录质量。按下式计算油脂含量、油脂产量和油脂产率。
油脂含量=油脂质量/藻体干重×100%
油脂产量=油脂质量/藻液体积
油脂产率=油脂质量/(藻液体积×培养时间)
1.2.5 产油微藻分子生物学鉴定
微藻培养至对数生长期后,6 000 r/min离心10 min,收集藻细胞。取100 mg藻细胞,在无菌研钵中用液氮研磨,用DNA 提取试剂盒(EasyPureTM Plant Genomic DNA Kit)提取微藻总DNA,用ITS1/ITS4通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′)PCR扩增其ITS序列,送至生工生物工程(上海)股份有限公司测序。测序结果在GenBank上进行BLAST同源序列搜索,挑选相关近源藻序列,用ClustalW软件进行多序列对齐,并用MEGA 6.05软件以相邻法构建其系统发育树,重复1 000次计算bootstrap值。
1.2.6 数据处理
实验数据均平行测定3次,采用SPSS 18.0和Origin 8.5软件进行统计分析、作图。
2 结果与分析
2.1 荒漠产油微藻的分离筛选
从采集的水样中共分离到10余株纯藻株,根据镜检及其生长特征,初步鉴定均为绿藻,其中大部分为小球藻,有4株疑为实球藻、空球藻和栅藻。从尼罗红染色结果观察来看,所有微藻均能检测到不同强度的红色荧光,其中一株编号为DT025的小球藻荧光发射强度最高(见图1),故选择该藻株进行后续实验。该藻以单细胞状态存在,藻落呈绿色奶油状、扁平形,初步判断为小球藻。

图1 荒漠产油微藻DT025普通光及尼罗红染色荧光激发照片
2.2 微藻DT025的生长及油脂积累特性
荒漠产油微藻DT025按1.2.2方法活化、培养,其生长曲线及油脂积累特性见图2。

图2 荒漠产油微藻DT025的生长曲线与油脂积累特性
从图2可以看出:培养前2 d,微藻DT025的生长趋势相对较缓,可视此阶段为延缓期,但从细胞数量上来说,培养2 d时微藻细胞增长了几乎1倍,说明微藻DT025能较好地适应培养环境,在本实验培养条件下延缓期不明显;培养2~8 d,微藻细胞近指数增长,此阶段为对数生长期;培养8~10 d,微藻细胞增长变缓,此阶段为平稳期,此后微藻细胞数量变化不大,增长缓慢。
从图2还可以看出:在培养前8 d,微藻细胞油脂含量逐渐升高,特别是从培养4 d起,油脂含量增加迅速,此时对应微藻对数生长期,表明在此培养条件下,微藻油脂积累在时间上与微藻细胞生长同步,这与其他报道[11,22]的结果类似,可能是在培养过程中,除了细胞增殖,微藻还利用培养基中的碳源进行油脂的合成[11];培养8 d时微藻细胞油脂含量达到峰值(37.13%),此后油脂含量呈现小幅波动下降,但整体上维持在30%左右,直到培养18 d时油脂含量又有一定幅度上升。从生长及油脂积累特性来看,微藻DT025生长迅速,含油量较高,具有较好的开发利用价值。
2.3 微藻DT025的分子生物学鉴定
将按1.2.2方法培养7 d的微藻DT025,按1.2.5方法用通用引物对其ITS序列进行PCR扩增并测序,获得扩增序列长度为787 bp,该序列已提交GenBank,登录号为MN 328729。挑选部分相似序列与该藻系列构建系统发育树(见图3),结果发现,微藻DT025与小球藻Chlorellasp. SLA-04、Chlorellasp. Rys、ChlorellasorokinianaUTEX246聚为一类,同源性均在99%以上,其中与Chlorellasp. SLA-04同源性达99.59%。综上,将微藻DT025鉴定为小球藻,命名为Chlorellasp. DT025。

图3 基于ITS序列的荒漠产油微藻DT025系统发育树
2.4 pH对Chlorella sp. DT025生长及油脂积累的影响
采用磷酸盐缓冲液和硼砂缓冲液将培养基pH分别调节至6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5,然后按1.2.2方法对Chlorellasp. DT025进行活化、培养,考察Chlorellasp. DT025在不同pH下的生长及油脂积累情况,结果如图4所示。
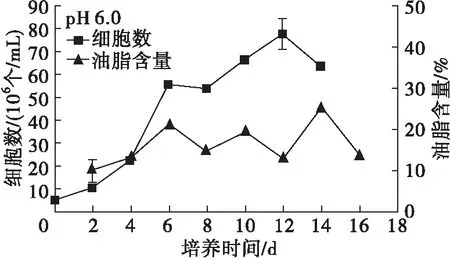
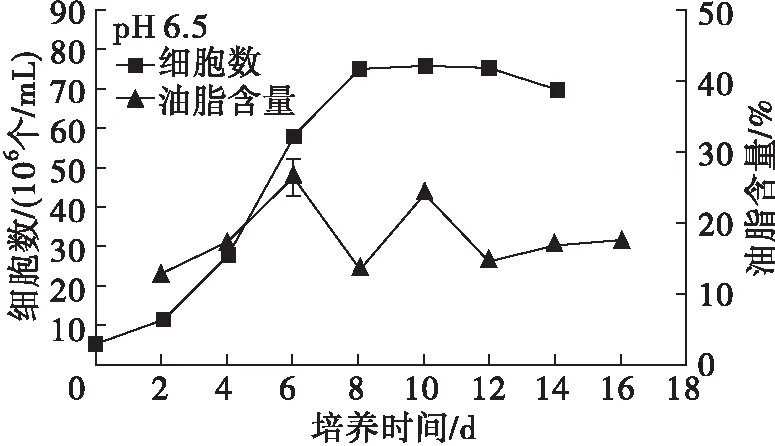
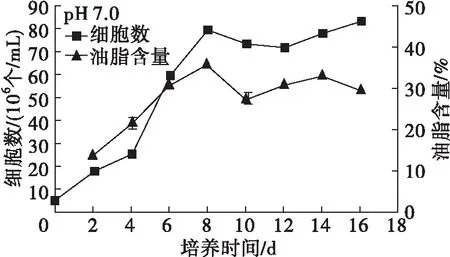
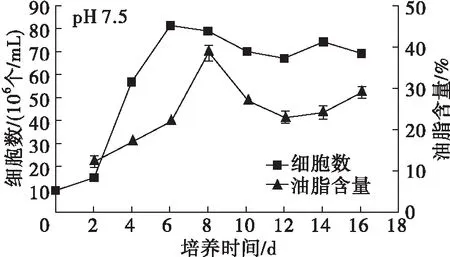




图4 pH对Chlorella sp. DT025生长及油脂积累的影响
从图4可以看出,在pH 6.0~9.0范围内,微藻DT025均能较好地生长,说明其具有较宽的pH耐受范围。另外,在pH 6.0~9.0范围内,微藻DT025的生长表现出相似的趋势,总体在培养2 d起,细胞数量快速增长,进入对数生长期, pH 7.5和pH 8.0在培养6 d时进入稳定期, pH 6.5、7.0、8.5在培养8 d时进入稳定期,而pH 6.0、9.0则生长相对较缓,分别在培养12、14 d时达到峰值进入稳定期,说明pH过高或者过低,均会对微藻的生长造成较大影响。此外,pH 9.5时微藻的生长几乎处于停滞状态,细胞数相比接种时无明显变化,能观察到微藻有明显的絮凝沉降,表明该微藻不适合在pH大于9.5的环境中生长。
从图4还可以看出:在培养前4 d,各pH下微藻细胞的油脂含量普遍较低,之后随培养时间的延长,除了pH 6.0,其余pH的微藻细胞油脂含量均迅速增加,达到峰值后逐渐呈现降低趋势,这与前述微藻油脂积累特性分析结果一致。在培养周期内,pH 6.0时微藻细胞油脂含量较低,增加缓慢,说明低pH不利于油脂积累。高pH时微藻细胞油脂含量普遍要高于低pH时的,在pH 9.5时微藻细胞油脂含量最高,培养10 d可达到46.93%,说明高pH胁迫有利于油脂积累,这与已有研究报道[12-13]结论一致。
胁迫环境下如何平衡微藻产油量和生长量之间的关系是微藻油脂开发的重要问题[23]。虽然在pH 9.5时微藻细胞油脂含量高,但此时微藻细胞数量很少,这将影响最终的油脂产量。为比较微藻在不同pH时的产油能力,计算了不同pH时微藻在稳定期的油脂产量和产率,结果见表1。
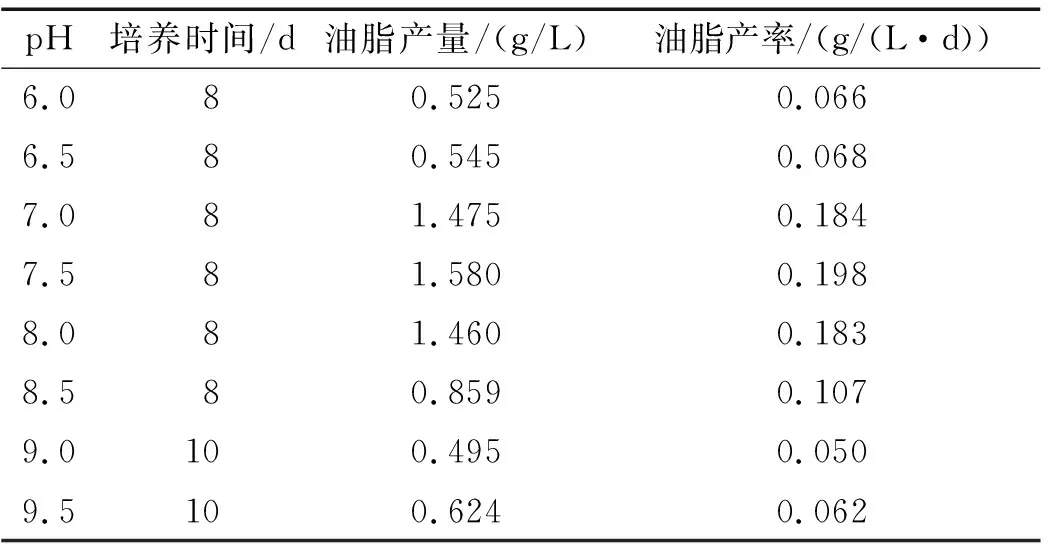
表1 不同pH时Chlorella sp. DT025的油脂产量与产率
由表1可知,在pH 7.0~8.0时,微藻的油脂产量及产率均比较高,说明该藻适宜培养产油的pH在7.0~8.0之间,其中pH 7.5条件下,微藻的油脂产量与产率均为最高,分别为1.580 g/L、0.198 g/(L·d)。此外,在pH 8.0、8.5时,微藻的油脂产量和产率也分别达到了1.460 g/L、0.183 g/(L·d)和0.859 g/L、0.107 g/(L·d),体现出该藻良好的碱耐受能力。
3 结 论
从新疆荒漠盐碱水滩中分离得到一株产油微藻DT025,该藻能较好地适应培养环境,培养2 d起快速生长,4 d起开始大量积累油脂,具备较好的开发利用价值,经分子生物学鉴定为小球藻Chlorellasp.。该藻pH耐受范围较宽,适于培养产油的pH范围为7.0~8.0,其中pH 7.5时产油能力达到最高。

