1株禽4型腺病毒JS株的分离鉴定
陈雨晴,曹洁,王玉峰,宋素泉,闫丽萍
(教育部动物健康与食品安全国际联合试验室/江苏省动物免疫工程试验室/江苏省陆生野生动物疫源疫病检测中心/南京农业大学免疫研究所/南京农业大学动物医学院,江苏 南京 210095)
禽腺病毒(fowl adenovirus,FAdV)属于禽腺病毒科禽腺病毒属成员,是呈二十面体对称的无囊膜双股DNA病毒[1-2]。它由核蛋白、衣壳蛋白以及非结构蛋白构成。其中Hexon是病毒表面含量最多的蛋白,常用于做禽腺病毒的进化分析[3]。根据血清交叉中和试验和基因组分析显示禽腺病毒可分为A~E 5个种,12个血清型(1~7、8a、8b、9~11)。其中,血清1型(fowl adenovirus serotype 1,FAdV-1)和血清4型(fowl adenovirus serotype 4,FAdV-4)主要引起禽类的肌胃糜烂或溃疡和心包积液肝炎综合征(hydropericardium hepatitis syndrome,HHS)。而血清2、7、8a、8b、11型则在世界范围内引起包涵体肝炎(inclusion body hepatitis, IBH)[4]。HHS在鸡群中的感染率很高,其中肉鸡的死亡率在10%~100%之间[5]。该病一般发生于3~5周龄肉鸡中,其症状主要表现为心脏表面被黄色透明液体包裹,心脏畸形且变软,心包黄染伴有出血点。一般患有心包积液的病鸡其肝脏也伴有病变,如肝脏肿大充血、肾脏肿大出血等[6]。
禽腺病毒主要感染蛋鸡、肉鸡、鹅和鸵鸟。2007年之前,IBH在我国多呈散发,并未造成严重损失;2007至2014年,IBH呈地方性流行,个别鸡场发病率可达30%,死亡率15%;从2015年开始,FAdV-4在我国大范围流行并引起了IBH和HHS,造成鸡群大量死亡,给养鸡业带来了巨大的经济损失[7]。经流行病学分析显示FAdV-4主要在我国北部和东部流行[8]。由于有一些弱毒感染鸡群后不导致鸡群发病,而水禽又是FAdV的天然储存库,这些因素可能是导致FAdV-4大流行的原因[1]。2015年以来已有一些文献报道了高毒力禽腺病毒,但其研究大多在流行病学调查、进化分析以及治疗上[9-10],少有文章对病毒的致病力进行研究。本研究从江苏省某发病鸡场分离获得1株禽腺病毒,并将其分离后进行致病性试验,为进一步预防和治疗该病提供试验依据。
1 材料与方法
1.1 病毒株及试验动物
取病鸡肝脏0.1 g用无菌PBS进行研磨,制备成肝脏组织匀浆后-20 ℃反复冻融3次,12 000 r/min 离心10 min,取上清液-80 ℃保存备用。将上清液1∶1 000感染鸡肝癌细胞(LMH),48 h后80%细胞变圆脱落,收集上清冻于-80 ℃。21日龄SPF鸡由广西丽原生物有限公司提供。
1.2 主要试剂
DMEM粉末购自Gibco公司;Phanta Max Super-Fidelity DNA Polymerase和HiScript II One Step qRT-PCR SYBR Green Kit购自Vazyme公司;FITC标记的羊抗鼠IgG购自KPL公司;引物由南京金斯瑞生物科技公司合成。
1.3 细胞培养与病毒分离
LMH用含10%血清的DMEM培养液培养。将处理好的病料接种于长满单层的LMH细胞,在37 ℃吸附1 h后弃上清,加入细胞维持液(DMEM+ 2%FBS),于37 ℃ 5%CO2培养箱培养,逐日观察细胞病变(CPE),连续在LMH细胞上传代3次后,将病毒进行扩大培养并进行致病性试验。
1.4 病毒DNA的提取
将病毒按1∶1 000接种LMH细胞,待80%左右细胞出现病变后,将细胞冻融2次后分装于保种管中,按上海生工柱式病毒DNA提取试剂盒说明提取DNA,于-40 ℃保存。
1.5 FAdV-4 Hexon基因的PCR和序列测定
以GenBank中的FAdV-4全基因组序列(GenBank登录号KU558760)为参考,使用Primer Premier 5软件,设计覆盖Hexon基因的引物(Hexon-F:5′-ATGGCGGCCCTCACGCCCG-3′;Hexon-R:5′-TTACACGGCGTTGCCTGTGGCGAAA-3′),扩增片段大小为2 814 bp。引物由南京金斯瑞生物科技公司合成。以提取的病毒DNA为模板,加入合成的引物,按照Phanta Max Super-Fidelity DNA Polymerase说明书配置50 μL PCR体系进行Hexon结构蛋白基因DNA的扩增。PCR结束后,用1%琼脂糖凝胶电泳跑胶鉴定,切下目的条带,按照AXYGEN琼脂糖凝胶回收试剂盒操作说明进行DNA的回收。将回收的基因片段送上海生工生物技术有限公司进行测序。
1.6 FAdV-4 Hexon基因序列进化树分析
利用MEGA 7.0软件将分离株的Hexon基因核酸序列与GenBank收录的不同时期和地点的禽腺病毒的核酸序列进行遗传演化分析。具体参考毒株信息见表1。
表1 参考毒株信息
毒株血清型基因型GenBank登录号年份国家ON1C4GU188428.12011加拿大JSJ13C4KM096544.12013中国HB1510C4KU587519.12016中国HNJZC4KU5587602015中国SCnj1601C4KY927938.12018中国SDJN0105C4MN1024132019中国SCcz1501C4KY9279362017中国HNSQC4KX640910.12016中国PK-01C4EU931693.12008印度KR5C4HE608152.12012澳大利亚U26221.1C10U26221.12000美国K181/10A1JN181575.12012韩国CELOA1U46933.11996澳大利亚340B5KC493646.12013澳大利亚X11D11AF339920.12001比利时764D9AF508958.22004比利时685D2AF508947.12004比利时CR119E6AF508954.22016比利时
1.7 病毒滴度的测定
LMH细胞传至96孔板细胞单层80%~90%,将病毒液稀释至10-2~10-10,每一稀释度接种8孔,每孔100 μL,对照组加100 μL细胞营养液,37 ℃孵育1 h后换成含2%FBS的DMEM培养液,观察3~5 d,记录细胞病变情况,按Reed-Muench法计算TCID50。
1.8 病毒的生长动力学测定
按MOI=0.01的病毒量接种长满单层LMH细胞的12孔板,置于37 ℃、5%CO2细胞培养箱中培养,1 h 后换成含2%FBS的DMEM培养液,分别在接种病毒后的不同时间点(12 h、24 h、36 h、48 h、60 h、72 h、84 h)收取细胞上清,37 ℃反复冻融3次,12 000 r/min 离心15 min,收取上清液,测定每个时间点收取上清的TCID50,共重复3次。
1.9 病毒对鸡的致病性试验
选用纯化后第4代毒株测定分离株对21日龄SPF鸡的致病力,测定时分别各选取SPF鸡30只,随机分成3组(表2),每组10只,采取肌肉注射或口服方法分别用含有106.0个TCID50的病毒液进行攻毒。观察14 d,记录临床症状和鼻、咽拭子排毒情况。采集的鼻拭子放入1 mL PBS中,冻融一次后,充分振荡,4 ℃ 12 000 r/min离心15 min,取上清液提取DNA,进行qPCR检测是否排毒,引物5′-AGTGTGTATGTGCGTTGGGTAG-3和 5′-CATTGTCATAACGATGGTGTAG-3′[11]。
表2 FAdV-4 动物试验分组

组别毒种毒量接种方式ⅠPBS-肌注5只,口服5只ⅡF4200μL 106.0TCID50肌注ⅢF4200μL 106.0TCID50口服
2 结果
2.1 病毒分离与纯化
肝组织样品处理液接种于长满单层的LMH细胞36 h后就能观察到细胞病变,病变细胞初期呈网格状,病变范围逐渐扩大,细胞出现融合,有明显的合胞体,最后变圆脱落,待病变稳定后获得一株纯化的病毒,命名为JS株。
2.2 病毒Hexon基因序列分析
以提取的分离株病毒DNA为模板,用合成的引物分别扩增出2 814 bp大小的特异性条带,测序结果表明是FAdV-4 Hexon基因序列,与GenBank收录的不同时期和不同地点分离的FAdV-4 Hexon的基因进化树分析(图1),结果显示:毒株FAdV-4 JS与我国主要流行的Ⅰ群禽腺病毒C基因型毒株(CH/HNJZ/2015、JSJ13、SDJN0105、HNSQ、HB15101、SCnj1601等)以及印度株PK-01的同源性最高,在同一分支上;与加拿大分离株ON1以及澳大利亚分离株KR5共属于一个大的分支,同源性为96%。表明JS株为我国FAdV-4国内流行株。

图1 FAdV-4 Hexon基因进化树分析
2.3 病毒的生长动力学
FAdV-4 JS株在LMH细胞上生长良好,以0.01 MOI接种病毒72 h后病毒滴度为107.0TCID50/0.1 mL,最高达到108.0TCID50/0.1 mL(图2)。
2.4 对鸡的致病性
第Ⅱ组鸡从攻毒后第2天开始有发病死亡,其中死亡2只,其他7只鸡均有不同程度的精神萎靡,沉郁等症状;攻毒后第3天又死亡7只,另1只有精神轻度沉郁,且随时间推移,该鸡恢复正常,死亡率为90%。第Ⅰ组和Ⅲ组鸡没有出现任何症状,死亡率为0。对其进行打分并绘制折线图,其中精神,无症状0分,轻度沉郁1分,非常沉郁2分,极度虚脱3分,死亡4分,结果见图3。
解剖病死鸡,发现第Ⅱ组鸡均有不同程度的心包积液,肝脏黄染肥大,肾肿大且有点状出血,脾脏出血肿大等明显症状。剖检第Ⅲ组鸡,发现其肝脏黄染,但其他部位未见明显病变。
试验结束后每组随机挑选3只剖杀,对其心、肝、脾、肺、肾以及气管、法氏囊进行荧光定量试验,结果显示:病毒主要靶器官为肝脏,且肌肉注射比口服感染效果更严重,口服感染组的病毒RNA载量基本在检测线(100拷贝数/mg)附近(图4)。
在攻毒后第1、3、5、7、9、11、13天采集咽肛拭子,进行荧光定量检测其排毒情况,结果显示攻毒后第Ⅱ组与第Ⅲ组鸡的咽肛拭子均有排毒,其中第Ⅱ组鸡的排毒情况在攻毒后第3~5天到达排毒高峰期,随后降低(表3)。

图2 JS株在LMH细胞上的生长曲线
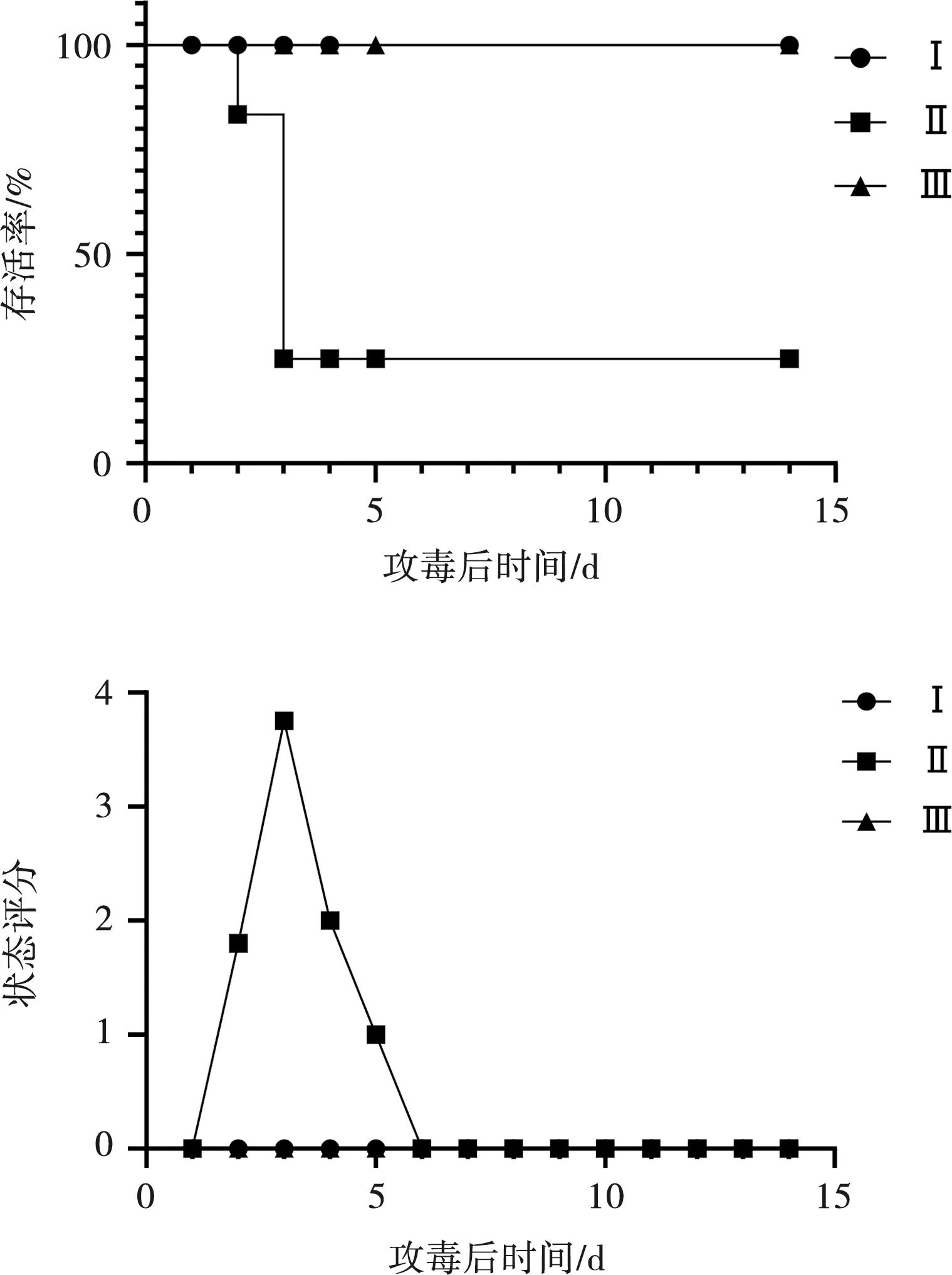
图3 SPF鸡存活率(上)及状态评分分析(下)
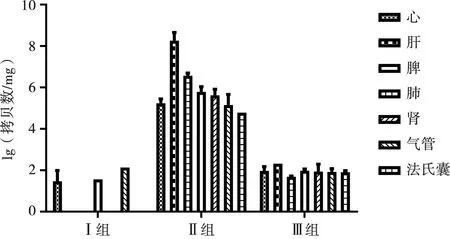
注:拷贝数低于100拷贝数/mg为阴性
图4 病毒的组织分布情况
表3 攻毒后咽肛拭子排毒情况
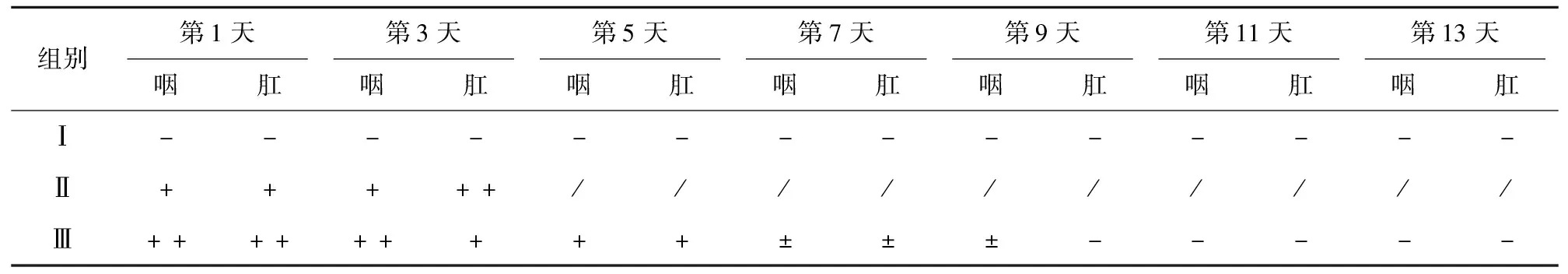
组别第1天第3天第5天第7天第9天第11天第13天咽肛咽肛咽肛咽肛咽肛咽肛咽肛Ⅰ--------------Ⅱ+++++//////////Ⅲ+++++++++±±±-----
注:“/”表示第Ⅱ组仅剩1只鸡,数据不具有代表性。“++”表示强阳性,荧光定量计算的拷贝数大于1 000拷贝数/mg;“+”表示弱阳性,荧光定量计算的拷贝数在100~1 000拷贝数/mg;“±”表示弱阳性,荧光定量计算的拷贝数在100~150拷贝数/mg;“-”表示阴性,荧光定量计算的拷贝数小于100 拷贝数/mg
3 讨论
2013年以来我国出现FAdV-4感染的疾病报告,且在2015年暴发心包积液肝炎综合征。本研究室2017年从江苏省某发病鸡场分离获得1株4型禽腺病毒,命名为JS株。经过序列比对发现其与我国近期流行株相似。同时,通过测定了病毒的生长曲线,发现它可以很好地在LMH细胞上繁殖,病毒滴度高达108.0TCID50/100 μL,但从河南省感染的病禽肝脏组织中分离的HNJZ株在LMH上的毒价仅为106.5TCID50/100 μL[11]、SD0828在鸡胚成纤维细胞上的毒价为105.3TCID50/100 μL[12]、SD1511在鸡胚肾细胞上的毒价为103.2TCID50/100 μL[13]以及SDJN0105株在鸡胚上的毒价为105.0TCID50/100 μL[3],这些毒株均没有本次分离的JS株毒价高。本试验分离到1株在LMH细胞上生长良好的病毒株,有助于后续进行灭活疫苗的研究。将F4代病毒通过肌肉注射或口服感染的途径对21日龄SPF鸡进行攻毒,发现口服感染组的鸡群并没有产生精神沉郁或死亡症状,解剖后观察到鸡的肝脏黄染,并无其他变化;而肌注组的SPF鸡在攻毒后24 h已出现轻度沉郁的症状,并在攻毒后3~5 d达到死亡高峰,引起了90%的死亡率。剖检可看到很明显的心包积液症状。这与已报道的CH/HNJZ/2015株的致病力有所不同[11]。尽管JS株与CH/HNJZ/2015株在Hexon基因水平上同源性达99%,但口服感染后呈现出不同的致病力,其中CH/HNJZ/2015株口服感染0.2 mL 105.0TCID50的病毒后,在攻毒后第5天达到100%死亡,而JS株在口服感染0.2 mL 106.0TCID50的病毒后,鸡群没有死亡也没有明显的临床症状。剖检后可看到肝脏黄染,无心包积液。2株病毒在Hexon基因水平上同源性高却有不同的致病力,可以考虑可能是其他基因水平上的差别导致了两株病毒毒力的不同。
已有研究通过不同感染方式调查FAdV-4对鸡的致病力,发现口服感染致病力低于肌肉感染,这可能是由于口服感染时消化道对病毒具有一定的消化作用,影响了病毒的活性及在机体内的吸附作用[6,13]。本试验在2种感染方式的鸡的咽拭子中都检测到了排毒,这也证实了该病毒可能经空气-消化道传播[13]。
对腺病毒在鸡体内的分布情况也进行了研究,发现肝脏中的病毒含量最高,且各组织脏器中病毒均有分布,这与其他研究结果一致,这也解释了为何FAdV-4可在LMH细胞上更好繁殖。口服感染组鸡没有死亡但咽拭子也有排毒情况,说明不同的感染方式对鸡的致病力不同,这一点与已有文献报道相同[14]。本研究分离获得了1株在LMH细胞上具有较高病毒滴度和高致病力的FAdV-4,为后续研究JS株的致病机理及制备针对FAdV-4的灭活疫苗奠定基础。

