传染性法氏囊病病毒主要结构蛋白VP2、VP1和VP2-VP1串联基因的原核表达及其初步应用
王威威,刘婷,陈果,姬忠华 ,赵增志,黄宇,陈艳艳,石梦雅,何秀苗*,韦平*
(1.广西大学养禽与禽病学研究所,广西 南宁 530005;2.广西民族大学海洋与生物技术学院/广西多糖材料与改良重点实验室,广西 南宁 530006)
传染性法氏囊病(infectious bursal disease, IBD)是由传染性法氏囊病病毒(infectious bursal disease virus, IBDV)引起雏鸡的免疫抑制性疾病,主要侵害淋巴组织,特别是法氏囊,并给世界养禽业造成重大经济损失[1]。已知IBDV存在2个血清型,血清Ⅰ型可引起鸡的长期免疫抑制并导致死亡,可分为经典株(classical, cIBDV)、抗原变异株(antigenic variant, avIBDV)和超强毒株(very virulent, vvIBDV),而血清Ⅱ型对鸡不致病[2]。vvIBDV于20世纪80年代出现,可从接种过疫苗的鸡群或具有母源抗体的鸡群中分离出来[3-4],当前vvIBDV毒株是我国主要流行的病毒。
IBDV是双链RNA病毒,属于双 RNA 病毒科(Birnaviridae)禽双 RNA 病毒属(Avibirnavirus),其基因组由 A、B 两个节段组成[5]。A节段编码VP2(外衣壳蛋白)、VP3(内衣壳蛋白)、VP4(蛋白酶)和VP5(非结构蛋白)[6-7]。VP2蛋白量约是病毒总量的51%,是病毒的主要宿主保护性抗原并携带所有中和表位,含有能诱导中和抗体的抗原决定簇,其诱导产生的中和抗体能被动地保护宿主免受IBDV的感染[8], 其中一些抗原决定簇被认为与抗原变异、病毒毒力和细胞凋亡有关[9]。VP1蛋白由B节段编码,具有 RNA 依赖的 RNA 聚合酶活性,与病毒RNA的复制和毒力有关,已成为众多学者研究的热点[10-11]。
目前研究人员多认为VP2具有良好的免疫原性,并已在多种表达系统成功表达了VP2蛋白,VP1基因的表达和功能研究较少[12]。前人研究发现鸡IBDV野毒株的VP2和VP1基因组片段不断发生变化并出现多种类型的重排毒株[13]。这些重排毒株的毒力和抗原性与不同来源VP1片段的重排或重组有关,并认为可通过与VP2片段协同增强病毒的毒力[14-15]。因此,本研究选择将VP2和VP1抗原性和亲水性较好的区域串联以探究串联重组蛋白的反应原性,以及为了获得IBDV特异性检测的VP2、VP1和VP2-VP1重组蛋白抗原,利用所建立的原核表达系统分别成功表达VP2、VP1和VP2-VP1串联蛋白,为IBDV特异性检测方法和新型亚单位疫苗的研发奠定基础。
1 材料与方法
1.1 病毒、菌株及IBDV阳性血清
广西地区流行代表株NN1172(GenBank ID: JQ398618 和 KC968868)为广西大学养禽与禽病研究所自行分离保存[13],该分离株抗原性和免疫保护性是近年来最好的[15];DH5α和BL21菌株购置天根生化科技有限公司;传染性支气管炎病毒(IBV)、呼肠孤病毒(ReoV)、禽白血病病毒(ALV)、新城疫病毒(NDV)和鸡抗IBDV阳性血清均为作者所在实验室制备并保存。
1.2 主要试剂
Trizol RNA提取试剂盒、HiFiScript cDNA第一链合成试剂盒购自北京康为世纪生物技术有限公司;PrimeSTAR MAX DNA Polymerase、快切酶QuickCutKpnⅠ、QuickCutXhoⅠ、QuickCutEcoRⅠ、T4连接酶均购自TaKaRa公司;通用型DNA纯化回收试剂盒、Mini Plasmid Kit、DAB显色试剂盒,购自天根生化科技有限公司;HRP标记山羊抗鸡IgY购置Abbkine公司;IPTG购自索莱宝生物科技有限公司;Ni-NTA亲和层析介质蛋白纯化试剂盒,购自金斯瑞生物公司;其他均为国产分析纯。
1.3 引物的设计与合成
根据GenBank上公布的IBDV序列,分别设计了扩增IBDV VP2、VP1和VP2-VP1串联基因的引物(见表1)。并通过DNASTAR软件分析VP2和VP1基因抗原性和亲水性相对较好的区段(VP2的1aa~223aa和VP1的690aa~881aa)。引物由上海英骏生物技术有限公司合成。
表1 IBDV VP2、VP1和VP2-VP1串联基因的扩增引物

基因引物序列(5′→3′)片段大小/bp工具酶VP2VP2-FCGCGGATCCATGACAAACCTGCAAGATCAAACCCVP2-RCGGCTCGAGCTACAGAAGATAGTCTACACCTTCCCCA1446BamHⅠXhoⅠVP1VP1-FCCCCGGTACCATGAGTGACGTATTCAACAGTCVP1-RGGCCTCGAGCTATTGGCGGCTCTCCTTCTG2643KpnⅠXhoⅠ截短VP2(P-VP2)P-VP2FCGCGGATCCATGACAAACCTGCAAGATCAAACCCP-VP2RCCCCGAATTCTGTAATTGTCACTCCACCTGCTTGG666BamHⅠEcoRⅠ截短VP1(P-VP1)P-VP1FCCCCGAATTCGAGATCCTTGCCGAACTGAACP-VP1RCCCGCTCGAGCTATTGGCGGCTCTCCTTCTG573EcoRⅠXhoⅠVP2-VP1P-VP2FCGCGGATCCATGACAAACCTGCAAGATCAAACCCP-VP1RCCCGCTCGAGCTATTGGCGGCTCTCCTTCTG1239BamHⅠXhoⅠ
注:加粗斜体代表酶切位点
1.4 重组表达质粒的构建
1.4.1 IBDV VP2、VP1和VP2-VP1串联基因的扩增
提取IBDV NN1172分离株的总RNA,以反转录的cDNA为模板,分别扩增VP1、VP2和P-VP2、P-VP1基因。用EcoRⅠ处理纯化后的P-VP2、P-VP1片段,T4连接酶连接P-VP2和P-VP1基因。以连接产物为模板,P-VP2F/P-VP1R为引物,进行PCR扩增,获得的PCR产物即为VP2-VP1串联基因。扩增IBDV VP2,VP1和VP2-VP1串联基因PCR反应体系:Mix 12.5 μL,cDNA 1 μL,各基因所对应的上、下游引物各1 μL,ddH2O 9.5 μL。反应程序为:98 ℃ 5 min;98 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,30个循环;72 ℃ 5 min。PCR产物通过1.0%琼脂糖凝胶电泳检测。
1.4.2 重组表达质粒的构建与鉴定
将目的片段VP2、VP1和VP2-VP1串联基因和表达载体pET-32a分别用BamHⅠ/XhoⅠ,KpnⅠ/EcoRⅠ和BamHⅠ/XhoⅠ双酶切后回收,用T4连接酶进行重组连接。将连接产物转化入克隆菌株DH5α感受态细胞,涂于含氨苄青霉素(100 μg/mL)的LB琼脂平板37 ℃培养过夜。经菌液PCR和双酶切鉴定正确后,将重组质粒送华大基因有限公司测序。鉴定正确的菌株分别命名为pET-VP2、pET-VP1和pET-VP2-VP1。
1.5 VP2、VP1和VP2-VP1串联基因的诱导表达
1.5.1 诱导表达及其条件的优化
将鉴定正确的重组质粒pET-VP2、pET-VP1和pET-VP2-VP1分别转化入表达菌株BL21,涂于氨苄抗性的LB平板上培养过夜,次日挑单个菌落接种到含有100 μg/mL氨苄青霉素的LB液体培养基中,于37 ℃、220 r/min条件下培养12 h,制备种子菌,所得菌种按照1%的量接种到新的含氨苄青霉素(100 μg/mL)的LB培养基中,相同条件下培养至菌液OD595=0.6,取出加入1 mmol/L的IPTG,于37 ℃ 220 r/min的恒温摇床中诱导表达,分别在2、3、4、5、6和7 h各收集1 mL菌液,经SDS-PAGE分析对诱导时间进行优化。然后以优化的最佳诱导时间,对诱导剂IPTG的浓度进行优化,IPTG浓度分别为0.05、0.08、0.1、0.3、0.5、0.8、1 mmol/L(其中诱导IBDV VP1蛋白的IPTG浓度梯度为0.01、0.03、0.05、0.08、0.1、0.3、0.5 mmol/L)。同时,在含空载体pET-32a的培养菌液中也加入诱导剂IPTG至终浓度1 mmol/L作相同处理。
1.5.2 分析重组蛋白表达形式
离心收集菌体后加入PBS重悬菌体,并加入溶菌酶至终浓度1 mg/mL,冰上放置30 min。细菌悬液于-20 ℃反复冻融3次,用超声破碎仪破碎菌体,破碎后的菌液经4 ℃,12 000 r/min 离心20 min,分别取上清和沉淀进行SDS-PAGE分析。
1.6 纯化重组蛋白
根据优化条件大量表达目的蛋白,4 ℃ 8 000 r/min离心30 min,弃上清,收获菌体。通过蛋白的粗纯化,具体方法如下:30 mL PBS重悬洗涤菌体,4 ℃,6 000 r/min 离心30 min,收集菌体;以10 mL/g菌体的比例加入PBS重悬菌体沉淀,加入溶菌酶至终浓度为1 mg/mL,混匀后冰上放置30 min;于-80 ℃反复冻融3次,超声破碎仪破碎菌体,结束后4 ℃,12 000 r/min 离心20 min,弃上清;向包涵体沉淀中加入20 mL包涵体洗涤液(50 mmol/L Tris-Cl、50 mmol/L NaCl、2 mol/L Urea、0.5%曲拉通,pH 8.0),漩涡振荡悬浮包涵体沉淀,置冰上10 min后,经4 ℃,12 000 r/min 离心20 min,弃上清收集沉淀,重复2次;向沉淀中加入40 mL包涵体溶解液(100 mmol/L Na2HPO4、10 mmol/L Tris-Cl、8 mol/L Urea,pH 8.0),重悬于50 mL的小烧杯,用磁力搅拌器于4 ℃搅拌3 h,使包涵体更加有效地溶解,4 ℃,12 000 r/min 离心20 min,收集上清。将粗纯化后的重组蛋白溶液经Ni-NTA亲和层析介质蛋白纯化试剂盒纯化(具体操作按说明书)。取Ni-NTA亲和层析纯化后的重组蛋白进行SDS-PAGE分析。
1.7 表达蛋白的Western blot分析
取纯化后的重组蛋白经SDS-PAGE分离后,经电转移至PVDF膜上,用TBST洗涤PVDF膜,然后转入5%脱脂奶粉室温封闭1 h后于4 ℃过夜封闭。用TBST洗涤3次,10 min/次,最后用TBS洗涤10 min。加入用TBST以1∶100稀释的鸡抗IBDV阳性血清,室温孵育2 h,PBST洗涤3次,每次10 min。之后加入1∶7000稀释的HRP山羊抗鸡IgY二抗,室温孵育1 h,PBST洗涤3次,每次10 min,最后TBS洗10 min,用滤纸吸干PVDF膜上的水分,暗室DAB显色,3 min后加入去离子水终止反应。
1.8 表达蛋白的特异性及其临床初步应用
以纯化的VP2、VP1和VP2-VP1重组蛋白作为包被抗原,分别检测IBV、ReoV、ALV和NDV 4种阳性血清,同时设置阳性和阴性对照,每种血清样品重复3次,以探究其特异性。并且还检测分别免疫了IBD灭活疫苗、IBD基因工程疫苗和IBD弱毒疫苗的商业鸡群的570份免疫血清,其中免疫IBD灭活疫苗和IBD基因工程疫苗的鸡群分别在免疫前和免疫后的第7、14、21、28、35、42天共7个时间点,每个时间点采集30份(免疫IBD弱毒疫苗分别在一免前(9d)、二免前(16d)和二免后的第7、14、21天共5个不同时间点, 每个时间点采集30份),以观察疫苗免疫后的抗体应答水平。此外,用该间接ELISA以及商品试剂盒A、B平行检测OD450在其临界值附近的184份血清样品,用来观察其与商品试剂盒的相对敏感性及符合率。
2 结果
2.1 重组表达质粒的构建及鉴定
琼脂糖凝胶电泳显示,成功扩增出NN1172 VP2、VP1和VP2-VP1串联基因目的条带,分别约为1 446、2 643和1 239 bp。将其克隆入原核表达载体pET-32a,经双酶切鉴定,证实获得重组表达质粒pET-VP2、pET-VP1和pET-VP2-VP1,结果分别可见约1 446、2 643和1 239 bp相应大小的外源基因和5 900 bp的线性化质粒条带(图1)。测序结果显示,扩增获得的VP2、VP1和VP2-VP1串联基因片段大小与预期结果相符,且无碱基的突变和插入。
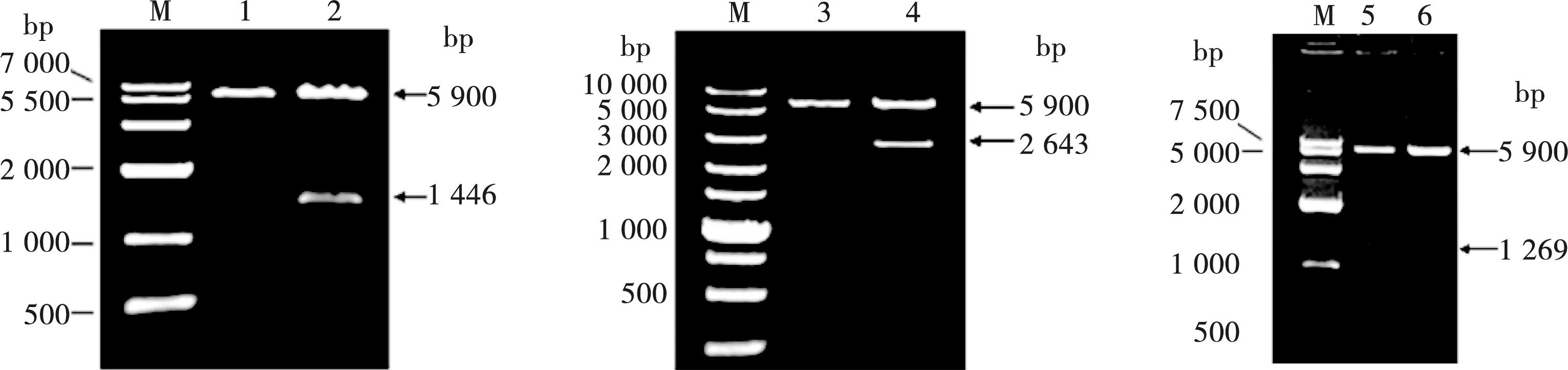
M.DNA分子量标准; 1.pET-32a经BamHⅠ+XhoⅠ双酶切产物;2.pET-VP2经BamHⅠ+XhoⅠ双酶切产物;3.pET-32a经KpnⅠ+XhoⅠ双酶切产物;4.pET-VP1经KpnⅠ+XhoⅠ双酶切产物;5.pET-VP2-VP1经BamHⅠ+XhoⅠ双酶切产物;6.pET-32a经BamHⅠ+XhoⅠ双酶切产物
图1 pET-VP2、pET-VP1和pET-VP2-VP1重组表达质粒的鉴定
2.2 诱导表达条件的优化
诱导表达时间的优化结果显示,VP2、VP1和VP2-VP1重组蛋白均在IPTG诱导2 h时开始表达,其中VP2在诱导5 h表达量最多,VP1在3 h后开始维持稳定表达,VP2-VP1在6 h表达量最多,之后无明显差别(见图2)。最佳诱导IPTG浓度优化结果显示,0.05~1 mmol/L不同诱导浓度对重组蛋白VP2、VP1和VP2-VP1的表达量没有明显的影响(见图3),为降低试验成本,后续试验选择0.05 mmol/L的IPTG对重组蛋白进行诱导表达。
2.3 表达蛋白的可溶性分析
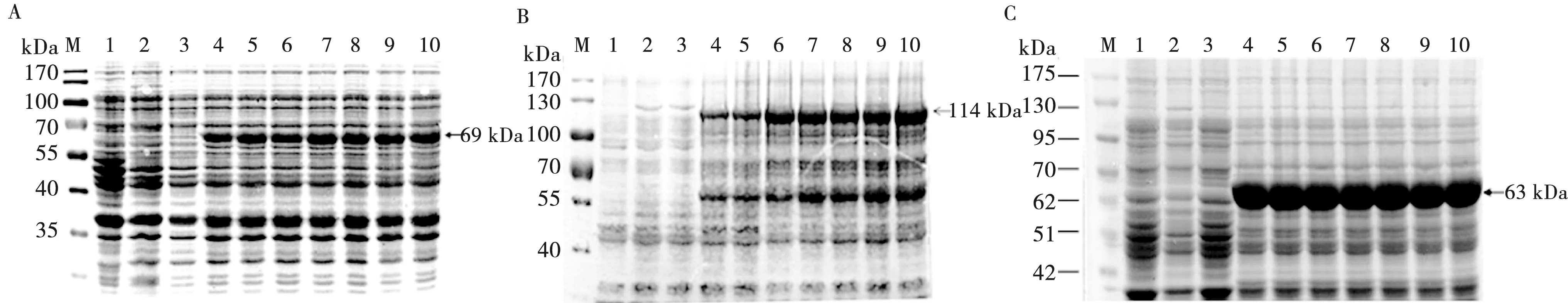
将重组表达蛋白经超声破碎处理后,分别将获得的上清和沉淀加热变性,进行SDS-PAGE分析,结果显示培养上清中未见预期蛋白条带,而沉淀中可见预期蛋白条带,说明表达的VP2,VP1和VP2-VP1蛋白均存在于细菌沉淀中,为非溶性蛋白,且主要以包涵体的形式表达(见图4)。
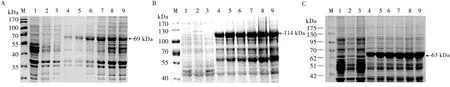
M.蛋白质分子量标准; 1.pET-32a 无IPTG诱导; 2.pET-32a 经IPTG诱导; 3.重组表达菌无IPTG诱导; 4~9.重组表达菌经IPTG诱导2、3、4、5、6和7 h
图2 pET-VP2(A)、pET-VP1(A)和pET-VP2-VP1(C)重组表达质粒在BL21菌株中最佳诱导时间的确定
M.蛋白质分子量标准; 1.pET-32a 无IPTG诱导; 2.pET-32a 经IPTG诱导; 3.重组表达菌无IPTG诱导; 4~10.重组表达菌分别经0.05、0.08、0.1、0.3、0.5、0.8、1 mmol/L 的IPTG诱导
图3 pET-VP2(A)、pET-VP1(B)和pET-VP2-VP1(C)重组表达质粒在BL21菌株中最佳IPTG诱导浓度的确定

M.蛋白质分子质量标准; 1.重组表达菌经超声破碎处理后的上清; 2.重组表达菌经超声破碎处理后的沉淀
图4 VP2(A)、VP1(B)和VP2-VP1(C)表达产物的可溶性分析
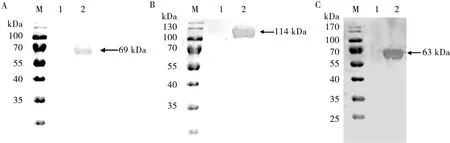
2.4 重组表达蛋白的纯化
将表达产物经蛋白的粗纯化和Ni-NTA亲和层析纯化后,并以纯化前的溶液作对照,SDS-PAGE分析显示,纯化所得的重组蛋白大小分别为69、114和63 kDa左右,无其他杂蛋白,纯化效果良好(见图5)。
2.5 表达蛋白Western blot鉴定结果
对各重组质粒的表达产物进行Western blot,结果显示,空载体pET-32a经IPTG诱导表达后的菌液没有反应条带,而VP2、VP1和VP2-VP1重组蛋白分别在69、114和63 kDa的位置与抗IBDV抗体有反应条带,且无非特异性条带出现(见图6),说明表达产物均可与鸡抗IBDV阳性血清发生特异性识别,具有良好的反应原性。
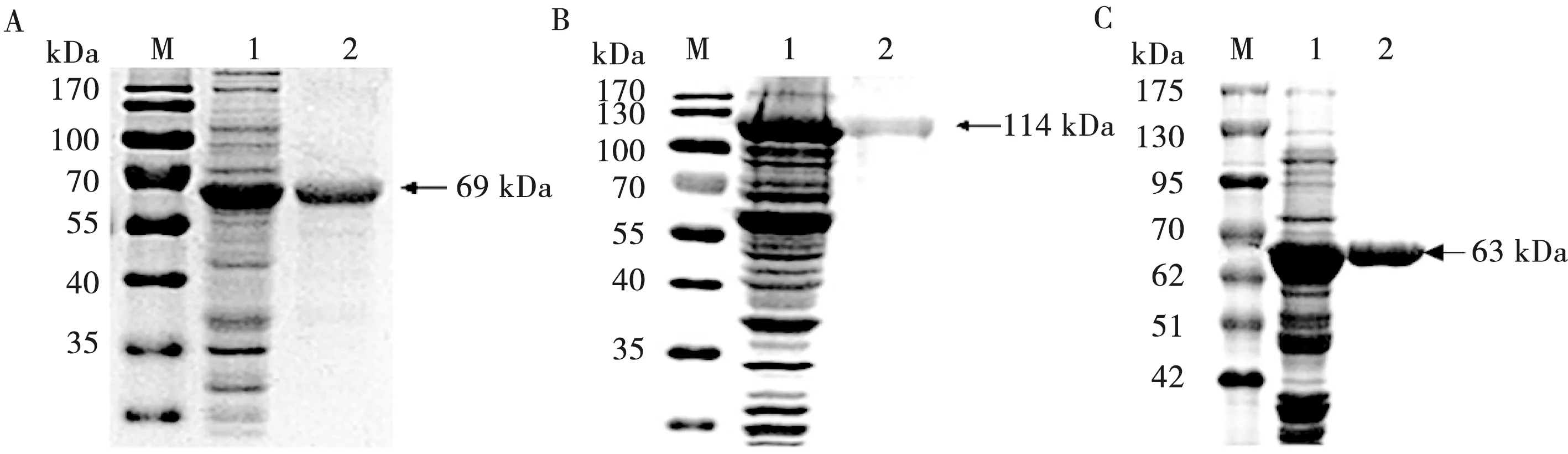
M.蛋白质分子质量标准; 1.IPTG诱导表达产物; 2.表达产物纯化
图5 VP2(A)、VP1(B)和VP2-VP1(C)表达产物的纯化
M.蛋白质分子质量标准; 1.pET-32a诱导蛋白与抗IBDV抗体作用; 2.重组表达蛋白纯化后与抗IBDV抗体作用
图6 VP2(A)、VP1(B)和VP2-VP1(C)表达蛋白的Western blot鉴定
2.6 表达蛋白的临床初步应用分析
以表达纯化的VP2、VP1和VP2-VP1重组蛋白作为包被抗原,分别对IBV、ReoV、ALV和NDV 4种阳性血清进行检测,结果均为阴性,表明所获得的纯化蛋白具有高度的特异性。并且还分别检测免疫了IBD灭活疫苗, IBD基因工程疫苗和IBD弱毒疫苗的商业鸡群的570份免疫血清,抗体检测结果均能显示疫苗免疫后机体抗体水平的变化趋势(图7)。

图7 以纯化的VP2、VP1和VP2-VP1蛋白为包被抗原来分别检测免疫了IBD灭活疫苗, IBD基因工程疫苗和IBD弱毒疫苗的商业鸡群的免疫血清情况
3 讨论
IBD是由IBDV引起雏鸡的一种急性,高度接触性和免疫抑制性的病毒性疾病,尤其是近年来vvIBDV的出现给全球家禽产业构成了严重威胁。因此,对鸡群IBDV的早期监测显得尤为重要。而采用血清学方法监测鸡群IBD感染情况和鸡群免疫后的抗体水平,有利于建立免疫检测体系、进行疫苗免疫效力评估和制定合理的免疫程序[12]。
目前,市场上虽已有检测IBDV抗体的商品试剂盒,但均以全病毒作为包被抗原,纯化全病毒费时费力且价格高昂,进行ELISA检测时有较强的背景反应和非特异性反应,而限制了其在基层的推广应用。此外,全病毒包被,可能因为不同毒株表面抗原的差异使得包被毒株与检测毒株差异大的病毒诱导产生的抗体没有被全病毒抗原包被所完全检测出来,导致检测的抗体滴度偏低,不能准确反映实际的可以应答水平[16-17]。并且与全病毒为包被抗原相比,该方法具有成本低廉、生物安全性高的优点,且不存在潜在病毒扩散的威胁。课题组连续多年对IBDV分子流行病学研究结果显示VP2并非是决定病毒毒力的唯一因素[18],并认为其毒力和抗原性与不同来源VP1片段的重排或重组有关[14-15]。本研究所表达纯化的3个蛋白均具有较高的特异性,实际应用检测临床的570份血清样品均能显示疫苗免疫后正常的抗体水平及其变化的趋势。并且与商品试剂盒A、B作平行检测184份临床血清样品显示,以VP2蛋白为包被抗原的相对敏感性和符合率是最高的。原因可能是,VP2上有中和性抗原表位、毒力相关性抗原表位,同时包括与诱导中和抗体有关的抗原决定簇。本文采用PCR扩增基因串联法[19-20],首次成功表达VP2-VP1重组蛋白,并发现单独的VP2和VP1表达、VP2-VP1串联表达均与IBDV野毒株血清发生良好的免疫反应,表明表达的蛋白能与不同毒株来源的抗血清具有良好的免疫学反应,研究结果为利用表达的VP2、VP1和VP2-VP1重组蛋白作为包被抗原,建立相关的抗体检测方法,具有广阔的应用前景。
IBDV衣壳蛋白VP2是宿主重要的免疫保护性抗原,它与病毒毒力变异、抗原漂变和细胞凋亡等有关[21]。近年来,VP1蛋白被认为也与病毒的复制和毒力有关[11]。目前,VP2蛋白已在重组病毒、酵母等表达系统中得到成功表达[22-23]。与其他表达系统相比而言,原核表达系统因遗传背景清晰、速度快、产量高、成本低等优势,成为外源基因表达最常用的表达系统[24]。而pET载体因具有蛋白表达量高等优点作为最常用的大肠杆菌中表达重组蛋白的原核表达质粒。此外,本研究采用的pET-32a载体还含组氨酸标签和Trx标签,与目的蛋白融合后可方便蛋白的纯化和促进外源蛋白的可溶性表达。但在SDS-PAGE的可溶性分析时发现,VP2、VP1和VP2-VP1重组蛋白经IPTG诱导后均以包涵体的形式表达,这与之前对VP2和VP1蛋白的研究结果相似,推测可能是重组蛋白在大肠杆菌中的表达速率过快,蛋白的部分折叠或错误折叠而造成的[25]。而高祥等[26]在冷休克条件下在Transetta(DE3)工程菌中实现衣壳蛋白VP2的可溶性表达。刘丹等[12]使用pET-32a载体表达IBDV衣壳蛋白VP2,诱导后发现在BL21中不表达,但在Rosetta(DE3)中经1 mmol/L IPTG诱导5 h时表达量明显提高。而本研究利用pET-32a载体,通过不断对试验条件进行优化,发现VP2、VP1和VP2-VP1 3种重组蛋白均可在BL21菌株中以包涵体的形式大量表达。
研究发现蛋白的表达量与各试验条件的优化密切相关,本文通过对各试验条件优化结果显示,VP2、VP1和VP2-VP1重组蛋白在IPTG浓度为0.05 mmol/L诱导2 h开始表达,其中分别在5 h、3 h和6 h时的蛋白表达量最多。并且发现在进行Ni-NTA亲和层析纯化前应先对蛋白粗纯化,这样可去除大部杂蛋白以获得更高纯度的目的蛋白。纯化后的3种重组蛋白均可与鸡抗IBDV阳性血清发生特异性识别,表明纯化后的重组蛋白均具有良好的免疫反应活性,为下一步IBDV特异性抗体的检测方法的建立和新型亚单位疫苗的研发奠定基础。

