安徽部分地区猪场产肠毒素大肠杆菌的分离鉴定及其生物学特性分析
任建鸾,张鹏,殷晗杰,黄豪胜,杨德鸿,曾颃,李一昊
(南京农业大学农业部动物细菌学重点实验室/南京农业大学动物医学院,江苏 南京 210095)
仔猪黄白痢为仔猪黄痢和白痢的合称,是一种常见的仔猪肠道传染病,既增加养殖业的用药费用,还会直接对仔猪的成活率产生影响,甚至使其无法正常生长发育,对现代规模化猪场造成巨大的经济损失[1]。产肠毒素大肠杆菌(enterotoxigenicEscherichiacoli, ETEC)是引起仔猪黄白痢的重要致病菌,常感染新生仔猪和断奶仔猪,患病猪群表现为新生仔猪拉黄色痢疾,哺乳期仔猪拉黏稠的白色痢疾,严重病例会导致死亡;此外ETEC还会引起婴幼儿的腹泻,是一种十分严重的人畜共患病[2-3]。ETEC的毒力因子肠毒素(enterotoxin)是 ETEC 在体内或者体外生长时产生并且分泌到细胞外的一类蛋白质性质的毒素,包括不耐热肠毒素(heat labile enterotoxin,LT)和耐热肠毒素(heat stable enterotoxin,ST)[4]。
畜类携带ETEC不仅给养殖业造成巨大经济损失,且已成为威胁食品安全的重要风险因素[5]。动物源性食品中污染的ETEC致病菌不仅严重危害人类健康,而且养殖场滥用药物会导致耐药性ETEC的大量产生和广泛传播,这些耐药菌通过生产链最终污染产品,使得食源性细菌疾病的防控和治疗更加困难[6]。因此对我国规模化猪场ETEC的感染情况进行调查具有非常重要的意义。本研究采集了安徽地区部分规模化猪场的仔猪黄白痢病料,进行了ETEC菌株的分离鉴定,并对分离的ETEC菌株进行了血清型、耐药性及毒力的测定,为该地区规模化猪场ETEC感染的防控提供参考。
1 材料与方法
1.1 主要仪器、试剂及菌株
酵母提取物、胰蛋白胨、MHA(Mueller-Hinton Agar)培养基、MAC(MacConkey Agar)培养基购自英国Oxoid公司;大肠杆菌标准血清购自天津生物芯片有限责任公司;抗生素药敏纸片购自杭州滨和微生物试剂有限公司;2×PCR Mix购自南京诺唯赞生物科技有限公司;佐剂购自法国SEPPIC公司;PCR仪为日本TaKaRa公司制造;分光光度计及凝胶成像仪为美国Bio-Rad公司制造。参考阳性菌株为本实验室保存的ST阳性菌株CVCC1521和LT阳性菌株CVCC1526
1.2 样品的采集及处理
采集安徽全椒、肥东、肥西、埇桥、亳州和南陵6个不同地区17个规模化猪场的仔猪黄白痢病料479份,主要采集2日龄仔猪及断奶后仔猪的新鲜粪便、直肠棉拭子,将采集的样品置于无菌离心管中,并放于冰盒中,于1周之内带回实验室进行样品的分离鉴定。用无菌接种环挑取样品,在麦康凯琼脂平板上进行划线,随后将平板置于37 ℃恒温培养箱过夜培养,次日在平板上挑取红色菌落(疑似大肠杆菌菌落),于LB培养基中培养,并保存备用。
1.3 PCR鉴定
为进一步鉴定以上菌落是否为大肠杆菌,针对大肠杆菌16S rRNA的基因片段设计了特异性引物(表1)。LT和耐热肠毒素ST是ETEC 的重要毒力因子,因此本研究根据LT和ST序列设计特异性引物(表1),用于鉴定ETEC。PCR 反应体系为25 μL:Mix12.5 μL、上下游引物各1 μL、细菌模板2 μL和水8.5 μL;反应程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退30 s,72 ℃延伸1 min,循环30次;72 ℃延伸10 min;最后用1%琼脂糖凝胶进行核酸电泳,通过凝胶成像仪观察条带大小并分析结果。
表1 ETEC特异性鉴定引物

引物名称引物序列(5′-3′)产物大小/bpST-1AGGCCCGCATCCAGTTAT85ST-2CGAGTGACGGCTTTGTAGLT-1ACGGCGTTACTATCCTCT280LT-2CAATTTTGGTCTCGGTCA16SrRNA-1AGAGTTTGATCCTGGCTCAG138116SrRNA-2GGTTACCTTGTTACGACTT
1.4 血清凝集试验
选用大肠杆菌标准O抗原血清对分离菌株进行血清凝集试验。根据标准说明,待检菌株与标准血清混合后经肉眼观察出现“++”及以上凝集现象即为该种标准血清的血清型。将上述鉴定出的ETEC菌株与对应的标准血清进行玻片凝集试验,若出现肉眼可见的凝集现象,即定型待检菌株的血清型;经过玻片凝集试验后未发生凝集现象时,则选择ETEC相应多价血清进行验证,若出现阳性凝集现象,再选择多价血清中包含的单价血清鉴定,最终确定ETEC菌株的血清型。
血清凝集试验前,首先要将ETEC菌株划线LB平板,放置37℃恒温培养箱培养16 h,取出平板后,用1 mL 0.9%生理盐水洗菌,待洗到浓度最大时装于管中煮沸30 min,以此来破坏K、H抗原的干扰,作为待检菌株。取洁净玻片,吸取菌液滴于玻片两端,一滴加入10 μL标准血清,一滴加入生理盐水,轻轻晃动玻片,倾斜玻片于1 min内观察试验现象,以出现“++”及以上凝集反应判定阳性结果。
1.5 药敏试验
根据CLSI标准对本研究中鉴定的ETEC菌株进行药敏试验[7]。共选用13种药敏片进行检测,包括青霉素类阿莫西林、头孢类头孢噻肟、多肽类多黏菌素B、四环素类强力霉素和四环素、大环内酯类红霉素、氨基糖苷类庆大霉素和丁胺卡那、氯霉素类氯霉素、喹诺酮类恩诺沙星和环丙沙星及磺胺类药物甲氧苄啶/磺胺甲噁唑。据CLSI公布的大肠杆菌对抗生素药敏纸片敏感范围的最新标准(表2),将药敏试验结果分为耐药(R)、中介(I)和敏感(S)。
表2 药敏纸片抑菌环直径判断标准
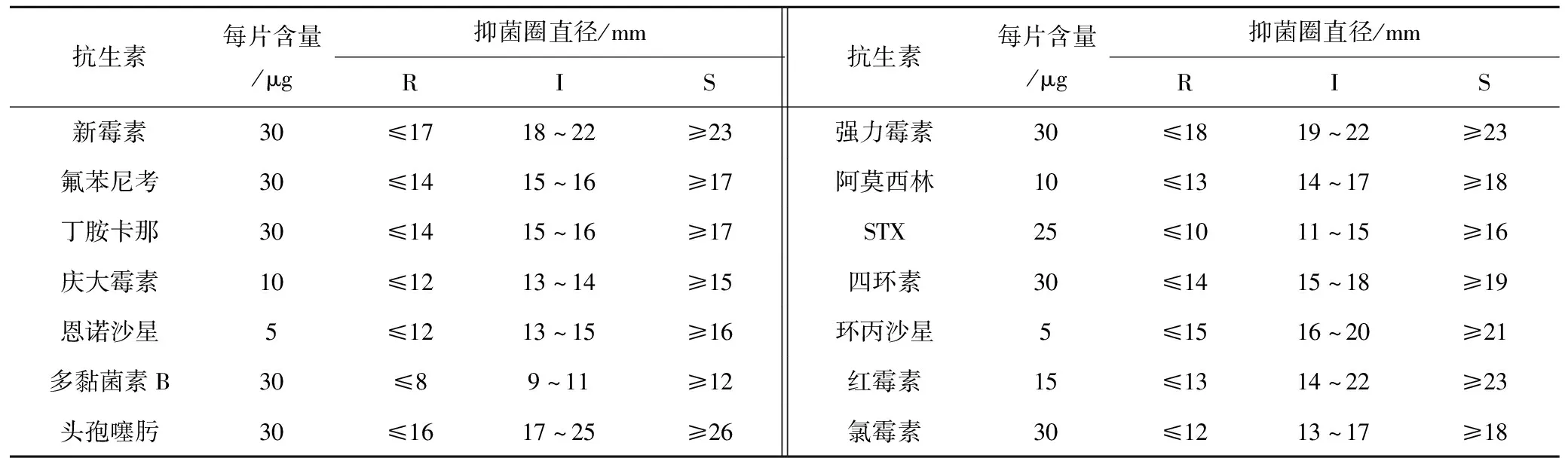
抗生素每片含量/μg抑菌圈直径/mmRIS抗生素每片含量/μg抑菌圈直径/mmRIS新霉素30≤1718~22≥23强力霉素30≤1819~22≥23氟苯尼考30≤1415~16≥17阿莫西林10≤1314~17≥18丁胺卡那30≤1415~16≥17STX25≤1011~15≥16庆大霉素10≤1213~14≥15四环素30≤1415~18≥19恩诺沙星5≤1213~15≥16环丙沙星5≤1516~20≥21多黏菌素B30≤89~11≥12红霉素15≤1314~22≥23头孢噻肟30≤1617~25≥26氯霉素30≤1213~17≥18
1.6 优势血清型菌株的毒力测定
将本研究中鉴定的优势血清型菌株浓度调整为2.5×107cfu/mL,对4周龄ICR雌性小鼠进行腹腔攻毒,每只0.2 mL,每株菌攻毒6只小鼠,同时设阴性对照。于7 d内记录小鼠的死亡情况。根据小鼠死亡数量判定ETEC菌株的致病力,将死亡5~6只小鼠的菌株判定为强毒株,死亡2~4只判定为中等毒力菌株,死亡0~1只判定为弱毒株。
2 结果
2.1 ETEC的分离鉴定
对待检菌株进行16S rRNA序列扩增,若菌株在1 381 bp处出现条带,则送公司测序,并NCBI数据库进行序列比对,与大肠杆菌同源性为98%以上的,鉴定为大肠杆菌。所得大肠杆菌再进行LT和ST的PCR鉴定,结果显示479份样品中鉴定为ETEC的菌株有110株,且各个地区均有分布。其中:同时含有ST和LT基因的菌株6株,占5.5%;仅含有ST基因的菌株97株,占88.2%;仅含有LT基因的菌株7株,占6.4%。
2.2 血清型鉴定
对ETEC菌株进行血清凝集试验,结果110株ETEC中52株可定型,占ETEC菌株总数的47.3%,8株出现自凝反应,其余未能定型。共鉴定出O8、O20、O128、O15、O25、O114、O169、O159、O3、O9、O149、O137和O141共13种血清型,以O8、O20、O128为该地区的优势血清型,其中:O8血清型占定型菌株的26.9%(14/52),O20血清型占定型菌株的21.2%(11/52),O128血清型占定型菌株的11.5%(6/52)。ETEC定型的菌株中有59.6%是优势血清型,占分离菌株的28.2%。此外还分离到O15血清型5株,占9.6%;O25血清型4株,占7.7%;O114、O169、O159和O3血清型各2株,分别占3.8%;O9、O149、O137和O141各1株,分别占1.9%。
2.3 ETEC菌株耐药性分析
药敏试验结果表明,分离的110株ETEC菌株对丁胺卡那、恩诺沙星、头孢噻肟等抗生素的敏感率分别为60%、57.3%和60%,其中对多黏菌素B的敏感率达到90%以上(表3)。安徽地区分离到的110株ETEC菌株表现出高耐药性,对强力霉素的耐药率高达100%(110/110);对新霉素、红霉素、庆大霉素、阿莫西林、四环素等抗生素的耐药率分别为77.3%(85/110)、94.5%(104/110)、77.3%(85/110)、91.8%(101/110)、97.3%(107/110),耐药率均高达75%以上。安徽地区分离的110株ETEC对多种抗生素均有耐药性,用13种药敏片对ETEC菌株进行试验,其中9、10重耐药菌株数最多,分别占比19.1%;10重耐药以上的ETEC菌株有42株,耐药率达38.1%,以安徽中部偏南区域为主。
表3 110株ETEC菌株药敏试验结果

抗生素菌株数(占比)RIS新霉素85(77.3%)25(22.7%)0丁胺卡那44(40%)15(13.6%)51(46.4%)红霉素104(94.5%)6(5.5%)0庆大霉素85(77.3%)1(0.9%)24(21.8%)恩诺沙星47(42.7%)11(10%)52(47.3%)环丙沙星49(44.5%)14(12.7%)47(42.7%)多黏菌素B011(10%)99(90%)头孢噻肟44(40%)9(8.2%)57(51.8%)强力霉素110(100%)00阿莫西林101(91.8%)09(8.2%)甲氧苄啶/磺胺甲恶唑104(94.5%)06(5.5%)四环素107(97.3%)1(0.9%)2(1.8%)氯霉素79(71.8%)3(2.7%)28(25.5%)
2.4 ETEC优势血清型菌株毒力测定
分别将优势血清型O8、O20、O128菌株以5×107cfu/只的攻毒剂量对4周龄ICR小鼠攻毒,每只小鼠腹腔注射0.2 mL,每组6只。毒力测定结果选择3次试验的平均数,试验表明,14株O8血清型有7株强毒株,占比50%(7/14);6株菌为中等毒力菌株,1株为弱毒株(表4)。O20血清型强毒株占比72.7%(8/11)(表5);O128血清型强毒株占比66.7%(4/6)(表6)。
表4 O8血清型ETEC小鼠致病力
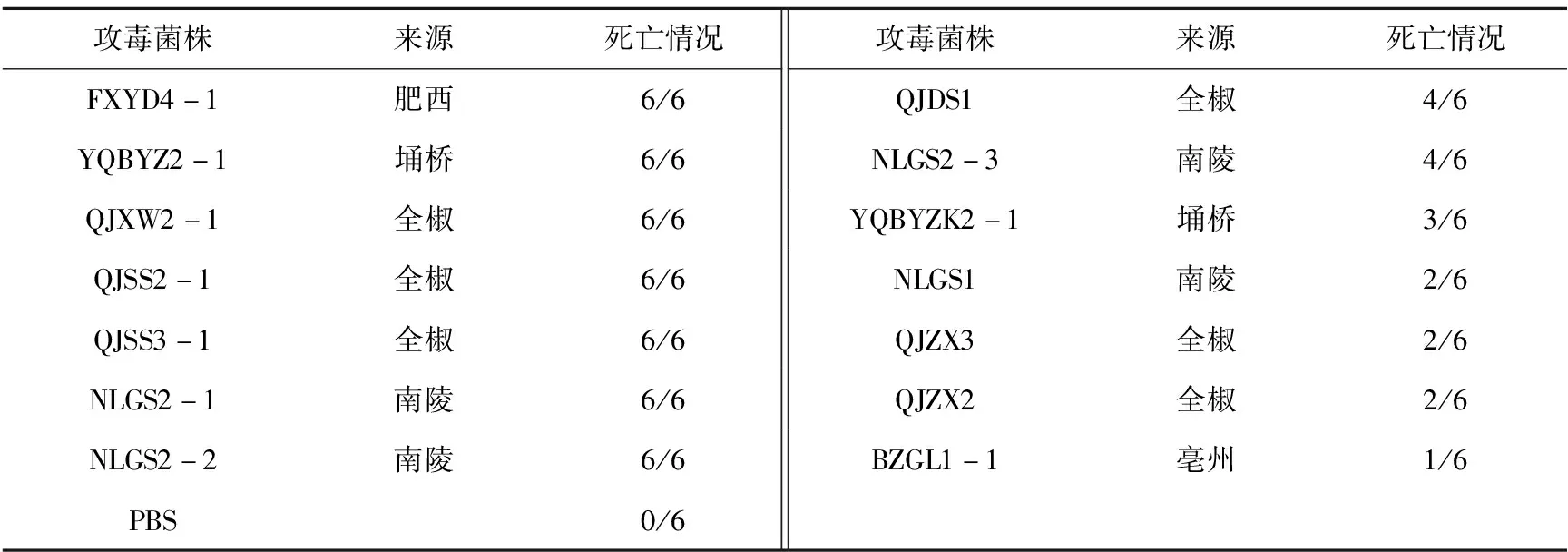
攻毒菌株来源死亡情况攻毒菌株来源死亡情况FXYD4-1肥西6/6QJDS1全椒4/6YQBYZ2-1埇桥6/6NLGS2-3南陵4/6QJXW2-1全椒6/6YQBYZK2-1埇桥3/6QJSS2-1全椒6/6NLGS1南陵2/6QJSS3-1全椒6/6QJZX3全椒2/6NLGS2-1南陵6/6QJZX2全椒2/6NLGS2-2南陵6/6BZGL1-1亳州1/6PBS0/6
表5 O20血清型ETEC小鼠致病力

攻毒菌株来源死亡情况攻毒菌株来源死亡情况QJSS2-2全椒6/6QJSS2-3全椒6/6FDDS1肥东6/6QJSS2-4全椒4/6QJDS2全椒6/6QJSS2-5全椒4/6FXGZ2肥西6/6FXYQ1肥西3/6FXYD4-2肥西6/6PBS0/6BZGL1-2亳州6/6QJSS3-2全椒6/6
表6 O128血清型ETEC小鼠致病力

攻毒菌株来源死亡情况YQBYZ1埇桥6/6YQBYZ2-2埇桥6/6YQBYZK2-2埇桥6/6QJXW2-2全椒6/6YQBYZ2-4全椒4/6YQBYZ2-3全椒0/6PBS0/6
3 讨论
仔猪黄白痢是规模化猪场难以根除的动物传染病,给养猪业的发展带来了巨大的挑战[8-9]。本试验对安徽规模化猪场仔猪黄白痢样品进行细菌分离,从479份样品中分离出110株ETEC菌株,表明ETEC在仔猪黄白痢样品中分离率较高,也进一步证实该菌为造成仔猪黄白痢的主要病原之一。
大肠杆菌血清型达180多种,且在实际操作过程中存在不凝和自凝等无法判定血清型的现象。本研究共鉴定出52株ETEC分离株的血清型,定型率达菌株总数的47.3%,其中以O8、O20、O128三种血清型为安徽地区的优势血清型,占定型菌株的59.6%,且分布比较广泛。据报道,猪源ETEC常见血清型有O8、O11、O128、O9、O138、O101和O149等[10],本试验与前人报道相符。本实验室还在2017—2018年对苏北部分地区21个规模化猪场的仔猪黄白痢样品进行了ETEC菌株的分离鉴定,结果表明苏北地区ETEC的优势血清型主要为O8、O101和O128[11],与本研究中的优势血清型有部分重合,且都在前人报道的常见血清中,表明我国不同地区ETEC的优势血清型主要集中于几个常见的血清型,这对ETEC的防控具有重要的指导意义。
由于抗生素的广泛使用,菌株的耐药现象日益严峻,已引起了全世界的广泛关注。本研究对110株分离菌株的耐药性做了调查,耐药现象非常严重,在13种测试药物中,对6种药物的耐药率均高于70%,对强力霉素的耐药率甚至高达100%,且大部分菌株呈现多重耐药,其中9、10重耐药菌株数占比高达19.1%。而在其他ETEC相关报道中,耐药现象也非常严峻[12-14],提示我们要尽快制定应对策略,减少抗生素的滥用,同时积极寻找抗生素替代疗法,如噬菌体、抗菌肽等[15-16]。
为验证本研究中分离的ETEC菌株是否是造成仔猪黄白痢的关键病原菌,利用小鼠作为动物模型,对110株ETEC分离株中3个优势血清型的所有菌株(O8血清型14株,O20血清型11株,O128血清型6株)进行了毒力测定,结果表明O8、O20和O128中高毒力菌株占各自血清型菌株的比例分别为50%(7/14)、72.7%(8/11)和66.7%((4/6),表明优势血清型菌株的毒力普遍较高,提示它们是造成规模化猪场仔猪黄白痢的关键病原。因此,猪场可考虑针对这些优势血清型菌株制备灭活疫苗,用于猪场仔猪黄白痢的防控。

