硫化氢通过减轻肾小管上皮细胞凋亡改善糖尿病肾病
余燕婷 朱润章 肖磊娟 王聪 李晓峰 季大玺
210019 南京,南京医科大学附属南京明基医院肾脏内科
糖尿病发病率逐年增加,有1/3糖尿病患者可发展成糖尿病肾病,表现为尿白蛋白或尿总蛋白增加。糖尿病肾病尚无有效治疗方式,随着肾功能进展,既往控制尿蛋白的血管紧张素转化酶抑制剂、血管紧张素受体阻滞剂以及中成药雷公藤等均需慎用[1]。因此,寻找糖尿病肾病的治疗药物具有重要临床意义。硫化氢(H2S)是继一氧化碳、一氧化氮之后的第三种气体信号分子[2],在哺乳动物体内多个组织、器官均有内源性的H2S产生[3]。在H2S的合成酶学途径和非酶学途径中,酶学途径占主要地位,涉及胱硫醚β合成酶(cystathionine betasynthetase,CBS)、胱硫醚β裂解酶(cystathionine beta-lyase,CSE)、3-巯基丙酮酸转硫酶(3-mercaptopyruvate transferase,MST)[4],三种酶在肾脏近端小管上皮细胞均有表达[5]。H2S的生理作用涉及血管舒张、抗氧化、抗炎、抗凋亡、促血管生成[6]。H2S对肾脏稳态起重要作用,具有利尿、排钠、排钾等作用[7]。在慢性肾脏病(CKD)动物模型,血浆H2S浓度下降,肾组织H2S减少。临床上规律血液透析的终末期肾脏病(ESRD)患者的血浆H2S水平较健康对照者也下降[8],而糖尿病是一个多基因多因素参与的疾病,发病机制涉及氧化应激[9]。H2S作为一个还原剂,是否对糖尿病肾病起保护作用呢?相关的研究并不多。本实验旨在研究H2S在糖尿病肾病中的作用及探讨其可能的机制。
资料与方法
一、实验对象
1.实验动物 C57BL/6J小鼠给予STZ(#S0130,sigma-aldrich)50 mg/kg×4 d腹腔注射,自第一次注射开始2周后测随机血糖超过16.7 mmol/L为糖尿病造模成功,后续所有动物给予高脂饮食。将造模成功小鼠分两组:STZ+GYY 4137组(H2S组)给予20 mg/kg GYY 4137(sigma,SML0100)腹腔注射,STZ+生理盐水组(DKD组)给予等量生理盐水腹腔注射。另外取正常C57BL/6J-1小鼠作为正常对照组(control组),给予等量生理盐水腹腔注射。连续注射12周。12周后留取24 h尿液,测尿白蛋白含量。并处死小鼠,留取肾组织,在光镜下行PAS染色观察,取肾组织匀浆检测CBS、CSE、MST的水平,光镜石蜡切片行TUNEL检测。
2.细胞 大鼠近端肾小管上皮细胞系(NRK-52E,CRL-1571TM)购自美国模式菌种收集中心(ATCC)。用含10%胎牛血清和100 U/mL青-链霉素的DMEM低糖(5.5 mmol/L)培养基(#D5546,sigma-aldrich),在37 ℃,含5%CO2的孵箱中培养。细胞贴壁生长达到80%融合后,换成无血清的DMEM低糖培养基孵育过夜(16 h),再次更换无血清的DMEM低糖培养基,给予D-葡萄糖和甘露醇刺激6 h、12 h、24 h、48 h,检测caspase-3的活性。取12 h的时间点,H2S预孵后再次检测高糖刺激后caspase-3的活性变化。
二、方法
1.生化指标检测 自注射GYY4137第12周末,测量大鼠空腹体质量,用10%水合氯醛麻醉,摘取眼球后取血,离心后取血清用自动生化分析仪检测空腹血糖、血尿素氮(BUN)、血肌酐(Scr)、白蛋白(albumin,Alb)。并检测24 h尿白蛋白水平。
2.肾脏形态学变化观察 小鼠处死后,速取两侧肾脏,去除包膜,左肾分装后置于-80 ℃冰箱保存;右肾置10%甲醛固定,石蜡包埋,切片,PAS染色:1%高碘酸氧化15 min,纯水洗3~5遍;Schiff氏液染30 min,流水冲洗至颜色转为玫瑰红;苏木素淡染,水洗,脱水,透明,封片。光镜下观察肾脏形态学变化。TUNEL染色:石蜡切片脱蜡、脱水,滴加20 μg/mL不含DNase的蛋白酶K,20~37 ℃作用15~30 min,加50 μL TUNEL检测液,37 ℃避光孵育60 min,PBS洗3次后,用抗荧光淬灭封片液封片后,置于荧光显微镜下观察。
3.Western blot检测肾组织和细胞蛋白的表达 取肾脏组织50 mg,加细胞裂解液匀浆,离心后取上清,BCA法测定蛋白质浓度。各组取30 μg上样,SDS-PAGE电泳,蛋白转至PVDF膜,5%TBST脱脂奶粉室温封闭2 h后,分别加入一抗1∶400稀释的CBS(sc-67154,santa cruz)、CSE(sc-101924,santa cruz)、MST(HPA001240,sigma)多克隆抗体,1∶1000稀释的β-actin单克隆抗体,4 ℃孵育过夜。次日,二抗孵育1 h,浓度为1∶1000。化学发光ECL显色,曝光成像。凝胶成像系统测定条带的灰度值,计算CBS、CSE、MST的蛋白相对表达量。同法检测细胞的caspase-3(#14220, Cell Signaling Technology, Beverly, MA),cleaved-caspase-3(#9664, Cell Signaling Technology, Beverly, MA)的蛋白表达。
三、统计学处理

结 果
一、各组小鼠生化指标水平比较
糖尿病肾脏病(DKD)组尿白蛋白水平显著高于Control组(144.6±61.0 vs 34.9±13.9 mg,P<0.05),H2S组尿白蛋白较DKD组显著下降(46.6±47.2 vs 144.6±61.0,P<0.05)。与Control组相比,DKD组小鼠体质量显著下降(31.4±3.8 vs 37.8±7.7 g,P<0.05),但BUN、Scr、Alb水平无明显差异(P>0.05);H2S治疗对小鼠体质量、血糖等无明显影响。(表1)

表1 各组小鼠生化指标水平比较±s)
注:与Control组比较,aP<0.05,与DKD组比较,bP<0.05
二、各组小鼠肾脏形态学比较
取小鼠肾组织切片行PAS染色,观察各组小鼠肾小球系膜增殖情况。与Control组相比,DKD组小鼠系膜细胞增多,系膜基质增生;H2S治疗后系膜细胞增生减少,系膜基质增殖也减轻。(图1)
三、各组小鼠肾组织CBS、CSE、MST蛋白相对表达量比较
DKD组小鼠肾组织CBS蛋白较Control组小鼠表达减少(P<0.05),而DKD组和Control组小鼠肾组织的CSE、MST表达无明显差别(P>0.05)。(图2)
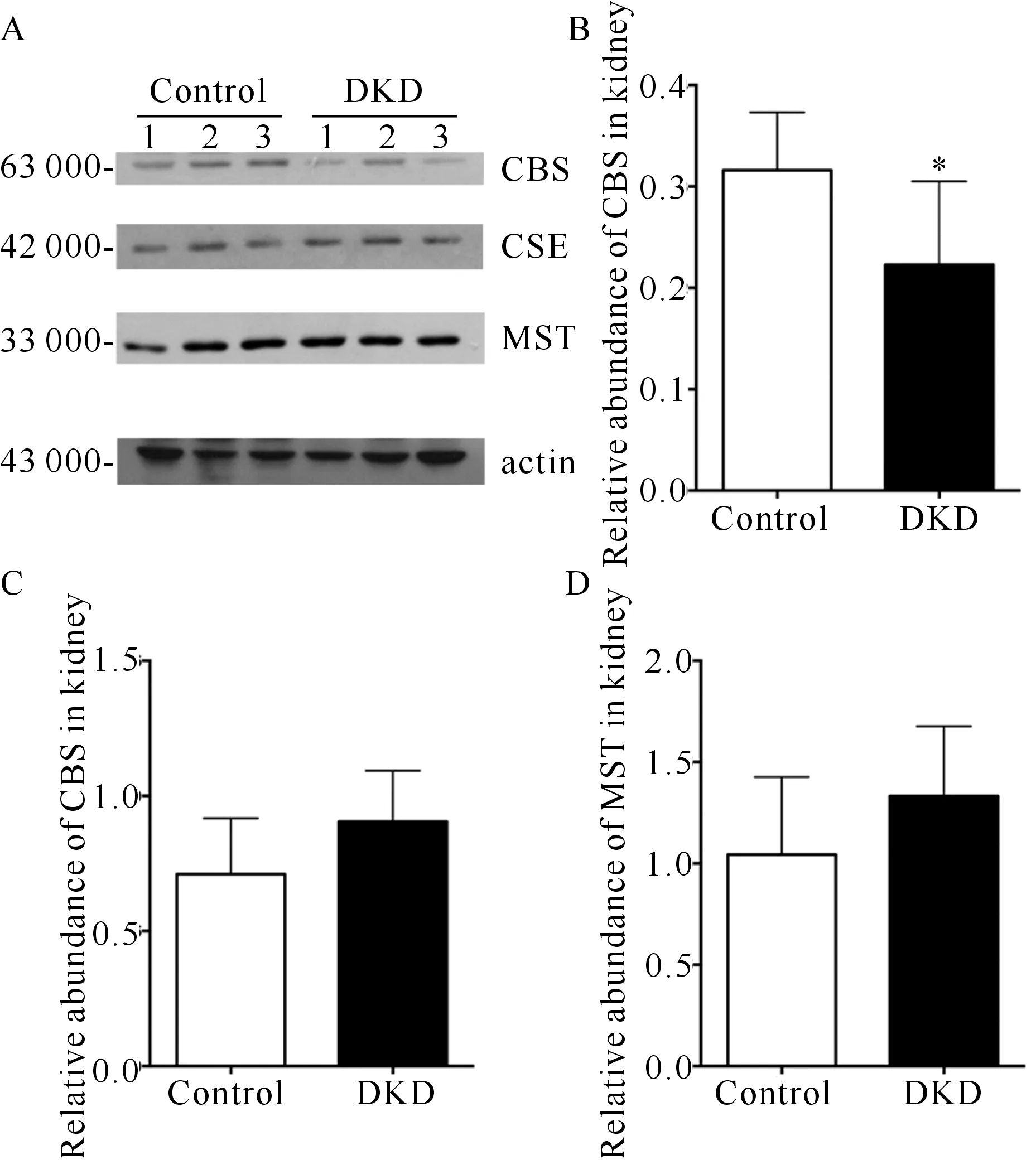
图2 各组小鼠CBS、CSE、MST的蛋白相对表达量比较(A.三种H2S产生酶在正常和糖尿病小鼠肾组织表达,B.H2S产生酶CBS的蛋白相对含量,C.H2S产生酶CSE的蛋白相对含量,D.硫化氢产生酶MST的蛋白相对含量;与Control组比较,aP<0.05)
四、各组小鼠肾组织细胞凋亡情况比较
小鼠肾组织切片行脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测细胞的凋亡。与Control组相比,DKD组小鼠肾组织TUNEL检测阳性细胞数增加(P<0.05),H2S治疗后TUNEL检测阳性细胞数较前明显减少(P<0.05)。(图3)
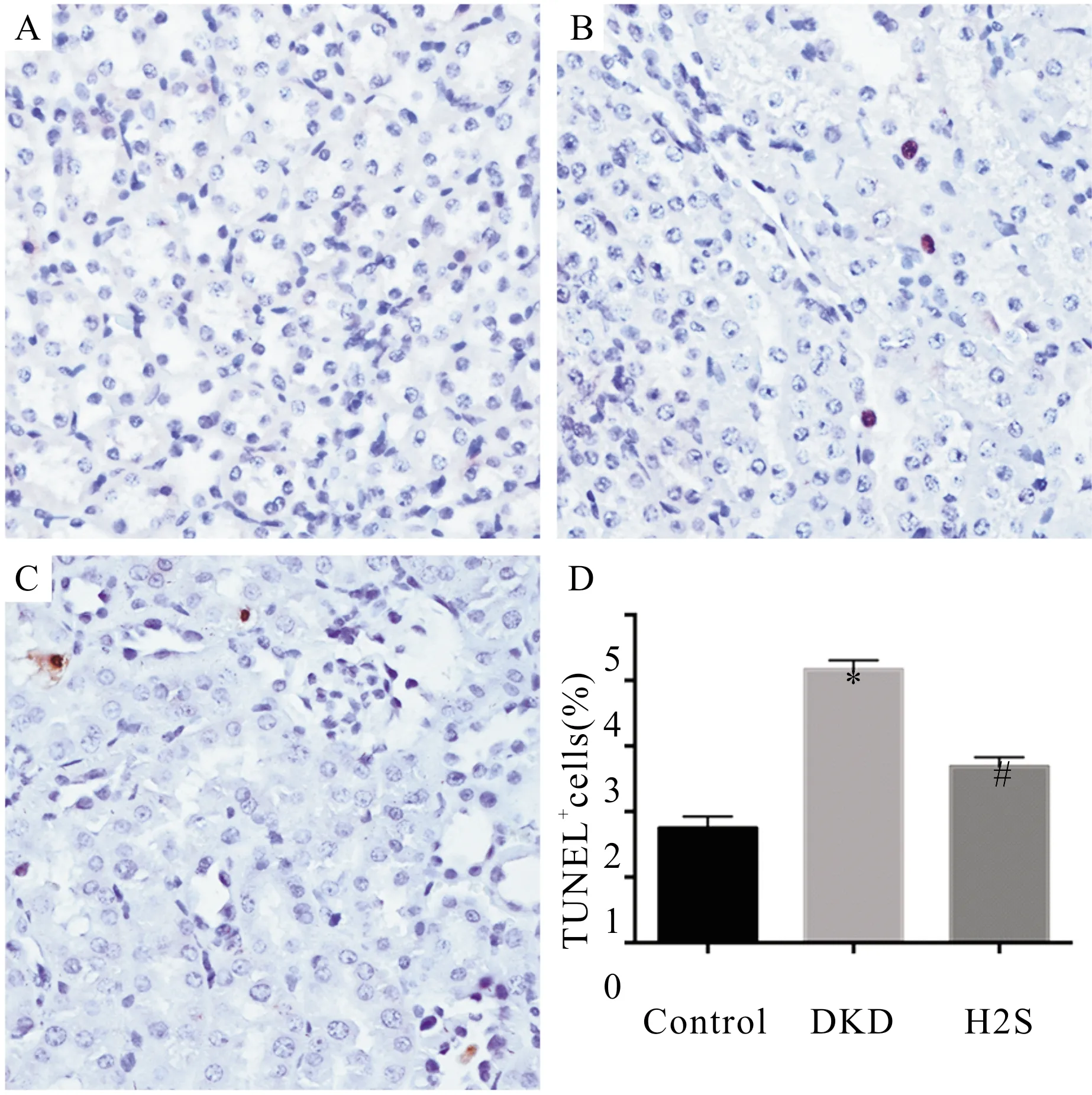
图3 各组小鼠肾组织细胞凋亡情况比较(A.Control组,B.DKD组,C.H2S组,D.各组小鼠肾组织TUNEL染色阳性细胞的百分比;与Control组比较,aP<0.05;与DKD组比较,bP<0.05)
五、H2S对肾小管上皮细胞caspase-3的作用
对大鼠近端肾小管上皮细胞(NRK-52E细胞)给予25 mmol/L葡萄糖刺激,凋亡标志物cleaved-caspase-3的表达明显增加,刺激6 h、12 h时其增加具有统计学差异(P<0.05)。提前给予不同浓度(10、50、100 μmol/L)H2S预孵30 min再给予25 mmol/L葡萄糖刺激12 h,cleaved-caspase-3的表达均降低(P<0.05)。(图4)
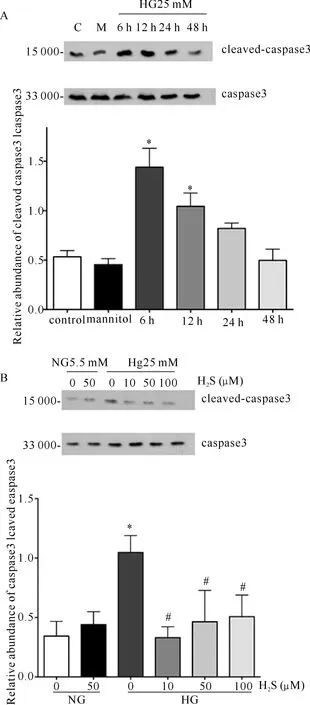
图4 H2S对肾小管上皮细胞cleaved-caspase-3和caspase-3的作用[A.大鼠近端肾小管上皮细胞在高糖(葡萄糖25 mmol/L)刺激后较正常葡萄糖(5.5 mmol/L),cleaved-caspase-3/caspase-3表达增加,B.不同浓度H2S预孵后进行高糖刺激,cleaved-caspase-3/caspase-3表达降低;HG为高糖组;与Control组比较,aP<0.05,与HG组比较,bP<0.05]
讨 论
H2S是新型气体分子,在生物体内多个系统显示有治疗作用[10]。既往研究发现H2S在慢性肾脏病患者体内下降[8,11],动物实验显示H2S能够改善梗阻性肾病的肾脏纤维化[12],体外实验发现H2S能够改善高糖诱导的足细胞基质蛋白的合成[13],但H2S对糖尿病肾病的作用研究较少。本研究用STZ小剂量多次腹腔注射,并给予高脂饮食诱导制备糖尿病肾病模型,尿白蛋白增加是糖尿病肾病造模成功标志,对糖尿病肾病模型小鼠给予H2S治疗后,尿白蛋白明显改善,提示H2S能够改善糖尿病小鼠肾损伤。不仅尿白蛋白改善,对肾组织形态学分析,发现H2S能改善肾小球系膜细胞增生和系膜基质增殖。
硫化氢在众多疾病中均下降,包括急性肾损伤,心肌纤维化,脑认知功能障碍等。但硫化氢产生酶的研究尚少,H2S产生酶包括CBS、CSE、MST。既往有研究发现CSE能够保护肾脏缺血再灌注损伤[12]。本研究用蛋白印迹法检测三种酶在肾脏的具体表达量,发现糖尿病小鼠较正常对照CBS的表达明显下降,CSE和MST的表达没有明显变化,提示H2S产生酶CBS的减少可能是糖尿病小鼠H2S产生减少的原因。
H2S的供体既往有硫氢化钠,Zhou等[14]研究结果显示,外源性给予糖尿病大鼠NaHS 14 μmol/kg后能够改善肾功能指标和病理结构损伤。杨悦等[15]的研究显示,通过外源性给予大鼠补充H2S的供体NaHS 56 μmol/kg后,NaHS组大鼠各项指标与对照组无显著差异;而与糖尿病组相比,NaHS治疗组大鼠体质量明显增加,空腹血糖、BUN、Scr、24 h尿蛋白、肾质量和肾质量指数均明显降低,形态学损伤明显改善,结果显示外源性补充H2S对糖尿病大鼠肾脏具有保护作用。但NaHS缺点是释放快,对使用者有一定危害。GYY4137是新型的H2S缓释制剂[16]。研究发现GYY4137对高糖的细胞毒性起保护作用,其机制是通过AMPK/mTOR信号途径发挥作用[17]。本研究通过GYY4137给STZ诱导的糖尿病小鼠补充H2S,发现小鼠体质量增加,尿蛋白减少,肾小球的系膜增生改善,提示缓释剂GYY4137作为H2S供体对糖尿病肾病具有保护作用。
细胞凋亡在糖尿病肾病的发展中起一定作用[18],研究发现H2S通过巯基化核因子-κB起抗凋亡作用[19]。TUNEL检测可反映细胞的凋亡,本研究发现糖尿病肾病小鼠肾组织中TUNEL检测染色阳性的细胞数增多,而H2S治疗组阳性细胞减少。caspase-3常作为凋亡发生的标志酶,本实验对大鼠来源的近端肾小管上皮细胞NRK-52E细胞给予高糖刺激后,caspase-3活性明显升高,而H2S预孵育可使caspase-3活性降低,提示H2S通过抑制细胞凋亡保护肾脏。本研究选取近端肾小管上皮细胞系,原因是H2S探针发现小管H2S产生较肾小球明显增加,而且肾组织免疫组化也发现凋亡细胞主要在肾小管上皮细胞,而且有研究发现H2S能够抑制高糖诱导的近端小管上皮细胞基质蛋白的表达[20]。
综上所述,本研究发现对糖尿病小鼠外源性补充H2S缓释制剂GYY4137,能够减轻小鼠尿白蛋白,减轻肾小球系膜增殖,减少肾组织细胞凋亡。体外研究发现,H2S可能通过降低caspase-3活性而减轻高糖诱导的肾小管上皮细胞凋亡,提示GYY4137作为H2S的缓释制剂,有望成为糖尿病肾病的治疗新举措。

