让学生通过设计活动掌握物质鉴别方法
殷菊香 李胜荣
摘要:选择碳酸钠和碳酸氢钠鉴别实验作为教学探索题材。让学生在比较碳酸钠和碳酸氢钠性质和组成基础上确定鉴别依据,注重可靠性并理解鉴别原理;要求学生设计尽可能多的可行性鉴别方案,激发、培养学生的创新热情和能力;引导学生注重现象的鲜明性,选择效果较好的鉴别方案;引导学生注重操作的便捷性和可靠性,改进和完善鉴别方案;要求学生完整地表述鉴别方案,明确选择规则。对3个有鉴别功能的实验做详尽讨论,分析优缺点。
关键词:鉴别实验;碳酸钠和碳酸氢钠;学生课堂活动;实验设计
物质鉴别是中学化学中的一项重要内容。可是一些学生往往死记硬背鉴别方法,不注重弄清鉴别原理和鉴别方案选择规则,学习效果难以达到预期水平,更难以举一反三实现学习迁移。为改变这种状况,我们选择“碳酸钠和碳酸氢钠的鉴别”[1]作为教学素材,尝试让学生通过设计活动掌握物质鉴别方法,取得了令人满意的教学效果。
为什么选择碳酸钠和碳酸氢钠鉴别实验作为素材?我们的考虑是:碳酸钠和碳酸氢钠的组成和性质比较相似,又有多种性质差异,但尚缺乏简单高效的鉴别方法;有关的参考文献较少,因而有较强的探究性,其难度比较适合于高中学生,有利于他们明确和掌握鉴别的原理和规则。
1 教学思路和具体做法
1.1 在比较碳酸钠和碳酸氢钠性质和组成基础上确定鉴别依据,注重可靠性并理解鉴别原理
由于碳酸钠和碳酸氢钠的组成和性质比较相似,不少学生对它们的鉴别感到困惑。此时可以提示学生:除直接利用它们不同的性质进行鉴别之外,还可以通过它们在相同条件下转化成不同的物质来进行鉴别。经过启发之后,多数学生能够想到一些方案,例如:钙离子、钡离子可以使碳酸钠和碳酸氢钠分别转化成溶解度不同的碳酸盐和碳酸氢盐。HCO -3在溶液中存在电离平衡和水解平衡(以水解为主,电离为次,溶液呈碱性):
1.2 要求学生设计尽可能多的可行性鉴别方案,激发、培养学生的创新热情和能力
在部分学生对这个要求感到困难时,教师可提示:此前大家通常关注被鉴别物质的不同性质,现在,由于碳酸钠和碳酸氢钠的性质大致相似(如溶解性、碱性等),在鉴别它们时,还要关注它们性质的差异性。经过启发,学生不难想到一些鉴别思路,例如:
利用溶解性差异鉴别碳酸钠和碳酸氢钠;
利用溶液碱性强弱鉴别碳酸钠和碳酸氢钠;
利用与盐酸反应的快慢鉴别碳酸钠和碳酸氢钠;
利用熱稳定性大小鉴别碳酸钠和碳酸氢钠;
利用与CaCl2溶液或BaCl2溶液的反应现象不同鉴别碳酸钠和碳酸氢钠;
利用与CO2气体反应现象的不同鉴别碳酸钠和碳酸氢钠,等等。
1.3 引导学生注重现象的鲜明性,选择效果较好的鉴别方案
例如,利用溶解性差异(见表1)鉴别碳酸钠和碳酸氢钠时,由于20℃以下碳酸根离子会水合、40℃以上水合碳酸根离子会失水;在30℃左右,碳酸钠溶解度可达到碳酸氢钠溶解度的4倍左右,在这个温度下用溶解度鉴别碳酸钠和碳酸氢钠时的现象最为明显。据此可以具体设计利用溶解性差异鉴别碳酸钠和碳酸氢钠的最佳方案。
1.4 引导学生注重操作的便捷性和可靠性,改进和完善鉴别方案
例如,利用溶液碱性强弱鉴别碳酸钠和碳酸氢钠。由表2数据可见,常温下0.1mol·L-1碳酸钠溶液和碳酸氢钠溶液的pH相差较大,可以便捷地利用溶液碱性的不同鉴别它们。但是,若用pH试纸测量溶液碱性,较难区分碳酸钠和碳酸氢钠;若改用pH计或者手持数字化信息采集技术,则可以获得比较清晰的结果。
实际上,利用溶解性差异鉴别碳酸钠和碳酸氢钠的鉴别方案具有试剂用量较大、操作较复杂、“灵敏度”较低、不易观察等缺点;利用溶液碱性强弱鉴别碳酸钠和碳酸氢钠的鉴别方案需要事先配制准确浓度的试剂,跟真实的未知物鉴别情境有一定差距,同时须使用精确的数字化测量仪器才比较可靠。因此,这两种方案还需要不断改进和完善。
1.5 要求学生完整地表述鉴别方案,明确选择规则
完整、恰当地表述鉴别方案,有利于使学生的思路更清晰,印象更深刻。不断小结和完善鉴别方案,以及明确选择规则,有利于提升学生的学习水平。
选择鉴别方案的原则主要是:依据合理;现象鲜明;结果准确;装置简单;操作简便;有利于理论联系实际;安全绿色等。
2 对几个鉴别实验的讨论
在有关文献中,有一些鉴别方案需要采用比较复杂的仪器或装置,例如:
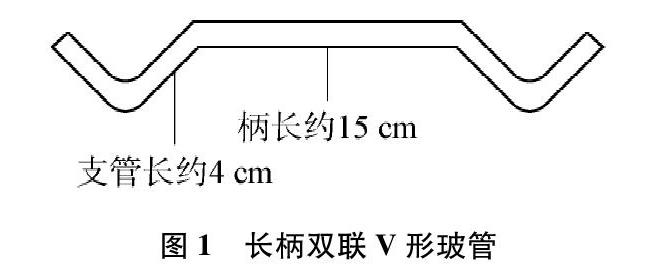
(1) 根据热稳定性大小鉴别碳酸钠和碳酸氢钠的自制专用仪器“长柄双联V形玻管”[4]。
鉴别原理:碳酸氢钠受热时可分解,使固态物质质量变小;生成的二氧化碳和水能使蓝色石蕊试纸变色。
装置说明:图1是根据热稳定性大小鉴别碳酸钠和碳酸氢钠的自制专用仪器“长柄双联V形玻管”[5],可以截取1根外径约10mm、长短合适的硬质玻璃管,在酒精喷灯上弯制而成。
在长柄双联V形玻管的V形底部分别装入粒度相近的1.5克碳酸钠固体和1.5克碳酸氢钠固体,把干燥的蓝色石蕊试纸揉皱塞在两边导管口(不要滑到V形管底部与固体接触),长柄的中心位置系一根粗细合适的棉线,将长柄Ⅴ形玻管悬挂成水平状态(见图2)。
操作过程:①先用酒精灯加热盛有碳酸钠的V形管部分(加热时间60秒左右),此时玻璃管会有轻微的晃动(热气流扰动造成),但玻璃管的长柄仍处于水平状态,而且干燥的蓝色石蕊试纸不变色。该实验现象说明碳酸钠受热后质量不变,即碳酸钠受热不易分解。②再加热盛有碳酸氢钠的Ⅴ形管部分。不到50秒就可以看到盛有碳酸氢钠的V形玻璃管明显上升,而且干燥的蓝色石蕊试纸部分变成浅红色。该实验现象说明,碳酸氢钠受热后质量明显减少,即碳酸氢钠受热易分解,并且产生了酸性气体。
该组实验操作不算太复杂,用时较短,有趣味性、微型化等特点;实验中可以观察到先加热时装置不倾斜、后加热时装置倾斜等现象。该装置像天平一样,能让学生直观地感受到反应过程中固体质量的变化。但试剂用量略大,灵敏度不易控制,操作有一定难度。
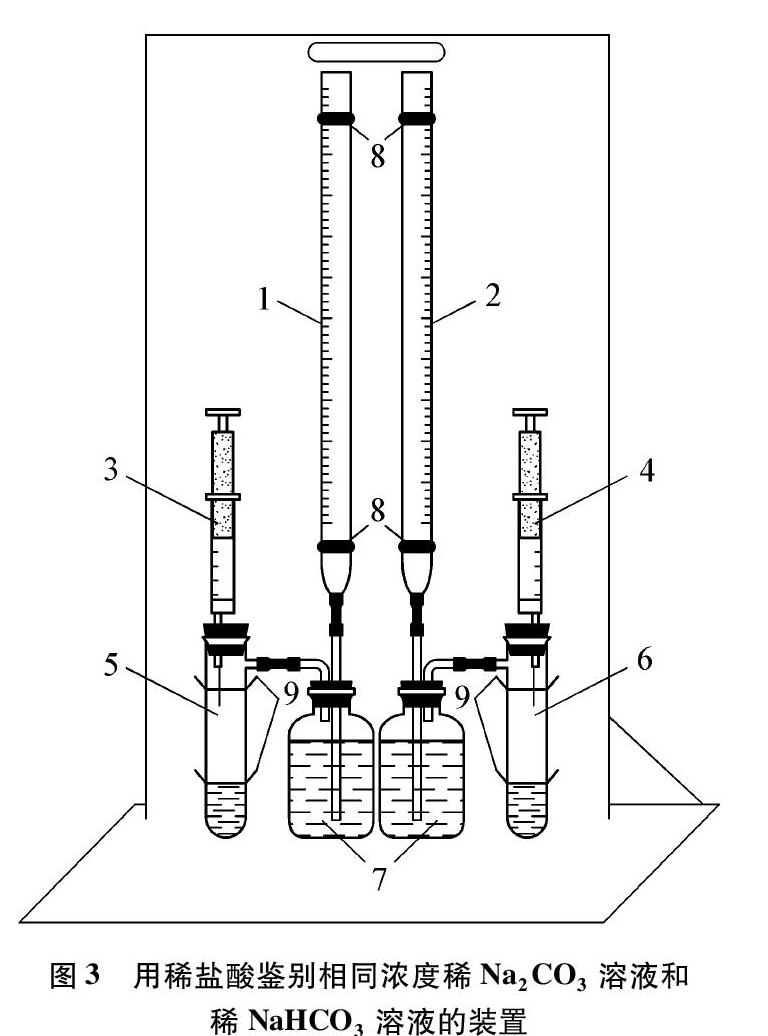
(2) 用与盐酸反应的快慢鉴别碳酸钠和碳酸氢钠的自制专用装置(见图3)。
鉴别原理:等质量的两种固体与盐酸反应时,NaHCO3反应快,消耗的盐酸少,产生的CO2多。
装置说明:图3中1、2是用25mL规格碱式滴定管代替的量气管,通过气体压上来的液体的量来测量产生的气体体积;3、4是针筒,用于定量注入稀盐酸;5、6是具支试管,事先分别加入等体积等浓度的Na2CO3溶液和NaHCO3溶液;7中装有滴加酚酞的饱和NaHCO3溶液,因为溶液呈碱性而显红色,当产生的气体将红色水溶液压入量气管,能清晰地看到红色液柱上升的位置,即指示反应产生气体的量;8,9均为用橡胶制成的固定圈。
操作步骤:①如图所示安装好仪器。②分别向试管中加入3mL 0.3mol·L-1 Na2CO3溶液和3mL 0.3mol·L-1 NaHCO3溶液。分别用两个注射器吸取6mL 0.3mol·L-1的稀盐酸,把注射器连接到具支试管上面,塞紧橡皮塞。③分别请两位学生以相同速度分三次压入相同量的盐酸:先加2mL,观察两边水柱的变化。反应结束时,发现一边水柱上升,一边不升。然后再同时加入2mL盐酸,引导学生观察两边液柱的变化快慢。第三次再同时加入2mL盐酸,发现反应结束时两边液面上升高度大致相同。
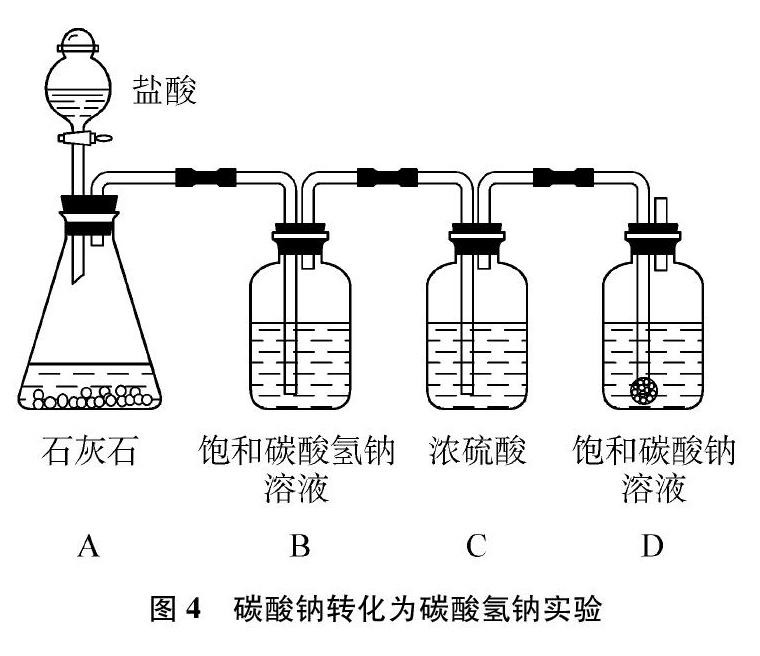
(3) 利用与CO2气体反应现象的不同鉴别碳酸钠和碳酸氢钠的自制专用装置(见图4)。
鉴别原理:同温下碳酸钠的溶解度大于碳酸氢钠,从理论上讲,将CO2气体通入饱和碳酸钠溶液中,应比较容易析出碳酸氢钠晶体:Na2CO3+CO2+H2O2NaHCO3;CO2气体与饱和碳酸氢钠溶液不反应,所以可以根据将CO2气体分别通入饱和Na2CO3溶液和饱和NaHCO3时是否析出晶体来鉴别两溶液。但是,在向饱和Na2CO3溶液中通入CO2气体时常常很难看到晶体析出,原因是CO2气体在水中的溶解度较小,通入的CO2气体只有很少一部分能与碳酸钠溶液反应,绝大多数CO2气体散逸到空气中。由于长时间看不到晶体析出容易使人产生误解,作出错误判断。
操作步骤:将块状的石灰石敲碎;滴入浓度较大的盐酸;通过洗气装置B、 C将CO2气体中混有的HCl气体和水蒸气除尽;导管出口使用多孔球泡;CO2气体通入时间要足够长,使生成的碳酸氢钠足够多。随着反应的进行,生成的碳酸氢钠越来越多,碳酸氢钠在水中先达到饱和,再生成的碳酸氢钠以“沉淀”的形式析出。
将CO2气体连续通入饱和碳酸钠溶液中约8分钟,发现溶液开始浑浊;约12分钟,可发现有较多白色细小晶体析出;约15分钟后有大量白色晶体析出。
成功关键:①碳酸钠溶液要饱和;②CO2气体要过量。
这3个鉴别方案中,除了方案(1)之外,另外兩个的装置和操作都比较复杂,且实验用时过长,不适宜作为鉴别方案,也不适合课堂演示采用。必要时,可以事先在实验室拍成视频,然后在课堂上播放。
参考文献:
[1][2]北京师范大学化学系无机化学教研室编. 简明化学手册[M]. 北京:北京出版社,1980:182.
[3]朱建民. 碳酸氢钠溶液的pH与其浓度关系探讨[J]. 科教导刊(电子版),2018,(22):82.
[4][5]陈立铭,李德前. 利用长柄V型玻璃管比较碳酸钠和碳酸氢钠的热稳定性[J]. 化学教育,2014,(21):56~57.

