SERPINC1基因突变致肺血栓栓塞家系研究
石晔飞,徐 徐,袁杨杨,李淼新,彭文辉
(1.同济大学医学院,上海 200092;2.中山大学中山医学院,广州 510080;3.同济大学附属第十人民医院心血管内科,上海 200040)
肺栓塞(pulmonary embolism,PE)是以各种栓子阻塞肺动脉或其分支为发病原因的一组疾病或临床综合征的总称,主要包括肺血栓栓塞(pulmonary thromboembolism,PTE)、脂肪栓塞、羊水栓塞、空气栓塞等。其中,PTE 为肺栓塞最常见的类型[1]。抗凝血酶是一种关键的内源性抗凝血剂,其缺乏是血栓形成的危险因素,高达80%的抗凝血酶缺乏患者具有SERPINC1 基因缺陷[2]。本文通过全外显子组测序,确诊了1 例由 SERPINC1 基因 c.1277C>T(p.Ser426Leu)突变导致的肺血栓栓塞家系,现报道如下。
1 病例资料
先证者:男,40 岁,2015年 10月因“活动后气促3 天”于同济大学附属第十人民医院就诊,查血小板254×109/L,凝血酶原时间(PT)12.1 s,活化部分凝血活酶时间(APTT) 24.5 s,凝血酶时间(TT)19.3 s,抗凝血酶Ⅲ活性102%,D-二聚体 7.51 mg/L,肺部CTA:右肺动脉主干及两肺诸叶肺动脉分支多发栓塞(图1),诊断为肺栓塞,予低分子肝素抗凝治疗,好转出院后不规律服用达比加群酯抗凝治疗,自行停药半年后,于2018年10月因“喘息1 天伴晕厥”再次到同济大学附属第十人民医院就诊,查血小板206×109/L,PT 17.4 s,APTT 40.2 s,TT 29.4 s,抗凝血酶Ⅲ活性104%,D-二聚体58.96 mg/L,复查肺部CTA:两肺肺动脉主干及分支多发栓塞(图2),诊断为肺栓塞,于阿替普酶溶栓、低分子肝素抗凝,好转后改为口服利伐沙班抗凝治疗。
先证者之父,男,65 岁,2017年 7月因“右侧胸痛”就诊,查血小板 203×109/L,PT 12.6 s,APTT 27.6 s,TT 11.6 s,抗凝血酶Ⅲ活性 108%,D-二聚体1.929 mg/L,肺部CTA:右肺动脉主干充盈缺损(图3),诊断为肺栓塞,予低分子肝素抗凝治疗,好转口服达比加群酯抗凝治疗。
先证者母亲、妻子、女儿无胸痛不适症状,凝血相关指标均正常;先证者叔叔及其妻儿均无胸痛不适症状,凝血相关指标均正常;先证者祖代均已过世,无肺栓塞相关症状。在该家系中,肺栓塞存在遗传倾向,总结该家系遗传系谱图如图4 所示。

图1 先证者2015年肺部CTAFig.1 Lung CTA of the proband in 2015
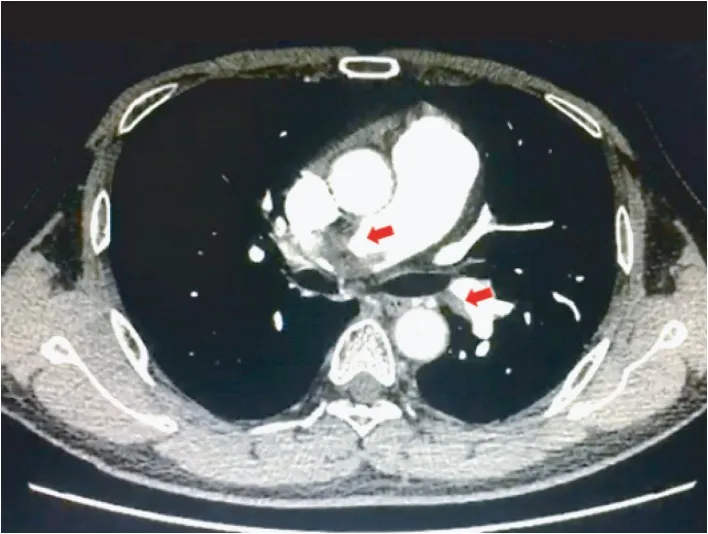
图2 先证者2018年肺部CTAFig.2 Lung CTA of the proband in 2018
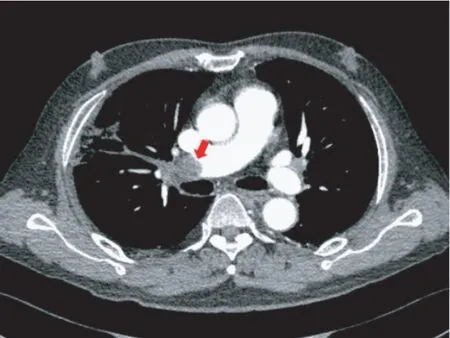
图3 先证者之父2017年肺部CTAFig.3 Lung CTA of the father of proband in 2017

图4 先证者家系遗传系谱图Fig.4 The family tree of the proband
2 基因测序及分析
2.1 血液样本采集及基因测序
取得患者及家属同意后签署知情同意书,采集该家系成员的外周静脉血5 mL,委托上海中优精准医疗科技股份有限公司进行全外显子组基因测序。
2.2 生物信息学分析及基因致病性的判断
获得测序数据后,按照既往研究所采用的方法[3],使用 GATK、Strelka2 和 Sentieon 分别进行变异位点的检测,将所得到结果分别通过KGGSeq 过滤注释分析,并用Phenolyzer 进行表型相关性分析。按照隐性模式筛选得到唯一的候选基因TMEM104(rs3803784),没有关于这个基因的功能研究,且在模式生物数据库中也没有相关的报道,不考虑。按照显性遗传模式筛选出两位患者存在SERPINC1 基因c.1277C>T(p.Ser426Leu)杂合突变,根据 Phenolyzer 表型分析结果,表明SERPINC1 基因与凝血功能相关,该基因突变会导致肺栓塞、血栓栓塞、静脉血栓形成、异常栓塞形成等表型。对家系成员该基因位点进行Sanger 测序验证(图5),先证者与其父亲存在该位点的杂合突变,其他成员该位点无突变,证实该家系为SERPINC1 基因 c.1277C>T(p.Ser426Leu)突变致病。

图5 先证者家系SERPINC1 基因Sanger 测序Fig.5 The results of Sanger sequencing of proband's family
3 讨 论
PTE 和深静脉血栓形成(deep vein thrombosis,DVT)统称为静脉血栓栓塞(venous thromboembo⁃lism,VTE),全球每年约有1 000 万例VTE 发生,是继心肌梗死和中风之后的第 3 大心血管疾病[4⁃5]。PTE 与DVT 实质上为VTE 在不同部位、不同阶段的不同表现形式[6⁃7]。VTE 危险因素包括遗传性和获得性两大类,遗传性危险因素主要包括抗凝血酶缺乏、凝血因子Ⅴleiden 突变、凝血酶原G20210A 基因突变、蛋白C 缺乏、蛋白S 缺乏等,获得性危险因素主要包括高龄、癌症、肥胖、慢性病、妊娠、口服避孕药、手术、外伤等[8]。其中,SERPINC1 基因突变引起的遗传性抗凝血酶缺乏扮演着重要角色[9]。
SERPINC1 基因位于 1q23⁃25.1,跨越 13.4 kbp,包含 7 个外显子[10]。该基因编码的抗凝血酶Ⅲ(antithrombin Ⅲ,AT Ⅲ)属于丝氨酸蛋白酶抑制剂家族,在肝脏合成464 个氨基酸组成的蛋白质前体后,剪切去除32 个前导氨基酸后形成432 个氨基酸组成的成熟蛋白质[11]。AT Ⅲ的生理功能是灭活凝血酶(Ⅱa 因子)和 Xa 因子,同时对因子Ⅸa、Ⅺa、Ⅻa、ⅤⅡa 也有一定的作用[12⁃13]。该蛋白质包括两个重要的功能区:位于N 端的肝素结合区和位于C端的反应位点。AT Ⅲ的反应位点结合凝血酶活性中心,形成稳定的抗凝血酶-凝血酶复合物,进一步灭活凝血酶。在循环血液中,AT Ⅲ的抗凝活性比较弱,当与肝素中特殊的戊糖序列结合后,AT Ⅲ构象发生变化,暴露出反应中心环,发挥出有效的抗凝作用[14⁃15]。在肝素存在的条件下,AT Ⅲ的抗凝作用可以增加数千倍[16]。AT Ⅲ是最重要的凝血因子抑制剂,具有较低的多态性,揭示了该分子对轻微遗传缺陷的敏感性,任何错义突变都有可能导致抗凝血酶功能改变[10]。
遗传性抗凝血酶缺乏症是一种罕见的常染色体显性遗传病,其特征是反复 VTE[17]。1965年,Egeberg 报道了首例遗传性抗凝血酶缺乏症[18],之后的几十年里,不同突变导致的遗传性抗凝血酶缺乏症被发现。根据人类基因突变数据库(HGMD)的报告,截至2019年1月,已经发现有420 种不同的SERPINC1 基因突变导致遗传性抗凝血酶缺乏。在中国人群中,已有关于遗传性抗凝血酶缺乏所致肺栓塞的报道,如p.Met1Leu[19]、p.Cys29Ser[20]、p.Arg13Gln、p.Ser82Arg[21]。而在本研究中,首次报道了中国人群中p.Ser426Leu 突变(在成熟蛋白中为Ser394[22])所致的肺栓塞,丰富了中国人群的抗凝血酶基因突变数据库。
根据血浆中检测到的抗凝血酶的水平,可以将遗传性抗凝血酶缺乏症分为两大类型:Ⅰ型(绝对缺乏)和Ⅱ型(结构异常)。Ⅰ型抗凝血酶缺乏症表现为血液中抗凝血酶活性和抗凝血酶浓度均降低,属于抗凝血酶绝对缺乏。产生这种情况的原因是SERPINC1 基因发生碱基的插入或缺失,影响了mRNA 正常合成,导致抗凝血酶的合成障碍。Ⅱ型抗凝血酶缺乏症表现为抗凝血酶水平正常但活性降低,根据功能缺陷区分为3 种亚型:Ⅱa 型(反应位点型),突变位于反应中心环,导致编码的蛋白失去正常的活性,灭活凝血酶和Xa 因子能力大大降低,常见于382、384、392、393 和394 密码子;Ⅱb 型(肝素结合位点型),突变位点位于肝素结合区,影响肝素与抗凝血酶的相互作用,常见于 41、47、99 和 129 密码子;Ⅱc(多效应型),突变导致反应性和肝素结合能力的异常,常见于 402、404~407 和 429 密码子[23⁃24]。结合本文报道家系的突变位点,该家系属于Ⅱa 型。
研究发现,常规抗凝血酶检测存在一定缺陷,使用人的凝血酶测定可能缺乏特异性,并且使用Xa 因子测定可能无法检测到Ⅱa 型,比如AT Cambridge Ⅱ(p.Ala416Ser)和 AT Denver(p.Ser426Leu),使用牛凝血酶作为反应物检测时,检测到了低水平的AT 活性,但当使用Xa 因子作为反应物时却检测到AT 活性及抗原水平正常[13]。随着测序技术的快速发展,遗传分析诊断疾病的应用越来越普遍,使用遗传分析方法检测编码抗凝血酶基因SERPINC1 中的突变,已成为鉴定遗传性抗凝血酶缺陷症的最佳方法[25]。
根据2014年欧洲心脏病学会急性肺栓塞诊治指南,抗凝治疗是预防早期死亡和复发及致命性VTE 的有效手段[26],新型口服抗凝药物 Xa 因子拮抗剂利伐沙班和凝血酶抑制剂达比加群酯的疗效不劣于使用维生素K 拮抗剂的标准治疗方案,同时出血风险更低,无须频繁监测凝血功能[27⁃28]。在该家系中,达比加群酯和利伐沙班均有使用。
综上所述,此先证者及其父亲存在SERPINC1基因 c.1277C>T(p.Ser426Leu)突变,突变后 AT Ⅲ灭活凝血酶和Xa 因子的能力减弱,血液处于高凝状态,易形成深静脉血栓,并导致肺动脉血栓栓塞。对于遗传性抗凝血酶缺乏症患者,如能早期行基因检测明确是否有致病突变,有利于疾病早期预防血栓,并帮助选择合适的抗凝药物,对于疾病的治疗及预后具有重要意义。

