玻璃体内注射康柏西普对糖尿病性黄斑水肿患者黄斑区视网膜血管密度和中心凹无血管区面积的影响
马若璇 冉振龙 张月玲 顾朝辉
糖尿病性黄斑水肿(diabetic macular edema,DME)是糖尿病患者视力受损的主要原因之一。虽然DME的确切发病机制尚未完全阐明,但已公认血管内皮生长因子(vascular endothelial growth factor,VEGF)在其发生发展过程中起着重要作用[1]。大量研究证明,抗VEGF治疗能有效抑制视网膜新生血管形成,减轻血管渗漏,促进黄斑水肿消退,改善患者视力,因而已成为DME的一线治疗方法[2-3]。但目前针对抗VEGF治疗对视网膜微循环的影响观点不一。有研究认为,频繁的抗VEGF治疗可延缓视网膜毛细血管闭塞的进展,另一些研究则持相反的观点[4-11]。本研究应用光学相干断层扫描血管成像(OCTA)观察DME患者玻璃体内注射抗VEGF药物康柏西普治疗前后视网膜毛细血管的血管密度(vessel density,VD)和中心凹无血管区(foveal avascular zone,FAZ)面积,以评价抗VEGF治疗对DME患者黄斑区视网膜微循环的影响。
1 资料与方法
1.1 一般资料收集2018 年3月至2019年6月在保定市第一中心医院眼科确诊为DME患者36例(36眼)的临床资料,其中男17例(17眼)、女19例(19眼),年龄为42~67(59.35±6.20)岁; 糖尿病病程为4~22(15.44±2.70)a; 术前最佳矫正视力(BCVA)为0.05~0.60。本研究通过保定市第一中心医院伦理委员会批准。所有患者治疗前均签署知情同意书及手术同意书。
纳入标准:依据2014年我国糖尿病视网膜病变临床诊疗指南[8],经检眼镜、眼底照相、光学相干断层扫描(OCT)及眼底血管荧光造影(FA)检查,确诊为Ⅲ~IV期糖尿病视网膜病变合并黄斑水肿,黄斑区中心视网膜厚度(central retinal thickness,CRT)大于250 μm,无瘢痕和增生组织。排除标准:合并其他眼底疾病,如视网膜静脉阻塞、老年性黄斑变性等;合并严重青光眼和白内障等眼病;既往有视网膜激光光凝史、玻璃体内注药史及内眼手术史;屈光介质混浊、配合度欠佳影响成像清晰度,OCTA的扫描质量系数<6/10;对治疗方案不依从或失访的患者。
1.2 方法所有患者均接受连续3个月每月1次的玻璃体内注射0.5 mg康柏西普治疗。所有患者术前均行BCVA、非接触式眼压、裂隙灯生物显微镜、间接眼底镜、OCT及FA检查。BCVA采用国际标准视力表进行,利用OCT测量黄斑区CRT。完成上述检查后分别于治疗前及第1次、第2次、第3次治疗后行OCTA(蔡司CIRRUSTMOCT血管成像5000)检查,采用AngioPlex 模式对黄斑区进行3 mm×3 mm范围3次横向及纵向十字扫描,应用系统内置分析软件对获取的视网膜脉络膜血流图像进行分层并测量分析FAZ面积,应用Image J软件将浅层视网膜毛细血管(superficial retinal capillary plexus,SCP)和深层视网膜毛细血管(deep retinal capillary plexus,DCP)图像转换为8位灰度图像之后计算VD[9]。由同一名熟练的眼科技师完成所有患者的OCTA检查。由同一术者进行所有玻璃体内注药术。

2 结果
2.1 抗VEGF治疗前后BCVA、CRT的变化DME患者接受抗VEGF治疗前及3次治疗后的BCVA分别为0.26±0.02、0.42±0.04、0.51±0.04及0.54±0.04,治疗后BCVA较治疗前显著提高,差异具有统计学意义(t=14.135,P<0.05);接受抗VEGF治疗前及3次治疗后的CRT分别为(472.42±9.68)μm、(339.33±6.73)μm、(320.89±7.60)μm、(300.14±5.60)μm,治疗后CRT均较治疗前显著下降,差异具有统计学意义(t=17.948,P<0.05)。
2.2 抗VEGF治疗前后VD的变化DME患者接受抗VEGF治疗后SCP的VD与治疗前相比差异无统计学意义(t=0.310,P>0.05);治疗后DCP的VD与治疗前相比差异也无统计学意义(t=0.664,P>0.05)。见表1。
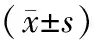

类型治疗前VD/%第1次治疗后VD/%第2次治疗后VD/%第3次治疗后VD/%t值P值SCP44.27±0.0444.28±0.0444.32±0.0444.32±0.040.310>0.05DCP52.96±0.0452.94±0.0452.87±0.0452.87±0.040.664>0.05
2.3 抗VEGF治疗前后FAZ面积的变化DME患者接受抗VEGF治疗后SCP的FAZ面积与治疗前相比差异无统计学意义(t=0.495,P>0.05);治疗后DCP的FAZ面积与治疗前相比差异也无统计学意义(t=0.701,P>0.05)。见表2。
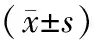

类型治疗前FAZ/mm2第1次治疗后FAZ/mm2第2次治疗后FAZ/mm2第3次治疗后FAZ/mm2t值P值SCP0.56±0.080.56±0.080.56±0.080.56±0.080.495>0.05DCP0.75±0.100.75±0.090.75±0.090.75±0.090.701>0.05
3 讨论
已有研究证实,糖尿病患者长期高血糖引起微血管功能受损,使视网膜组织持续缺血缺氧引发一系列氧化应激及炎症反应,导致VEGF过度表达,并破坏血-视网膜屏障(BRB)的结构与功能,致使血浆及脂质等血管内成分渗出并积聚于视网膜内,形成黄斑水肿;而黄斑水肿的形成又负反馈作用于原有视网膜组织缺血缺氧的状态,加剧VEGF的高表达,促进新生血管的形成和生长,造成疾病不断进展[10]。本研究通过对接受连续3个月每月1次玻璃体内注射康柏西普的DME患者随访观察,证实抗VEGF治疗可以有效减轻黄斑水肿,改善DME患者视力。
OCTA是近年来出现的一种快速非侵入性医学成像技术,它克服了FA检查存在的荧光素渗漏和荧光遮蔽,以及无法准确评估DCP等缺点,可以提供视网膜、脉络膜微血管结构的分层三维图像,实现对黄斑区视网膜毛细血管VD及FAZ面积的量化评估。
Campochiaro等[6]利用FFA测量DME患者抗VEGF治疗前后黄斑区无灌注区面积,发现VEGF水平的升高与黄斑区视网膜毛细血管无灌注区的形成密切相关,降低玻璃体内VEGF浓度可以减缓甚至改善黄斑区无灌注情况。然而有研究学者认为,玻璃体内VEGF浓度的升高是恢复黄斑区血流灌注一种补偿机制,虽然经抗VEGF治疗后黄斑水肿明显改善,但抗VEGF药物同时会加速DME患者视网膜毛细血管闭塞情况的进展,继而增加视力受损的严重程度[11-12]。目前关于抗VEGF治疗是否影响黄斑区视网膜灌注及是否会导致黄斑区缺血情况的加重仍存在争议。
Hwang等[13]和Sim等[14]研究表明,VD和FAZ面积分别可作为观察毛细血管灌注和评估缺血程度的指标。与健康人群相比,糖尿病患者视网膜血管密度下降,FAZ面积扩大,并且伴随糖尿病视网膜病变的进展,VD和FAZ面积发生不同程度的恶化。本研究利用OCTA观察DME患者在抗VEGF治疗前后视网膜微血管灌注情况的变化,结果显示:DME患者在抗VEGF治疗后黄斑区3 mm×3 mm范围SCP、DCP的VD和FAZ面积与治疗前相比差异均无统计学意义(均为P>0.05),与Campochiaro等[6]研究结果基本一致。表明DME发生发展过程中VEGF的异常升高已经导致视网膜血管发生不可逆性损伤,短期抗VEGF治疗不能使已闭塞的毛细血管发生再灌注;治疗后VD和FAZ面积没有出现明显加重表明,在视网膜血管已经发生损伤的情况下,抗VEGF治疗未对DME患者拱环周围视网膜毛细血管闭塞情况造成进一步损伤。
综上所述,本研究结果表明,抗VEGF药物康柏西普玻璃体内注射治疗DME疗效显著,能有效提高DME患者的BCVA,降低CRT,短期抗VEGF治疗前后黄斑区视网膜毛细血管VD及FAZ面积没有明显改变。在抗VEGF治疗DME的过程中,OCTA这一检查方式为DME发生发展转归机制、监测视网膜微循环变化以评估抗VEGF治疗DME的临床疗效及指导后续治疗等方面提供了重要量化指标。本研究的局限性包括:样本量较小,各组别眼数较少,且仅观察了DME经3次抗VEGF治疗后VD及FAZ面积的变化,尚不足以论证长期抗VEGF治疗对黄斑区微循环的影响。需要更大样本量、更长观察时间、更多相关因素以及更细微的深入研究以明确抗VEGF治疗在解剖和功能方面对视网膜微循环的影响,进而制定维持或增加视网膜微循环的治疗策略,以更好地维持和改善DME患者长期的视觉预后。

