Raf-1激酶抑制蛋白(RKIP)对糖尿病大鼠视网膜神经损伤的保护作用△
吴传玲 刘安琪 左中夫 刘文强 刘学政
糖尿病视网膜病变(DR)是糖尿病最严重、最主要的并发症之一,DR的发病率随着糖尿病病程的延长而增加[1],是成年人视力减退的重要原因之一[2]。近年来发现,DR视网膜中p38丝裂原激活蛋白激酶(p38-mitogen-activated protein kinase,p38-MAPK)通路被激活,Müller细胞中的胶质细胞谷氨酸转运体(L-glutamate/L-asparate transporter,GLAST)活性下降,谷氨酸堆积,产生细胞毒性,导致视网膜神经节细胞(retinal ganglion cell,RGC)不可逆性死亡[3]。Raf-1激酶抑制蛋白(raf-1 kinase inhibitory protein,RKIP)是磷脂酰乙醇胺结合蛋白家族成员,是MAPK通路的负调节剂途径[4]。研究表明,RKIP在神经退行性疾病相关的神经元凋亡和认知缺陷中起重要作用,视网膜损伤后RKIP的表达明显降低,RKIP过表达可抑制RGC凋亡[5]。因此,本研究通过注射含有RKIP基因片段的慢病毒载体拟探讨RKIP通过p38-MAPK通路对糖尿病(DM)大鼠视网膜神经损伤的保护作用,进一步为DR的发生发展和发病机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物健康清洁级SD大鼠48只,体质量220~250 g(锦州医科大学实验动物中心),每天给予清洁级饲料,室温环境饲养,自由饮食水,通风良好,12 h光照昼夜循环。
1.1.2 试剂与仪器链脲佐菌素(streptozotocin,STZ,美国Sigma公司);LV-RKIP(加拿大ABM生物科技有限公司);GLAST、谷氨酰胺合成酶(glutamine synthetase,GS)、RKIP和p38-MAPK一抗及免疫荧光二抗(英国Abcom公司);Western blot二抗(北京索莱宝科技有限公司);荧光倒置显微镜(日本Olympus公司);石蜡切片机(德国Leica公司);凝胶成像系统、垂直电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 动物模型建立及实验分组STZ粉末溶于0.01 μmol·L-1、pH 4.5的柠檬酸钠溶液中,使用前配制,避光保存。SD大鼠禁饮食12 h后,采用单次腹腔注射STZ(50 mg·kg-1)建立DM模型,72 h后检测尾静脉血糖,血糖>16.7 mmol·L-1的大鼠为DM模型建立成功。将SD大鼠随机分成对照组、糖尿病组、空白组、RKIP组,每组12只,其中糖尿病组、空白组和RKIP组大鼠为DM模型大鼠。
1.2.2 RKIP慢病毒载体玻璃体内注射模型诱导成功后参考文献[5]RKIP组于DM模型建成后第2周,腹腔注射水合氯醛全身麻醉,盐酸丙美卡因眼球表面麻醉,随机选取大鼠一侧眼球,在解剖显微镜下用微量进样器抽取5 μL RKIP慢病毒载体沿内眦角膜缘后1.0 mm处注入玻璃体内,而空白组注射等量空白病毒。对照组和糖尿病组按照上述方法在玻璃体内注射等量生理盐水。10周后取各组视网膜组织进行各项指标检测。
1.2.3 Western blot检测各组大鼠视网膜中RKIP、p38-MAPK蛋白表达每组随机取6只大鼠的新鲜视网膜组织加入蛋白裂解液,快速剪碎后使用超声波裂解仪裂解组织,4 ℃ ,12 000 r·min-1离心25 min,取上清。BCA法测定蛋白浓度,加入10 μL 样品电泳,SDS-聚丙烯酰胺凝胶电泳进行蛋白分离,转膜后10 g·L-1BSA室温封闭2 h;加入一抗(兔抗大鼠RKIP,13000;兔抗大鼠p38-MAPK,13000;兔抗大鼠GAPDH,13000),4 ℃孵育过夜。TBST洗涤4次,每次5 min;加入二抗(生物素标记的山羊抗兔,13000)室温孵育2 h,TBST洗涤4次,每次5 min;ECL化学发光试剂盒显影,以GAPDH为内参照进行校正,计算目的蛋白RKIP及p38-MAPK的相对表达量。
1.2.4 免疫荧光化学检测视网膜中GLAST、GS表达每组随机取6只大鼠,100 g·L-1水合氯醛全身麻醉后,40 g·L-1多聚甲醛心脏灌流,快速取双侧眼球,石蜡包埋切片,厚度为5 μm,脱蜡至水,抗原修复后于PBS中洗涤3次,每次3 min;加入体积分数3%山羊血清和体积分数0.3%Triton-100室温孵育30 min,滴加一抗(兔抗大鼠GLAST,1100;小鼠抗大鼠GS,1100),4 ℃过夜。PBS洗涤3次,每次3 min,滴加二抗(A594标记驴抗兔,1500;A488标记羊抗小鼠,1500),室温避光孵育2 h,PBS洗涤3次,每次3 min,抗荧光封片剂封片,倒置显微镜下观察并拍照。
1.2.5 HE染色检测RGC密度四组视网膜组织切片脱蜡至水,PBS洗涤3次,每次3 min,苏木素浸染2 min,分化液10 s,置于碱水中返蓝2 min,伊红浸染2 min。梯度酒精脱水,二甲苯透明,中性树胶封片,倒置显微镜下观察并拍照。
1.3 统计学方法采用SPSS 21.0统计学软件进行单因素方差分析,所得数据以均数±标准差表示,采用SNK-q检验进行组间两两比较。检验水准:α=0.05。
2 结果
2.1 Western blot检测各组大鼠视网膜RKIP、p38-MAPK蛋白表达四组RKIP蛋白相对表达量比较,差异有统计学意义(F=2809.42,P<0.01)。与对照组相比,糖尿病组RKIP蛋白相对表达量明显下降(P<0.01);与糖尿病组相比,空白组RKIP相对表达量无明显差异(P>0.05),RKIP组RKIP蛋白相对表达量明显增加(P<0.01)。四组p38-MAPK蛋白相对表达量比较,差异有统计学意义(F=3388.34,P<0.01)。与对照组相比,糖尿病组p38-MAPK蛋白相对表达量明显增加(P<0.01);与糖尿病组相比,空白组p38-MAPK蛋白相对表达量无明显差异(P>0.05),RKIP组p38-MAPK蛋白相对表达量明显下降(P<0.01)。见表1、图1。
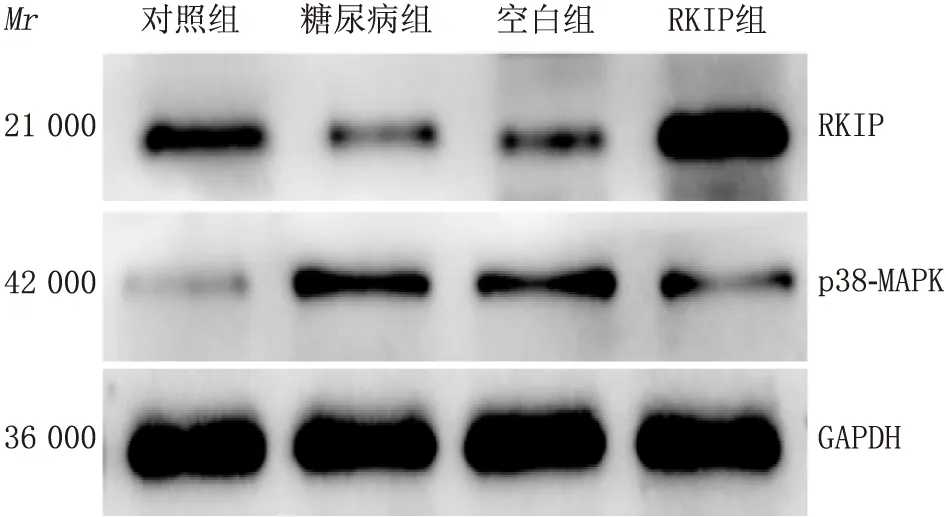
图1 Western blot 检测各组RKIP、p38-MAPK蛋白相对表达量
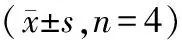
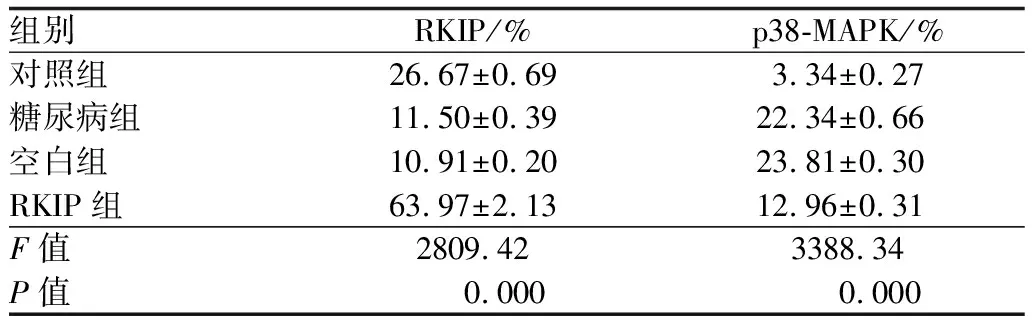
组别RKIP/%p38-MAPK/%对照组26.67±0.693.34±0.27糖尿病组11.50±0.3922.34±0.66空白组10.91±0.2023.81±0.30RKIP组63.97±2.1312.96±0.31F值2809.423388.34P值0.0000.000
2.2 免疫荧光化学检测结果
2.2.1 各组大鼠视网膜GLAST免疫荧光化学检测结果各组大鼠视网膜各层均有GLAST表达。与对照组相比,糖尿病组视网膜GLAST表达在内核层及外核层明显减少(P<0.01);与糖尿病组相比,空白组视网膜GLAST表达无明显差异(P>0.05),而RKIP组GLAST表达在内核层及外核层明显增加(P<0.01)。各组间光密度(A)值比较,差异有统计学意义(F=82.37,P<0.01)。见表2与图2。
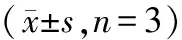
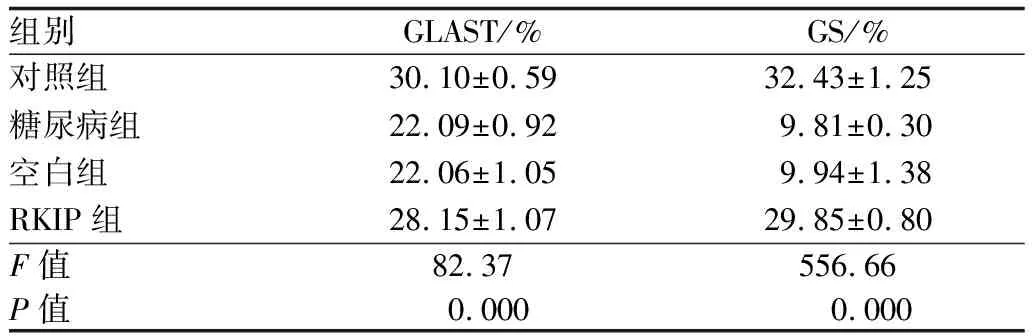
组别GLAST/%GS/%对照组30.10±0.5932.43±1.25糖尿病组22.09±0.929.81±0.30空白组22.06±1.059.94±1.38RKIP组28.15±1.0729.85±0.80F值82.37556.66P值0.0000.000
2.2.2 各组大鼠视网膜GS免疫荧光化学检测结果免疫荧光化学检测结果表明,GS在各组大鼠视网膜全层均有表达。各组间A值比较,差异有统计学意义(F=556.66,P<0.01)。与对照组相比,糖尿病组和空白组视网膜GS表达均明显减少(均为P<0.01),而RKIP组视网膜GS表达无明显变化(P>0.05);与糖尿病组相比,空白组视网膜GS表达无明显变化(P>0.05),而RKIP组视网膜GS表达明显增加(P<0.01)。见表2与图3。
2.3 HE染色结果对照组、糖尿病组、空白组以及RKIP组大鼠视网膜RGC密度分别为(423.26±3.74)个·mm-2、(216.02±10.47)个·mm-2、(215.40±13.51)个·mm-2、(412.49±11.67)个·mm-2。各组间比较,差异有统计学意义(F=479.97,P<0.01)。与对照组相比,糖尿病组和空白组RGC密度均明显降低(均为P<0.01),而RKIP组RGC密度无明显变化(P>0.05)。见图4。
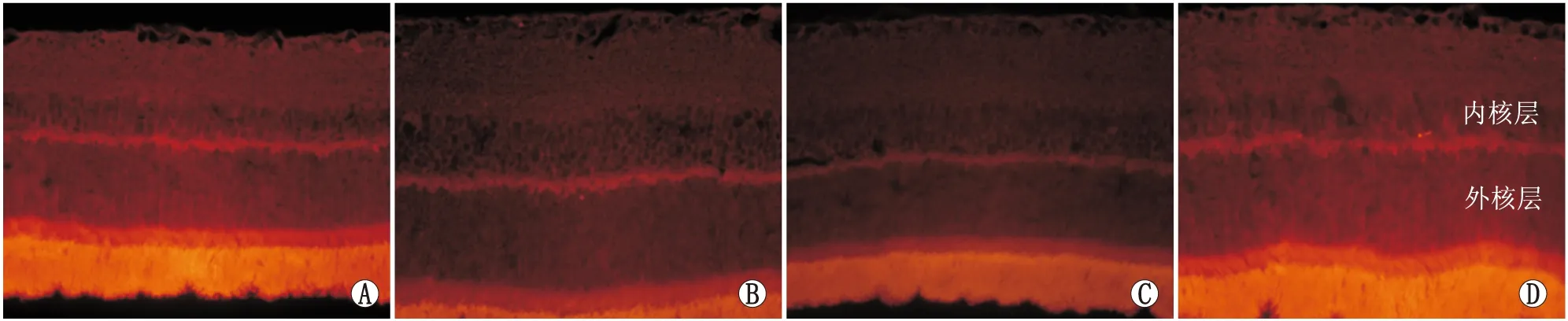
图2 各组大鼠视网膜Müller细胞GLAST表达(红色,×400) A:对照组;B:糖尿病组;C:空白组;D:RKIP组
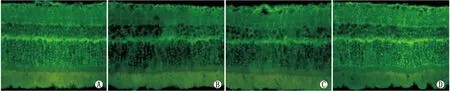
图3 各组大鼠视网膜Müller细胞GS表达(绿色,×400) A:对照组;B:糖尿病组;C:空白组;D:RKIP组
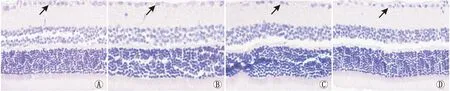
图4 HE染色观察各组视网膜RGC密度(箭头,×400) A:对照组;B:糖尿病组;C:空白组;D:RKIP组
3 讨论
DR是糖尿病最严重、最主要的并发症之一,会引起成年人视力严重减退。Müller细胞作为哺乳动物视网膜中主要的胶质细胞类型,是维持视网膜RGC功能的关键细胞[6]。RKIP是磷脂酰乙醇胺结合蛋白家族的成员,最初从牛脑中纯化,是一种保守的小胞浆蛋白,其在神经发育、心脏功能和精子发生等过程中均具有重要的生理功能[7-8]。此外,RKIP作为Raf/MAPK信号级联的调节因子与MAPK通路的负调节剂途径[4],其在神经元凋亡和神经退行性疾病相关的遗传缺陷中也起重要作用[5]。
MAPK级联可影响细胞增殖、分化和凋亡等多种生物学过程[9]。p38-MAPK是由各种细胞应激和细胞因子激活的主要MAPK途径之一,如促炎细胞因子、生长因子和活性氧。p38-MAPK在糖尿病诱导的视网膜炎症中起重要作用,降低糖尿病中p38-MAPK的活化能够抑制糖尿病诱导的内皮细胞和周细胞的死亡与视网膜毛细血管的退化,这为抑制糖尿病视网膜早期病变和糖尿病其他并发症的发展提供了一种新的治疗方法[10]。有研究表明,RKIP基因敲除可以诱导小鼠体内 p38-MAPK激活[11],RKIP的缺失会增强p38-MAPK的活化[12],而RKIP的过表达可以抑制P38-MAPK的磷酸化[13]。
GLAST是视网膜中主要的神经胶质谷氨酸转运蛋白,仅在Müller细胞中表达。 GS是参与神经胶质细胞中谷氨酸代谢的主要酶。细胞外谷氨酸经过GLAST介导摄取进入Müller细胞,通过GS迅速转化为谷氨酰胺,随后运回神经元进行谷氨酸再合成[14]。Müller细胞可将过多的谷氨酸转化为无毒的谷氨酰胺,这对维持视网膜正常功能尤为重要[15]。RGC中含有丰富的N-甲基-D-天冬氨酸(NMDA)谷氨酸受体,使它们特别容易受到谷氨酸兴奋毒性的影响。谷氨酸是光感受器-双极-神经节细胞回路的主要视网膜兴奋性神经递质,它通常在神经元内高水平表达,但在细胞外保持低浓度,使兴奋性毒性最小化。在DR中,已经证实了谷氨酸稳态的破坏[16]。本研究发现,与对照组相比,糖尿病组和空白组GLAST和GS表达在内核层和外核层中均明显下降,而给予RKIP慢病毒载体,使其在视网膜中表达并抑制p38-MAPK后,RKIP组视网膜中内核层和外核层GLAST和GS表达均升高,提示RKIP在一定程度上保护了Müller细胞。并且我们观察到,在给予RKIP慢病毒载体后,与糖尿病组和空白组相比,RKIP组视网膜中RGC密度明显升高,提示RKIP通过保护Müller细胞,进而阻止了RGC受到谷氨酸兴奋毒性的影响。
综上,在DR早期给予RKIP后可抑制视网膜中p38-MAPK通路,上调GLAST和GS表达活性,在一定程度上改善DR病理状态下Müller细胞的功能,从而减少谷氨酸兴奋毒性导致的RGC凋亡。但是RKIP通过抑制p38-MAPK通路对Müller细胞和RGC的保护作用机制是多信号途径的。因此,RKIP在DR状态下对视网膜神经损伤的保护作用方式还有待进一步研究。
致谢:非常感谢我的导师刘学政教授的支持和帮助,感谢左中夫副教授和刘文强老师的指导,感谢师弟师妹们的鼓励。

