伪鞘榕小蜂雌雄成虫触角感器的超微形态、分布及适生意义
李成星,刘志祥,杨 培,李宗波*
(1.云南省森林灾害预警与控制重点实验室,西南林业大学,昆明 650224; 2.云南中医药大学,昆明 650500)
解析群落结构和功能是当今生态学研究的重要内容之一,特别是寄生蜂与寄主间因互作和营养方式形成的多级功能群落,正如榕树-榕小蜂(Fig-associated chalcidoid wasps),已成为群落稳定、维持和级联关系研究的重要模型(Kerdelhuéetal.,2000;Proffitetal.,2007)。榕小蜂是一类依赖于榕树Ficusspp.隐头果(又称榕果)繁殖的膜翅目小蜂总科昆虫,分为传粉榕小蜂和非传粉榕小蜂。其中,传粉榕小蜂隶属于榕小蜂科Agaonidae的齿突榕小蜂亚科Agaoninae、畸足榕小蜂亚科Tetrapusiinae、甲米榕小蜂亚科Kradibiinae和鳃叶榕小蜂亚科Blastophaginae,为榕树传粉,两者已形成高度互惠的育幼传粉共生体;而非传粉榕小蜂分属于金小蜂科Pteromalidae、广肩小蜂科Eurytomidae、长尾小蜂科Torymidae、刻腹小蜂科Ormyridae和榕小蜂科的长鞘榕小蜂亚科Sycophaginae,不为榕树传粉,通过造瘿、寄居、寄生等负向方式影响互惠共生体(Cook and Rasplus,2003;Cruaudetal.,2010)。传粉榕小蜂和非传粉榕小蜂的雌雄成虫均具有二型性,繁殖策略分化明显。雌蜂形态与其它小蜂科昆虫相似,有翅和发达的复眼,需要在复杂的生态环境中选择合适的榕果,传粉榕小蜂利用雌花期榕果顶端松动的苞片口进入榕果内传粉和(或)产卵,而非传粉榕小蜂利用雌花前期、雌花期和间花期榕果,通常在果外产卵。产卵完成后即进入胚后发育,持续数周时间。待榕果发育至雄花期时,无论是传粉榕小蜂还是非传粉榕小蜂,产卵时间如何不同,所有的种类均同步发育成熟,唯一的差别是雄蜂先羽化。雄蜂翅和复眼退化明显,有发达的上颚和外生殖器,终生生活于果腔内,主要任务是搜寻并咬破含有雌蜂的瘿花并与之交配。交配结束后,传粉榕小蜂的雄蜂会主动挖掘出蜂口,允许雌蜂从果腔内爬出,各自迁飞寻找合适的榕果,开始新的生活史循环。
触角作为昆虫最为重要的感觉附肢,负责感知环境中的物理和化学信息,恰能反应其作为桥梁或中间体所承受的进化压力和形态适应性(Zacharuk,1985;Keil,1997;Basibuyuk and Quicke,1999;van Baarenetal.,2007;孟晶等,2015)。并且,触角感器类型、超微形态、分布等方面的精细对比,有利于了解昆虫的行为模式、进化趋势和亲缘关系(Ware and Compton,1992;Basibuyuk and Quicke,1999;van Baarenetal.,2007;孟晶等,2015;Dahakeetal.,2018;Diakovaetal.,2018)。例如,Dahakeetal.(2018)发现小豆长喙天蛾Macroglossumstellatarum触角上的机械感器可实时感知物体的运动状态,使其能够快速移动以确定食物的位置;Ozakietal.(2005)报道了日本弓背蚁Camponotusjaponicus触角上有一种专性的多孔锥形感器,可分辨出巢穴与非巢穴的表皮碳氢化合物。榕小蜂雌蜂寄主选择主要依赖于榕果的阶段性特异性气味(Proffitetal.,2007;Hossaert-Mckeyetal.,2010),而雄蜂配偶识别是利用雌蜂的体表碳氢化合物(Krishnanetal.,2014;Liuetal.,2019),但目前榕小蜂触角感器的研究主要集中在传粉榕小蜂触角上,很少涉及非传粉榕小蜂,特别是雄蜂(Ware and Compton,1992;Lietal.,2009;孟晶等,2015;Yangetal.,2018;Liuetal.,2019)。另一方面,非传粉榕小蜂雌蜂通常为卵育型寄生蜂,具有较长的寿命(Ghara and Borges,2010),在自然环境中寄主选择的持续时间也会比较长,面临的环境和威胁也比传粉榕小蜂雌蜂更为复杂,而先羽化的雄蜂在果内搜寻配偶,黑暗、密闭、狭小的环境构成了一个高度同源生境,而同源生境内物种(Sympatric taxa)的正选交配(Positive assortative mating)要比异源生境内的物种(Allopatric taxa)表现的更为强烈(Noor,1999;Krishnanetal.,2014),考虑到非传粉榕小蜂在整个群落组成中占比较小(Kerdelhuéetal.,2000;张媛等,2016),意味着雄蜂搜寻配偶需要花费更多的时间和精力,才能找到隐藏在众多不同种小蜂形成的瘿花中含有同种雌蜂的瘿花。
在前期研究的鸡嗉子榕榕蜂群落中,群落由传粉榕小蜂窝榕小蜂Ceratosolengravelyi,非传粉榕小蜂伪鞘榕小蜂Sycoscaptertrifemmensis、拉长鞘榕小蜂Sycophagacunia、缩腹榕小蜂Apocryptasp.、佩妃延腹榕小蜂Philotrypesisdunia5种寄生蜂组成,但后3种非传粉榕小蜂数量相对较小,加之季节变动的影响较大,并非在每个榕果都可发现(张媛等,2016)。因此,本研究选择群落中物种丰度较高又普遍共存的伪鞘榕小蜂为研究对象,对比和分析两性触角感器的种类、超微形态、分布及其生态适应性,特别是与其繁殖密切相关的化学感器和机械感器(Ozakietal.,2005;张媛等,2016;Dahakeetal.,2018),旨在加深对雌蜂寄主定位和雄蜂配偶识别机制的了解,并为开展单感器电位记录和化学受体的功能分析奠定理论基础。
1 材料与方法
1.1 伪鞘榕小蜂
伪鞘榕小蜂隶属于膜翅目金小蜂科延腹榕小蜂亚科Sycoryctinae,雌雄二型。雌蜂体长1.57±0.30 mm,产卵器长13.4±1.02 mm,体背面具有绿色金属光泽,腹面和足均淡黄色,仅在鸡嗉子榕间花期的雄果上产卵。一旦着陆在榕果表面,伪鞘榕小蜂即刻在果面爬行,开始一套固有的识别行为,如触角由上举转变为弯曲、敲击、横扫等,最后将产卵器插入榕果产卵(图1 A~D)。雄蜂无翅,通体黄褐色,在果内与雌蜂交配后即死去。
1.2 样品收集与保存
于中科院西双版纳热带植物园收集即将出蜂的雄花期榕果(21°55′N,101°15′E),将其带回实验室,待其自然出蜂后,雌蜂用乙酸乙酯直接杀死,雄蜂从剖开的榕果内挑取,雌雄各取20头。首先用10%生理盐水洗涤,接着超声波清洗,再置入2.5%戊二醛固定4 h(4℃),待用。

图1 伪鞘榕小蜂果外产卵的系列行为Fig.1 Fixed sequence of behaviors of female Sycoscapter trifemmensis ovipositing from outside the interfloral figs of Ficus semicordata注:A,雌蜂着陆在果面,伴随着上举的触角;B,触角下垂;C,触角敲击果面;D,产卵器弯曲,准备插入榕果产卵。Note:A,Female lands on the fig surface and hold its antennae upward;B,Female lowers the antennae;C,Female taps the fig surface with the tip of the flagellomere by curving the antennae downward;D,Female curves the ovipositor in order to lay eggs into the fig cavity.
1.3 扫描电镜观察
将固定好的样品经磷酸缓冲液(pH7.4)洗涤、酒精梯度脱水、临界点干燥(Leica EM CPD 300)后,于体视镜下摘取触角。触角按照背面、腹面和侧面3个方向粘在样品台上,每一面5个触角,镀金后用环境扫描电镜(Zeiss EVO LS 10)进行观察,设定电压为10 Kv。
1.4 触角感器的命名与统计分析
感器的分类和描述依据其形态、表面特征、孔的位置与数量,并参考Zacharuk(1985)、Keil (1997)、van Baarenetal.(2007)、Lietal.(2009)和Yangetal.(2018)的方法。用Image J测量触角各节及不同感器类型的长、宽、基部和感器窝直径,用2/3(2 πrh+πrl)计算多孔孔板形感器的表面积(Ware and Compton,1992)。为了较准确的统计触角各小节的感器数量,我们设定每一触角小节存在一个圆形截面(半径r),触角感器投射到截面即会增加截面距离(d),使得可视角度=180+2 acrcos(r/r+d),从而计算得出总感器数量为Vn360/(Vn可视数量,即直接从某一小节统计的感器数量)(Renthaletal.,2003)。用Mann-Whitney U检验雌雄触角及其不同感器类型数量、长度、分布的差异性,所有的数据分析均在R studio(R version 3.5.1)中完成。
2 结果与分析
2.1 触角形态
伪鞘榕小蜂雌雄成虫的触角均呈膝状,性二型(图2)。雌蜂触角长817.82±33.23 μm,由支角突、柄节、梗节和鞭节4部分组成,其中鞭节有11鞭小节;柄节长度是宽度的4倍,梗节为1.5倍,而支角突和各鞭小节近乎等长(图2 A;图3)。雄蜂触角长347.86±14.78 μm,包括支角突、柄节、梗节和6鞭小节形成的鞭节,柄节和锤头部明显膨大(图2 B)。在雌雄触角各节宽与长的对比中,发现雄蜂各节有明显缩短和增粗的特征,尤其是索节、第1棒小节和第3棒小节处(图2,P<0.0001)。
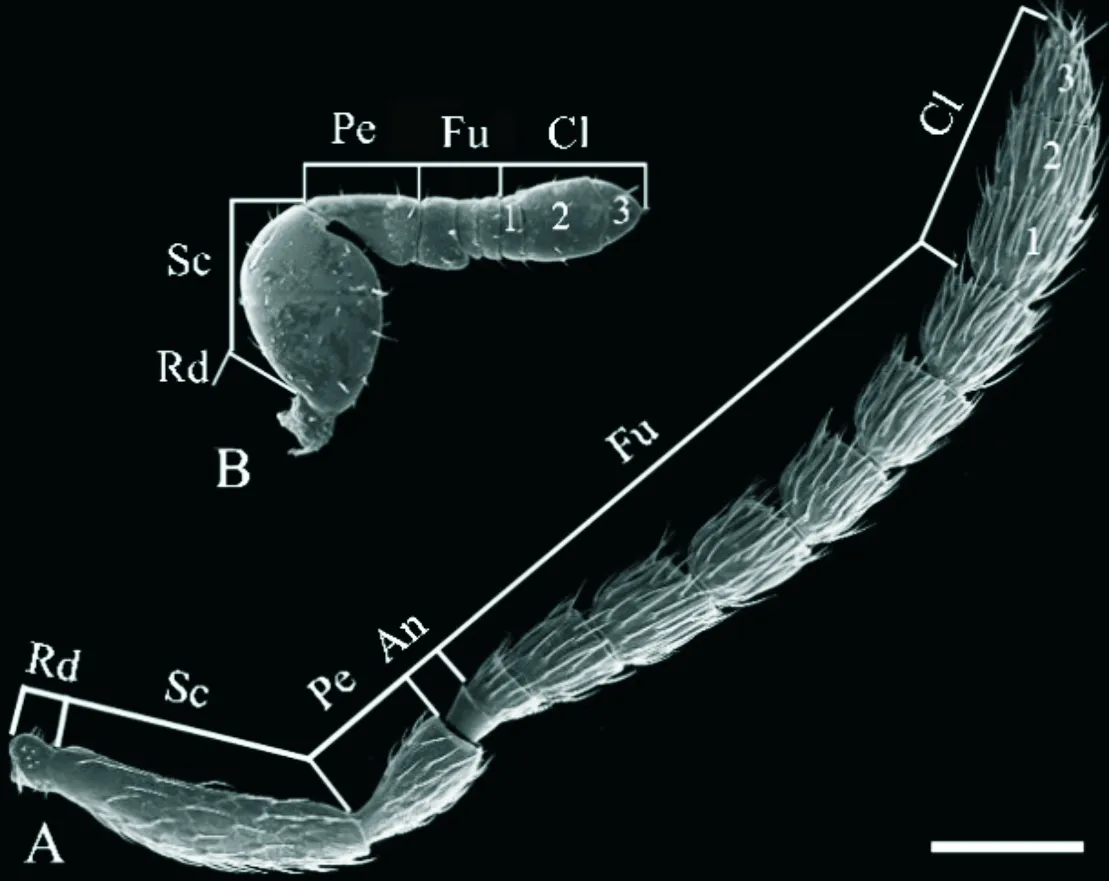
图2 伪鞘榕小蜂雌雄触角整体Fig.2 Whole antennae of female and male Sycoscapter trifemmensis注:A,雌蜂触角;Rd,支角突;Sc,柄节;Pe,梗节;An,环节;Fu,索节;Cl,棒节;1-3,第 1-3棒小节;以下缩写相同;B,雄蜂触角;比例尺为100 μm。Note:A,Whole antennae of female wasp;Rd,Radicula;Sc,Scape;Pe,Pedicel;An,Annellus;Fu,Funicle;Cl,Clava;The number shows subsegment occurs on the clava;The same acronyms for following figures;B,Whole antennae of male wasp.Scale bar=100 um.
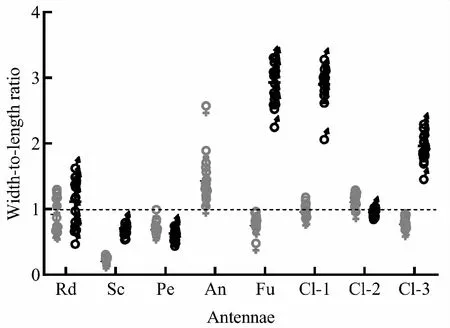
图3 伪鞘榕小蜂雌雄成虫触角各节宽度与长度的比Fig.3 Width-to-length ratio on the antennal (sub-)segment of female and male Sycoscapter trifemmensis
2.2 触角感器的类型
2.2.1毛形感器(Trichoid sensilla,TS)
是伪鞘榕小蜂雌雄触角上分布最广、数量最多、长度变化较大的感器类型(表1;图4 A~E;图6 A)。该感器外形呈纤毛状,基部位于一臼形窝内,从基部向端部逐渐变细,端部向触角主轴呈弧形弯曲,表面有8条纵向沟槽,并延伸至顶端(图4 F,J,L)。
2.2.2刺形感器(Chaetica sensilla,ChS)
外形似刺,外表光滑,刚硬,顶端尖锐(图4B,K,N)。根据其着生位置、表面及感器窝特征,将其分为3种亚型。刺形感器1(ChS-1)仅着生在雌蜂触角的索节和棒节处,与毛形感器混合分布于多孔板形感器之间;感器长33.10±2.32 μm,基部直接从触角表面突出,中部略微弯曲,指向触角主轴(表1;图4 B,G)。刺形感器2(ChS-2)仅在雄蜂触角柄节和梗节的侧腹面发现,长2.91±0.06 μm,基部位于一个近圆形的凹槽内(图4 C,N)。刺形感器3(ChS-3)在雌雄触角的支角突侧面和柄节与梗节交界处的腹面内侧均有发现(表1;图4 A,C),长度变化小,长8.68±2.30 μm,基部位于一个深圆形凹槽内,刺从凹槽内突出(图4 H,K)。
2.2.3锥形感器(Basiconic sensilla,BS)
外形似刚硬的椎体,端部钝圆,形态上可明显分化出处1型和2型,仅存在于触角棒节的顶端处(表1;图4 B~E)。锥形感器1明显从触角主轴突出,表面有9~11条纵向沟槽,延伸至感器顶端(图4 F,P)。锥形感器2(BS-2)仅分布在雄蜂触角上,均长8.32±1.32 μm,粗壮;表面光滑,感器顶端发现有多个似孔的凹刻(图4 O)。
2.2.4多孔板形感器(Multiporous placoid sensilla,MPS)
外形腊肠状,略微隆起于触角表面,表面有数量众多的微孔,可分为类型1(MPS-1)和2(MPS-2)两种(图 4,D,E,I)。MPS-1仅位于雌蜂触角第2索小节至棒节末端,感器长45.75±5.41 μm,中部宽4.55±0.69 μm;环形纵向排列在各鞭小节上,末端与触角主轴分离,其余部分均与触角表面愈合(表1;图4 I)。MPS-2仅分布于雄蜂触角第3棒小节处,尤以腹面最为明显,数量4~5个不等;长18.06±0.84 μm,中部宽6.42±1.01 μm,几乎平铺于触角表面(表1;图4 D,E)。
2.2.5栓锥形乳突状感器(Basiconic capitate peg sensilla,BCPS)
外形为乳突状椎体,乳突表面有11条纵向沟槽,锥体总长3.48±0.18 μm,位于一个较大的圆形凹槽内,凹槽直径1.72±0.13 μm(图4 G)。BCPS仅分布于雌蜂触角第3~7索小节和棒节处,通常一小节1个,但在第7索小节和第3棒小节偶见2个(表1;图4 B)。
2.2.6腔锥形感器(Coeloconic sensilla,CoS)
短锥体着生在一圆形凹槽内,椎体长1.87±0.88 μm,略微突出凹槽;感器表面光滑无孔,端部钝圆,仅分布于雄蜂触角柄节、索节和第3棒节侧腹面(表1;图4 C,D,M)。
2.3 雌雄蜂触角感器比较
伪鞘榕小蜂雌雄成虫触角各节着生的触角感器数量、分布、长度等存在明显差异,而同类型感器的基部宽度没有不同(表1;图5~6)。毛形感器在雌雄触角上均有分布,但雌蜂上的毛形感 器明显长于雄蜂(P<0.0001),且较长者主要分布在鞭节处(环节除外),较短者在柄节和梗节处;而雄蜂与此相反,较短的在鞭节处,较长的在柄节和梗节处,特别是柄节中部和端部各有一根超过50 μm的毛形感器(图4 A~C;图6A)。刺形感器1仅见于雌蜂触角上,长度明显大于刺形感器2和3;刺形感器2专属于雄蜂,而刺形感器3型则在两性触角上都有分布,且位置和数量保持一致(表1;图5)。锥形感器1在雌雄蜂触角上均有发现,但雌蜂上的锥形感器1显著长于雄蜂(图6 A,P<0.0001);而锥形感器2仅位于雄蜂触角上,更为粗壮突出(图4 D,E;图5)。多孔板形感器是雌雄蜂触角上最为典型的感器,1型和2型分属于雌蜂和雄蜂,I型呈环形排列在索节和棒节,长度为2型的3倍,数量为13倍;2型仅位于棒节末端,尤以腹面最为明显(表1;图4 D,E,I;图5),而1型的感器总表面积和单位孔数量均明显高于2型(总表面积0.0186±0.0021 μm2vs 0.0117±0.0011 μm2,P=0.00058;孔数量38±5 vs MPS-2 17±2个/μm2,P=0.0021)。栓锥型乳突状感器仅见于雌蜂,而腔锥形感器仅在雄蜂上发现,以柄节侧腹面最为丰富(图5)。

表1 伪鞘榕小蜂雌雄触角各节触角感器的类型、分布与数量Table 1 Type,distribution and abundance of different sensilla on the antennae of female and male Sycoscapter trifemmensis
注:a感器缩写参照结果,以下缩写相同。Note:The abbreviated and full name view results and keep the same for following figures.
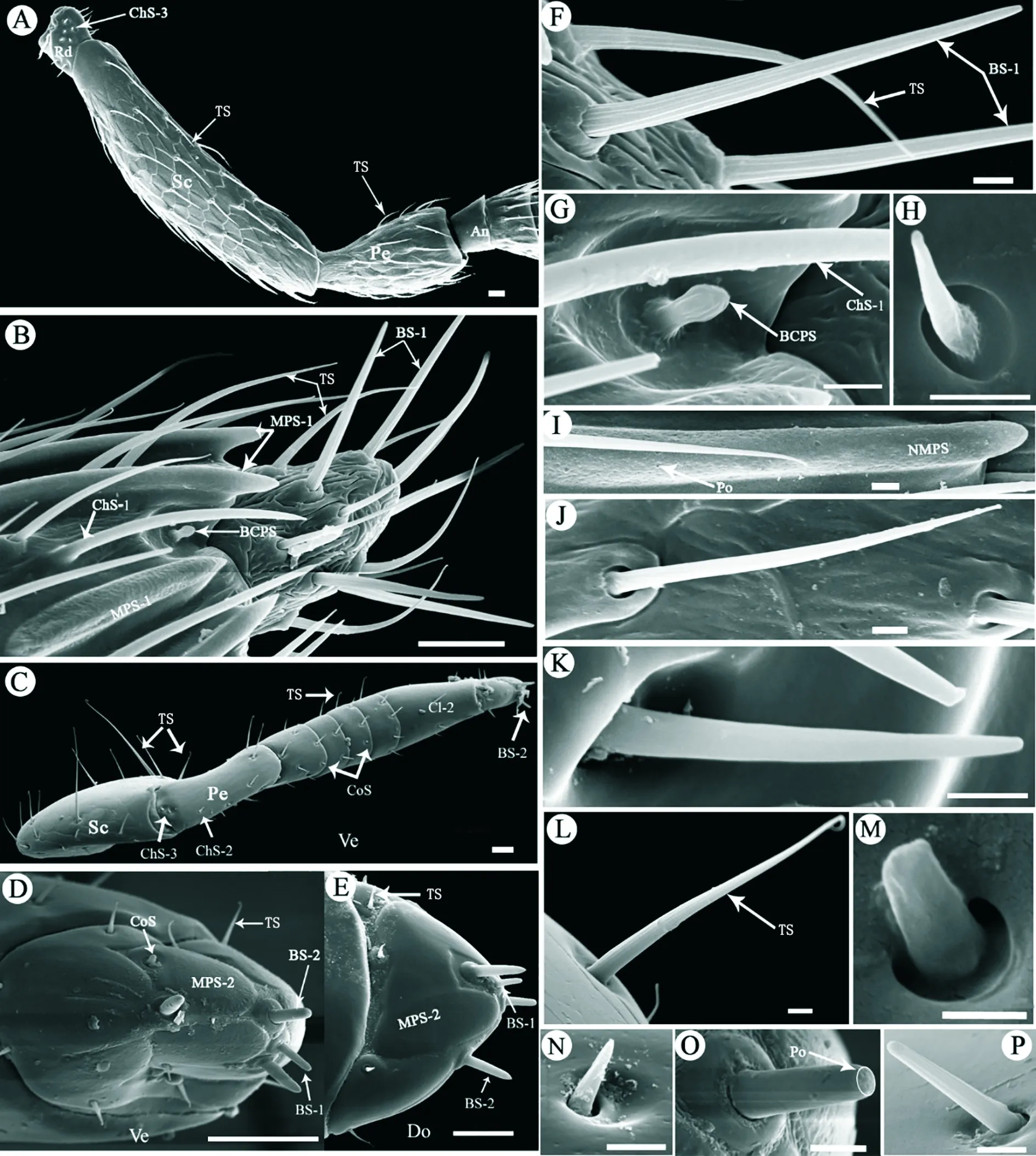
图4 伪鞘榕小蜂雌雄蜂触角感器类型、分布及超微形态Fig.4 Types,distributionand ultramorphology of different sensilla on the antennae of female and male Sycoscapter trifemmensis注:A,雌蜂触角基部侧面观;B,雌蜂棒节端部的各类感器;C,雄蜂触角腹面观;D,雄蜂棒节端部腹面观;E,雄蜂棒节端部背面观;F,毛形感器和锥形感器1的精细形态;G,刺形感器1和栓锥型乳突状感器的精细结构;H,刺形感器3;I,多孔板形感器1;Po,孔;J,雄蜂鞭节处的毛形感器;K,刺形感器3侧面观;L,雄蜂柄节处的毛形感器;M,雄蜂触角上的腔锥形感器;N,雄蜂触角上刺形感器2;O,锥形感器2;P,雄蜂棒节处的锥形感器1;A~E比例尺为10 μm,F~L和N~P为2 μm,M为1 μm.Note:A,Lateral view of basal segments of antennae of female wasp;B,Different sensilla on the tip of clava of female wasp;C,Ventral view (Ve) of the whole antennae of male wasp;D,Ventral view of the tip of clava of male wasp;E,Dorsal view (Do) of the tip of clava of male wasp;F,Fine structures of trichoid sensilla and basiconic sensilla type 1;G,Fine structures of chaetica sensilla type 1 and basiconic capitate peg sensilla;H,Chaetica sensilla type 3;I,Multiporous placoid sensilla type 1;Po,Pores;J,Trichiod sensilla on the flagellum of antennae of male wasp;K,Lateral view of chaetica sensilla type 3;L,Trichiod sensilla on the scape of antennae of male wasp;M,Coeloconic sensilla on the antennae of male wasp;N,Chaetica sensilla type 2 on the antennae of male wasp;O,basiconic sensilla type 2;P,Basiconic sensilla type 1 on the clava of antennae of male wasp.Scale bar,A~E=10 μm,F~L &N~P=2 μm,M=1μm.
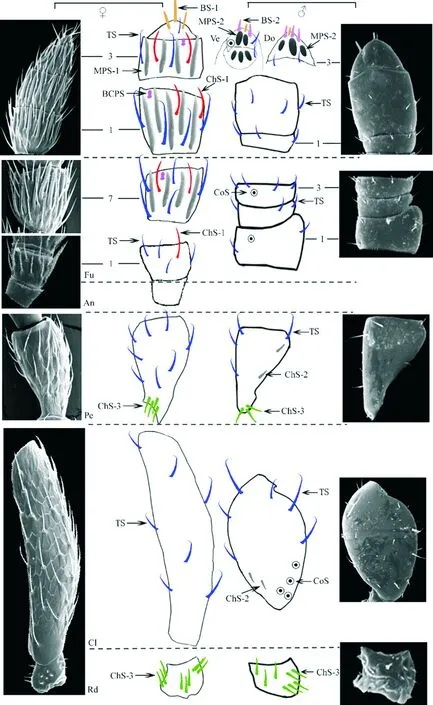
图5 伪鞘榕小蜂雌雄触角感器分布示意图Fig.5 Schematic diagrams of distribution of different sensilla on the antennae of female and male Sycoscapter trifemmensis

图6 伪鞘榕小蜂雌雄蜂触角上同类型感器的尺寸对比Fig.6 Comparison on the sensillar sizes of the same type of on the antennae of female and male Sycoscapter trifemmensis注:A,感器长;B,感器宽。Note:A,Length of the same type of antennal sensilla;B,Basal width of the same type of antennal sensilla.
3 讨论与结论
形态适生性是进化压力的反映与产物(Darwin,1891)。在阶段性榕果和配偶识别的繁殖压力下,榕小蜂产生了诸多的适应形态,如传粉榕小蜂雌蜂触角柄节的脊骨突(Spine-like expansion)和梗节的角锥型感器(Sensillum obscurum),这与进果和克服榕果苞片阻力有关(Lietal.,2009;孟晶等,2015;Yangetal.,2018)。但是,伪鞘榕小蜂是一种在果外产卵的非传粉榕小蜂,并不进入榕果,触角表现出与其它寄生蜂,如茧蜂、姬蜂、长尾小蜂等相似的形态,可能反映出它们在环境中相近的寄主选择习性,差别仅在于信息感知器官的形态、数量、分布等方面(Amornsaketal.,1998;van Baarenetal.,2007;Heratyetal.,2013;Huangetal.,2017;Diakovaetal.,2018;Gómez-Domínguezetal.,2018)。对于生活在榕果内的雄蜂来说,其信息感知器官主要是分辨配偶,并且要降低在瘿花之间移动所带来的阻力,其触角缩短和感器退化应与此关系密切(Keil,1997;Krishnanetal.,2014;孟晶等,2015;Liuetal.,2019)。通过扫描电镜观察,发现伪鞘榕小蜂触角上共存在6类10种感器,这些感器同样也在其它寄生蜂触角上存在,只是被给予了不同的名称,如毛形感器被称分为弯曲无孔型(ST1-AP)和直立无孔型(ST2-AP)(Diakovaetal.,2018),刺形感器3称为蒲姆氏鬃毛(Diakovaetal.,2018),栓锥型乳突状感器称为瓶形感器或凹槽钉形感器(Heratyetal.,2013)。对于感器的命名,本文并未将其长度作为分类的一个依据,这是因为形态、表面特征及其触角窝的高度相似可能昭示着这类感器为同功器官,长度的变化可能是昆虫做出适应性调整,过度的细分可能并不具有实际意义。因此,为了避免混淆以及正确反映感器的功能,文中只有感器的形态、触角窝、表面孔等出现了明显的分化,才将其作为一种新的感器类型。参照触角感器功能的划分方法(Keil,1997,1999;van Baarenetal.,2007),伪鞘榕小蜂触角上存在的各类感器可分为机械、化学和温湿度或CO2三类功能感器。其中,毛形和刺形感器的形态、分布、着生位置及其感器主体位于一个较大的触角窝内,符合一个机械感器的形态特征(Keil,1997)。尽管Amornsaketal.(1998)认为感器表面纵向的沟槽的是由无数的微孔构成的,但伪鞘榕小蜂触角上的毛形感器与传粉榕小蜂的毛形感器形态上极其类似,后者的内部结构显示其为厚壁无孔(Lietal.,2009),这使得有理由相信伪鞘榕小蜂触角上的毛形感器也是机械感器。刺形感器外形刚硬,长度分化意味着机械功能上可能有不同的作用,加之间花期榕果表面有较长的微绒毛,较长的刺形感器1和毛形感器可能具有协同和缓冲作用,避免小蜂用触角横扫果面时对位于下层的化学感器造成损伤(图1);而刺形感器2专属于雄蜂,着生位置与刺形感器1相似,很可能是刺形感器1的一种退化或遗留痕迹,刺形感器3位于节间处,可能与感知触角位置和运动时产生的本体机械刺激有关(Keil,1997;Diakovaetal.,2018;Yangetal.,2018)。表面具孔意味其是化学感器(Barlin and Vinson,1981;Steinbrecht,1997;Keil,1999),多孔板形感器和锥形感器2均显示有孔的结构,这些孔可允许气味分子进入感器淋巴腔,并与其内的气味蛋白结合产生信号信息(Wangetal.,2018)。尽管栓锥型乳突状感器和锥形感器1并未观察到表面有孔,但着生的位置以及与传粉榕小蜂上的同种感器的形态上高度相似,应具有化学信息感知的功能;栓锥型乳突状感器位于其它感器之下,可能与伪鞘榕小蜂感知长距离的榕果气味或短距离的果面低挥发性信息物质;锥形感器1明显突出于触角主轴,当伪鞘榕小蜂敲击榕果果面时,利于感知触觉信息(Steinbrecht,1997;van Baarenetal.,2007;Lietal.,2009;Wangetal.,2018)。对于腔锥形感器,Yadav &Borges(2017)用触角电位技术和生测法证实了腔锥形感器为一种CO2感器,伪鞘榕小蜂仅雄蜂触角上有腔锥形感器,形态上与进果的传粉榕小蜂触角柄节上的CoS-2相似,加之雄花期榕果果腔内具有较高的温湿度和CO2浓度(Altneretal.,1983;Grison-Pigéetal.,2001;Lietal.,2009;Diakovaetal.,2018),推测其可能为一种温湿度和CO2的复合感知器官。
伪鞘榕小蜂两性个体生活的环境截然不同,信息感知器官,特别是机械和化学感器出现明显分化是容易理解的。雌蜂在复杂的生态环境中搜寻识别寄主,一方面需要对阶段性榕果气味进行辨别,要求有较高丰度和表面积的多孔板形感器、栓锥型乳突状感器等化学感器的存在;另一方面又要对迁飞过程中运动状态进行判定,需要数量众多的毛形感器、刺形感器等机械感官的参与,最终才能搜寻到合适的榕果产卵(Proffitetal.,2007;Hossaert-Mckeyetal.,2010;Dahakeetal.,2018)。同时,毛形感器在雌雄蜂鞭节处有着相反的分布规律,雌蜂在果外飞行,雄蜂在果内爬行,两性个体运动状态差别巨大,这间接印证了毛形感器可能参与了物体运动状态的识别(Dahakeetal.,2018)。而对于生活于果腔内的雄蜂,因果腔内有大量的瘿花,瘿花与瘿花之间的距离较小,决定其在瘿花间移动的阻力较大,考虑到降低阻力和增加移动性,雄蜂触角机械感器的退化或数量大幅减少是合理的(表1),也是雄蜂适应果内生活所必需的。体表碳氢化合物作为一种低挥发性的信息化学物质,在促进雌雄个体的正选配偶识别过程中具有重要的作用,但果内生活使其化学感器,主要是多孔板形感器和锥形感器产生了明显的退化,特别是多孔板形感器仅在棒节末端的腹面残留4~5个,这显然是为了满足嗅觉定位和触碰证实同种配偶的需要(Liuetal.,2019)。此外,雄蜂棒节最为特殊是锥形感器2,其外部形态与日本弓背蚁触角上的锥形感器非常类似(Ozakietal.,2005),只是表面缺少孔的特征,下一步用单感器电位记录的方法将有助于证明其是否是一种专性的表皮碳氢化合物感知器官。因此,未来借助于气味结合蛋白和化感蛋白的克隆与分析,结合原位杂交实验技术,将有利于阐明伪鞘榕小蜂雌雄两性特定化学感器的功能和形态适应性的深层次原因。

