非酒精性脂肪性肝炎诊断研究进展
龙健灵,徐蕙,曾梦,杨磊,郑松柏*
(1.广州华银医学研究所有限公司,广东 广州 510700;2.南方医科大学基础医学院病理学系,广东 广州 510515)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种慢性、非传染性流行病。全球NAFLD 的流行率约为25%[1]。在亚洲,从城市到农村地区的患病率从高到低呈梯度变化。近年来NAFLD 患病率、发病率不断增高,发病年龄也出现低年龄化趋势,目前NAFLD 已经取代了慢性乙型肝炎,成为第一大慢性肝脏疾病。此外,NAFLD 在儿童中的流行率也很高,约为10%[2]。
NAFLD 两种常见的临床表现为非酒精性脂肪肝(non-alcoholic fatty liver,NAFL,又称单纯性脂肪肝)和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)。NAFL 往往是良性非进展性疾病,而NASH 可进展为肝硬化,在极少数情况下可导致肝细胞癌(HCC)[2-3]。
NASH 的诊断应排除:①过量饮酒史(男性> 210 g · d-1,女 性> 140 g · d-1)[4];②药 物 导 致 的 肝脏损伤;③其他肝脏疾病。目前,肝脏活检依然是公认的NASH 诊断金标准。近年来随着医学技术的发展,影像学及生物标志物越来越多地被应用于NASH 的诊断,本文从临床病史、病理学诊断、非侵入方法诊断等方面,对NASH 的综合诊断研究进展进行综述。
1 临床病史
对肥胖、糖尿病或多发性硬化症患者,应进行NAFLD 的筛查。大部分NAFL 或轻度NASH 患者无明显症状,有时会出现轻微的上腹压迫感及易疲劳[5]。大多数情况下,患者在常规体检中,常常由于血生化检测显示肝酶升高或超声检测显示肝脏脂肪变性,而疑似NAFLD。因此对于肥胖、高尿酸、2 型糖尿病患者以及三高(高血压、高血脂、高胆固醇)人群应重视NAFLD 的筛查。此外,由药物、毒素、脂肪代谢障碍、自身免疫和严重炎症疾病等因素引起的肝脏脂肪变性,在NAFLD 的确诊中,应进行充分评估。
2 病理诊断
肝脏活检仍然是诊断NASH 的金标准[6],也是目前唯一能可靠区分NAFL 和NASH 的方法;此外还是评估NASH 患者肝脏疾病进展或消退的有价值的检测方法。NASH 与酒精性肝病相似,随病程的进展而表现不同,包括肝细胞的脂肪变性、坏死、炎性细胞浸润和Mallory-Denk 小体形成,甚至有纤维化和假小叶形成[7]。目前普遍将脂肪变性作为NASH 最基本的病理学表现[2]。
为了更好地评估NASH 的疾病发展过程,为临床提供可量化的病理组织学评估,以及对治疗效果进行科学评价,近年来,病理学者致力于建立一套科学的组织学评估系统。NASH 临床研究网络病理委员会(the Pathology Committee of NASH Clinical Research Network,NASH-CRN) 提 出[8-9],NASH是指在没有大量饮酒的情况下,通过肝脏活检发现存在脂肪变性、炎症和肝细胞气球样变化,并且制定NAFLD 活动评分(NAS)的分级系统,该系统由14 项组织学指标构成,其中4 项进行半定量计分,包括:脂肪变性(0 ~ 3)、小叶内炎症(0 ~ 3)、肝细胞气球样变(0 ~ 2)、纤维化(0 ~ 4),另外9 项以“有”或“无”表示(见表1)[7]。NAS对各项组织学指标并无偏重,区分组织学改变的目的是为了评估整个NAFLD 活动度,而不是评估NASH 严重程度和进行NASH 诊断,但NAS 不能作为NASH 进展程度的评判尺度,它主要用于临床NASH 治疗后组织学改变的评估。学术界对NASH的组织学特征及NAS 仍存在较大的争议,不同的病理学家对NASH 的定义也不尽相同,对于病理工作者而言,准确地诊断NASH 仍存在一定的难度。在此基础上,美国肝脏疾病研究协会(Association for the Study of Liver Diseases,AASLD)提出了一个对于临床应用更加实用的标准,即脂肪变性> 5%、不同程度的肝细胞气球样变、不同程度的小叶炎症,该标准更加精确地提出了3 种指标的最低标准,得到更多肝病学家及病理学家的认可,也为多中心流行病学研究和临床试验提供了理论基础[10]。

表 1 NAFLD 组织学评分系统Table 1 Histological scoring system of NAFLD

续表1
由于纤维化被认为是NASH 进展阶段的一个标志,学术界近期提出一种改进的评分系统,称为SAF 评分,即:脂肪变性(steatosis,S,0 ~ 3);活动等级(activity,A,0 ~ 4)是气球样变(0 ~ 2)和小叶炎症(0 ~ 2)的未加权相加;纤维化(fibrosis,F,0 ~ 4)[11]。相比于NASH-CRN 提出的评分系统,SAF 评分在脂肪变性和气球样变上增加了对肝细胞大小及形状的描述。以含有大中型胞质内脂滴的肝细胞百分比评估脂肪变性(S0:< 5%;S1:5% ~ 33%;S2:34% ~ 66%;S3:> 67%)。肝细胞气球样变程度分为0 级(0 级:正常肝细胞,呈长方体形状,棱角分明,胞质呈粉红色,嗜酸性)、1 级(存在肝细胞簇,呈圆形,胞质苍白,常呈网状,形状虽不同,但大小与正常肝细胞相似)和2 级(与1 级气球样变肝细胞簇内的正常细胞相比,至少为2倍大小)。小叶炎症定义为小叶内有2 个或2 个以上的炎性细胞的病灶,在低倍镜下计数,分为0级(无病灶)、1 级(每个小叶< 2 个病灶)和2 级(每小叶> 2 个病灶)[11]。基于SAF 评分,研究者提出了一种算法——脂肪肝进展抑制(fatty liver inhibition of progression,FLIP)算法,用于区分在存在脂肪病变(即S ≥1)的情况下的NASH 和非NASH。FLIP 算法根据SAF 的3 个基本特征(脂肪变性、气球样变、小叶炎症)评价得分对NASH 进行分类区分,对于至少有5%的脂肪病变(即S ≥1)的病例,该算法列举了9 种可能情况进行诊断区别(见图1)[12]。此外,根据活动等级(A)和纤维化程度(F)来定义整体组织学严重程度,分成与NASH 轻度疾病(A < 2 和F < 2)和严重疾病(A > 2 和/或F > 2)。研究表明,基于SAF 评分的FLIP 算法可以减少病理学家、观察者之间的评定差异,更适用于临床诊断应用。
然而,任何的评分系统都不能完全代替肝脏活检的分析描述,进行肝脏活检时,获取高质量的组织标本是非常重要的。活检标本的长度为10 ~ 30 mm,直径为1.2 ~ 2 mm,占肝脏总质量的1/50 000[13],因此存在取样误差的重大风险。标本长度不够或碎片化、取样错误和观察者之间的差异等因素,将影响对肝脏损伤程度的正确评估。病理学家的经验程度也可能影响观察者之间的一致性。即使是专业的肝脏病理学家,NAS 评分也可能会有1 ~ 2 个点的差异,而且纤维化评分可能会有1 个点的差异。
Gunn 等[14]认为,不是所有疑似患有NAFLD的患者,都要进行肝活检。只有当肝活检可以改变患者的治疗建议,使患者意识到自己有严重的肝脏疾病,或者在临床数据不一致的患者中确认或排除NAFLD 时,才应进行肝脏活检。疑似患者的肝转氨酶、肝超声、其他原因引起肝病的血清学检测数据,以及患者是否有代谢综合征或超重等因素,应作为判断是否进行肝脏活检的依据。另外,大约30%的肝脏活检病例伴有短暂的疼痛、焦虑和不适,甚至可能危及生命的并发症(0.3%的病例出血,0.01%的病死率)[15]。
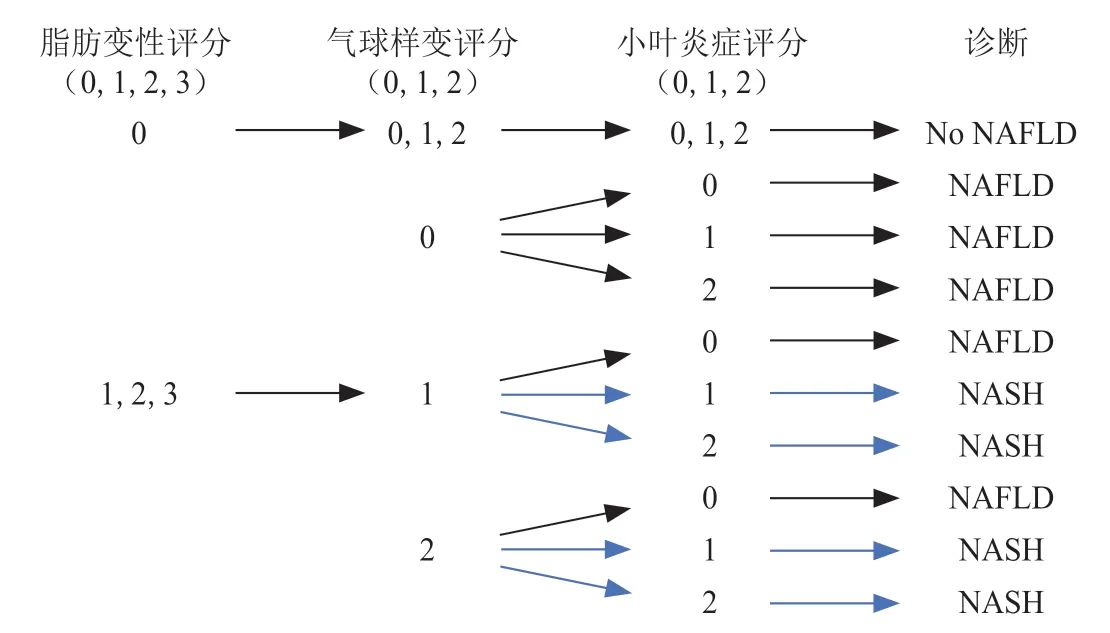
图 1 NASH 诊断算法Figure 1 Diagnostic algorithm for NASH
3 非侵入方法诊断
随着医学技术的不断发展,一些无创的方式越来越多被应用于诊断与预测NASH 及阶段性肝纤维化。这些方法包括预测模型[增强型肝纤维化(ELF)评分]和血清生物标志物检测。瞬时弹性成像(FibroScan,TE)或磁共振弹性成像(MRE)技术被用于评估肝硬度,可作为潜在肝纤维化的评估技术。总之,开发准确、安全和易于使用的非侵入性方法,以准确诊断和监测NASH 和相关的纤维化,在临床实践和临床研究中具有极其重要的意义。这些检测不仅对于进展性肝病的最大风险分层很重要,而且可以作为NASH 治疗性临床试验的适当替代终点。
3.1 常规实验室诊断
NAFLD 的实验室诊断中,最常见的异常参数为血清谷草转氨酶(AST)和谷丙转氨酶(ALT),在排除其他原因的肝脏损伤后,可作为NAFLD 的支持诊断[16]。当AST 与ALT 比值 < 1 可作为NASH的支持诊断。但部分NAFL 患者甚至NASH 患者的血清转氨酶处于正常水平,因此该参数不够敏感[17]。与其他肝脏疾病相同,NAFLD 患者血清谷氨酰转肽酶(GGT)和胆碱酯酶、血清铁蛋白水平也升高。在区分NAFLD 与其他肝脏疾病中,常规实验室的性能参数的敏感性及特异性没有达到令人满意的水平。然而,临床和实验室参数被纳入预测模型时可以提高诊断准确性。
各种评分系统也被逐步用于评估与预测NASH,这些系统都是基于各种临床表现和现成的生化检测,包括BARD 评分(包括BMI、AST 与ALT 比值、是否有糖尿病)[18]、NAFLD 纤维化评分(包括年龄、BMI、是否有胰岛素抵抗或糖尿病、AST、ALT 和血清白蛋白)[19],以及FIB-4(包括年龄、AST、ALT 和血小板计数)[20]。
3.2 影像学诊断
超声检查是脂肪肝变性诊断的一线检测工具,然而超声波检测微小脂肪变性能力很差,因此超声检测无法区分单纯性脂肪变性、NASH 以及肝硬化。计算机断层扫描(CT)只能评估中度脂肪变性,不能检测早期肝硬化或肝纤维化的程度。此外,还有辐射暴露的缺点。因此,CT 不作为诊断NAFLD 的常规项目。
磁共振成像(MRI)在检测微小脂肪变性和脂肪量化方面,优于超声检测和CT 检测。Leporq 等[21]通过同时定量NAFLD 患者的肝脏脂肪含量、脂肪酸组成、T2*横向松弛时间和磁化率,建立了脂肪性肝炎的诊断的磁共振定量检测方案。该研究对32例经活检证实的非脂肪肝性疾病患者进行验证,其中12 例患有单纯性脂肪变性,20 例患有NASH。32 例患者中,单纯性脂肪变性和NASH 患者的肝脏脂肪组分和T2*横向松弛时间和磁化率无明显变化。相比之下,NASH 患者的饱和脂肪酸含量比单纯性脂肪变性患者高(48.2%vs44.4%,P< 0.05),磁化率下降(P< 0.001),特征曲线下面积为0.91(95% CI 为0.79 ~ 1.0)。该研究表明,对肝脏脂肪含量、脂肪酸组成、T2*横向松弛时间和磁化率同时进行磁共振定量的检测方案对NASH 的诊断具有较高的诊断价值。
TE 是近年来应用较广的一种非侵入性检测方法,用于评估肝脏纤维化程度以及肝脏硬度。Boursier 等[22]报道了TE 评估的肝纤维化的阴性预测值(NPV)为90%,敏感性为88%,阳性预测值(PPV)为65%,与血液检测相比,更少的患者(43.6%)处于“灰色区域”。
3.3 基于生物标志物的诊断
NASH 的诊断依赖于肝活检,同时也受到病理学家的观察者间差异的限制。越来越多的研究者关注无创诊断,是否能找到适合的生物标志物成为NASH 诊断的一个关键。
NASH 中肝脏损伤的发病机制复杂,涉及多种激素、细胞和分子的干扰。这一复杂性导致了许多潜在的NASH 生物标志物的产生,这些标志物反映了潜在的疾病途径,包括肝细胞凋亡、炎症、氧化应激和异常的脂肪信号。血清转氨酶水平目前仍然是评估慢性肝病最常用的血液参数,然而,研究表明单独的ALT 水平不能很好地预测NASH[23]。
与单纯的脂肪变性相比,NASH 使肝细胞凋亡或坏死增加,并导致细胞角蛋白18(CK18)水平上调[24]。然而,基于CK18 的诊断方法敏感性和特异性分别为66%和82%,在临床应用中仍不够准确,为增加诊断价值,研究人员将CK18 与血清凋亡介导表面抗原FAS(sFAS)水平联合使用作为检测指标,其中sFAS 参与激活肝细胞内的外源性凋亡通路。一项研究表明,CK18 的M30 片段(CK18-M30)和sFAS 水平的结合使用具有合理到极好的准确性(曲线下面积为0.79 ~ 0.93),但其临床应用还亟待进一步的验证研究[25]。
炎症是NASH 的组织学特征之一,因此血清中C-反应蛋白(CRP)、IL-1 受体拮抗剂蛋白(IL-1RA)、IL-6、IL-8、肿瘤坏死因子(TNF)以及CXC-趋化因子10(CXCL10)等多种炎症标志物和介质水平被作为诊断标志物的研究对象。在一项648 例经活检证实的NAFLD 患者参加的研究中,对32 个血浆生物标志物进行检测后,发现IL-8、可溶性IL-1R1、总纤溶酶原激活物抑制剂1(PAI1)和激活的PAI1(aPAI1)的水平与NASH 相关。然而,在排除临床和代谢因素后,只有aPAI1 仍然可以预测NASH[26]。aPAI1 作为纤维蛋白溶解抑制剂,通过调控凝血功能从而增加心血管风险,但该指标不太可能是作为一项唯一标志物,还需通过进一步的研究与其他标志物联合诊断。
氧化应激是NASH 中肝脏损伤的主要致病机制之一,可对其导致的脂质氧化和血清产物进行检测。Feldstein 等[27]利用质谱法研究发现脂质氧化产物[11-羟基二十碳四烯酸(11-HETE)、羟基十八碳二烯酸(HODE)、氧化十八碳二烯酸(oxo-ODE)]与NASH 相关,由13-HODE 比值+年龄、BMI 和AST 构成oxNASH 评分,该评分目前已被证实对NASH 具有合理的诊断准确性。然而,对特殊设备的需求和标本处理的成本目前限制了脂质氧化产物作为NASH 诊断工具的广泛应用。
脂肪因子[包括脂联素、瘦素、抵抗素、内脂素(NAMPT)、视黄醇结合蛋白4(RBP4)、脂肪酸结合蛋白4(FABP4))]和肝源性激素[如成纤维细胞生长因子21(FGF21)]参与NAFLD 的发病过程,并与NAFLD 的严重程度密切相关,但不是NASH 的特异性血清标志物[28]。2017 年发表的一项研究分析表明血清FGF21 水平与NASH 之间存在一定的关联,然而,该生物标志物的敏感性和特异性仅分别为62%和78%[29]。铁蛋白作为一种急性期反应物,在NAFLD 和代谢综合征患者中常呈现为水平上调。有研究表明高铁蛋白血症与NAFLD患者的晚期纤维化之间存在相关性[26]。
肝纤维化是数百万肝病患者的常见病,但由于其分子机制的不明确,目前尚无有效的治疗方法。南方医科大学病理系周伟杰教授团队最新研究揭示了白细胞衍生趋化因子-免疫球蛋白样表皮生长因子同源性家族受体酪氨酸激酶1(LECT2-Tie1)信号通路通过调控肝脏门脉血管新生和肝血窦毛细血管化进而调控肝纤维化进程的新机制,并提出了应区别对待门脉血管新生和肝血窦毛细血管化在肝纤维化进展中的不同作用的新观点,提出靶向LECT2/Tie1 信号通路可能是肝纤维化的潜在治疗靶点,血清LECT2 水平可能是筛选和诊断肝纤维化的潜在生物标志物[30]。
CK18 是NASH 诊断中应用最广泛的血清学检测指标,但CK18 的诊断准确性仅为中等水平,尽管其他生物标志物或组合诊断有望成为诊断指标,但大多数尚未得到验证。不同的NASH 生物标志物在临床试验中的应用取决于研究药物的作用机制。例如,用于评估代谢变化、凋亡或细胞死亡、炎症或纤维形成的生物标志物可能与靶向肝细胞凋亡的药物更为相关。
4 结语与展望
在过去的几十年里,我们对NAFLD 的认知,已经从一个无法识别的实体演变成一个具有共同表现型肝脂肪变性的异质性重叠肝脏疾病的集合体。NAFLD 相当普遍,影响了全世界大约25%的成年人群体,其中的NASH 患者,特别是伴有严重纤维化的患者,在不良临床结果、死亡率以及重大经济负担方面面临着较高风险。庆幸的是,全球医学研究机构和产业界慢慢认识到该疾病的危害性,已在该领域投入大量人力和资金,相信在若干年以后,将有更加简单而精准的诊断手段及良好治疗药物面世,为患者带来福音。

