基于适配体技术对止咳平喘健康产品中非法添加的沙丁胺醇进行可视化快速检测
董嘉媚,刘亚雄,樊洪利,罗卓雅*
(1.广州中医药大学 中医药数理工程研究院,广东 广州 510006;2.广东省药品检验所 国家药品监督管理局 药品快速检验技术重点实验室,广东 广州 510663)
健康产品包括药品、食品、保健食品、化妆品,是人们最基础的日常生活用品[1]。沙丁胺醇(Salbutamol,SAL)是一种常用平喘药,属于β2受体激动剂[2]。研究表明,长期服用沙丁胺醇会对人的神经系统产生危害[3-4]。一些不法商家为了谋取利益,向声称具有止咳平喘效果的中成药以及保健品等健康产品中非法添加沙丁胺醇,严重损害消费者利益。
目前沙丁胺醇的常见检测方法包括色谱法和光谱法[5-8],如原国家食品药品监督管理局发布的食药监食监三[2016]28号文[9]《食品药品监管总局关于印发保健食品中非法添加沙丁胺醇检验方法等8项检验方法的通知》就采用了高效液相色谱法。但这些方法大多依赖贵重仪器、操作繁琐、需要专业人员且无法进行现场检验。沙丁胺醇的现场检测手段包括免疫法[10-13]和电化学法[14-17],但免疫检测中的抗体存在制备困难、价格昂贵、批间差异大等缺点[18-19];而电化学法也没有真正实现不借助仪器的现场快速检测。
核酸适配体(简称适配体,Aptamer)是一种短的单链核苷酸(DNA或RNA),对目标物具有高亲和力和特异性[20-21]。近年来,适配体以其体外合成、易于修饰以及稳定性高等优点[21-25]受到越来越多的关注。
本实验使用二氧化硅微球固定ssDNA结合蛋白(ssDNA binding protein,SSB)和辣根过氧化物酶(Horseradish peroxidase,HRP),并利用二氧化硅微球的大比表面积实现信号放大。其检测机理为,沙丁胺醇与SSB竞争与适配体结合,由于沙丁胺醇与适配体的亲和性更高,使得SSB与适配体组成的“开关”被沙丁胺醇打开,磁分离后,游离的二氧化硅微球@SSB@HRP复合物与其作用底物发生显色反应产生肉眼可见的结果。该传感器制备方法简单、灵敏快速、抗干扰性强,检测过程仅需45 min,无需任何仪器,实现了真实样品中非法添加沙丁胺醇的现场快速检测。
1 实验部分
1.1 仪器与试剂
磁力搅拌器(德国IKA公司);Nano-60超微量紫外可见分光光度计(德国Implen公司);离心机(美国Beckman Coulter公司)。
羧基化磁性微球(Magnetic beads,MB,直径3 μm,10 mg/mL)购自上海英芮诚生化科技有限公司;羧基化二氧化硅微球(SiO2,直径50 nm,50 mg/mL)购自北京中科雷鸣科技有限公司;ssDNA结合蛋白购自哈尔滨新海基因检测有限公司;乙醇胺和吗啉乙磺酸(MES)购自上海麦克林生化科技有限公司;沙丁胺醇标准品购于上海源叶生物科技有限公司;辣根过氧化物酶、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-Tetramethylbenzidine,TMB)、三羟甲基胺基甲烷(Tris)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)、N-羟基琥珀酰亚胺(NHS)和沙丁胺醇核酸适配体均购于上海生工生物科技股份有限公司;氨基修饰的沙丁胺醇适配体序列:5’-NH2-AGCAGCACAGAGGTCAGATGTTGTAAAACTTAATCAGCGATTCTCTATGTCTGCAATTACCCTATGC GTGCTACCGTGAA-3’[26];实验用水为去离子水。
1.2 缓冲液配制
偶联缓冲液(0.02 mol/L MES,pH 5.0);适配体结合缓冲液(BB,50 mmol/L Tris-HCl,5 mmol/L KCl,100 mmol/L NaCl,1 mmol/L MgCl2,pH 7.4);TMB缓冲液(0.1 mol/L Na3C6H5O7,0.2 mol/L Na2HPO4,pH 5.2);显色液(30% H2O2、1 mg/mL TMB乙醇溶液与TMB缓冲液以体积比1∶100∶900混合,现配现用)。
1.3 实验方法
1.3.1 磁性探针(MB-aptamer)的制备取0.1 mg MB分散于400 μL偶联缓冲液中,向其中加入偶联剂EDC-NHS(4∶1)至其最终质量浓度为10 mg/mL,室温活化30 min,以偶联缓冲液洗涤3次,除去多余偶联剂;取5 μL 浓度为100 μmol/L的沙丁胺醇适配体,95 ℃水浴5 min,立即置入冰浴中延展10 min,随后加入到活化的MB中,室温下振荡孵育1 h,得到磁性探针MB-aptamer;磁性分离,以偶联缓冲液洗涤3次,用400 μL含有1%乙醇胺的偶联缓冲液将MB-aptamer重新分散,室温下振荡孵育1 h封闭MB上残余羧基;磁性分离,BB洗涤3次,得到的磁性探针MB-aptamer悬于200 μL BB中备用。
1.3.2 二氧化硅微球-蛋白复合物(SiO2@SSB@HRP)的制备取5 mg羧基二氧化硅微球分散于900 μL偶联缓冲液中,加入偶联剂EDC-NHS(4∶1)至其最终质量浓度为10 mg/mL,室温下活化30 min;5 000 r/min离心5 min,沉淀洗涤3次后重悬于400 μL偶联缓冲液中;加入10 μL 10 μg/μL HRP和5 μL 2 μg/μL SSB,室温振荡孵育1 h;加入400 μL含有2%乙醇胺的偶联缓冲液,室温下振荡孵育1 h封闭二氧化硅微球上残余羧基;5 000 r/min离心5 min,去离子水洗涤3次,所得复合物标记为SiO2@SSB@HRP,悬于200 μL BB中备用。
1.3.3 磁性探针与二氧化硅微球-蛋白复合物的连接(MB-aptamer~SiO2@SSB@HRP)将上述得到的MB-aptamer与SiO2@SSB@HRP混合,37 ℃振荡孵育2 h;磁性分离吸弃上清液,BB洗涤3次,复悬后再于室温振荡孵育1 h,磁性分离吸弃上清液,BB洗涤3次,将结合不牢固的SiO2@SSB@HRP去除;最终得到的产物标记为MB-aptamer~SiO2@SSB@HRP,分散于300 μL BB中作为检测液,4 ℃保存备用。
1.3.4 沙丁胺醇的检测取“1.3.3”制备的检测液6份,每份50 μL,分别加入沙丁胺醇对照品和BB,使其最终体积均为100 μL,沙丁胺醇浓度分别为0、0.1、0.5、1、5、10 μmol/L,室温下捕获反应30 min;将6份待测液分别磁性分离,小心吸取上清液70 μL于新的1.5 mL EP管中;加入100 μL TMB-H2O2显色液,观察颜色变化,判定结果。
2 结果与讨论
2.1 实验原理
如图1所示,氨基修饰的沙丁胺醇适配体与羧基修饰的磁性微球偶联构成磁性探针MB-aptamer,二氧化硅微球负载HRP与SSB得到SiO2@SSB@HRP复合物,通过SSB与单链DNA(适配体本质是单链DNA)的结合作用将磁性探针MB-aptamer与SiO2@SSB@HRP连接形成检测复合物MB-aptamer~SiO2@SSB@HRP。当待测液中存在适配体的靶标,即目标物沙丁胺醇时,由于SSB与适配体的亲和作用(Kd=1.1 μmol/L)[27]小于适配体与沙丁胺醇的亲和作用(Kd=53.60 nmol/L)[26],因此沙丁胺醇将与适配体特异性结合,同时适配体与SSB的结合作用被破坏,即沙丁胺醇作为“钥匙”,将适配体与SSB组成的“开关”打开。最终,检测复合物MB-aptamer~SiO2@SSB@HRP产生MB-aptamer~SAL与SiO2@SSB@HRP两部分产物,经过磁性分离,MB-aptamer~SAL位于EP管底部,而上清液中的SiO2@SSB@HRP复合物被吸取并与HRP的底物TMB进行反应,产生肉眼可见的蓝色现象,从而可进行结果判定。

图1 基于适配体传感器检测沙丁胺醇原理Fig.1 Detection of SAL by the developed aptamer sensor
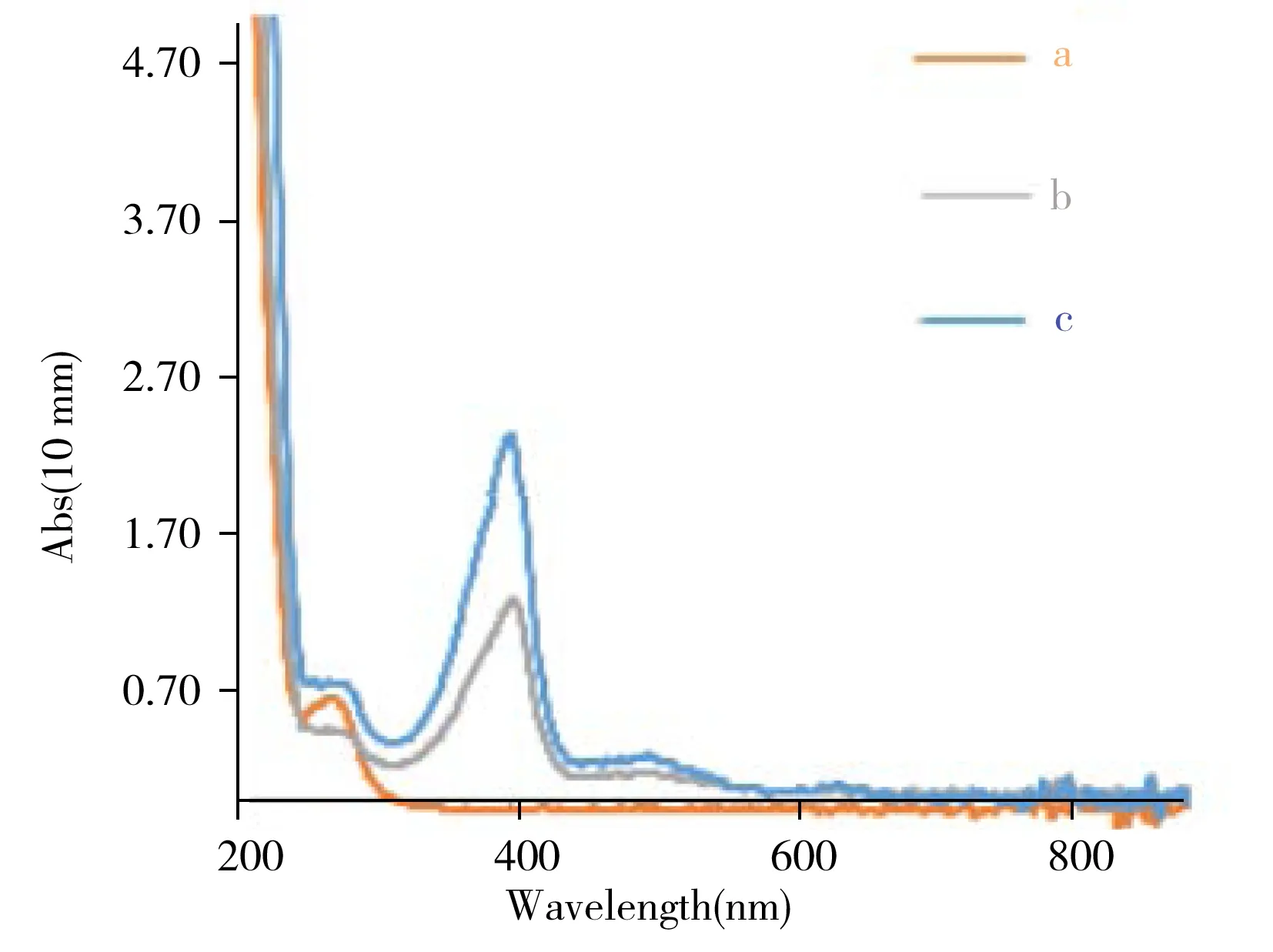
图2 SiO2@SSB@HRP复合物表征图Fig.2 UV-Vis spectra of HRP(a),SSB(b) and SiO2@SSB@HRP(c)
2.2 SiO2@SSB@HRP表征
应用紫外-可见分光光度法对SiO2@SSB@HRP复合物进行表征。如图2所示,SSB和HRP分别在270 nm和403 nm处有吸收峰(曲线a,b),而SiO2@SSB@HRP复合物在波长270 nm和403 nm附近出现吸收峰(曲线c),证明SSB、HRP负载成功,即SiO2@SSB@HRP复合物制备成功。
2.3 实验条件优化
2.3.1 磁性微球与沙丁胺醇适配体比例优化取0.1 mg磁性微球,分别与不同体积(1、2、5、8、10 μL)的适配体(浓度为100 μmol/L)进行实验,发现体系吸光度随着适配体体积的增加先升高后降低,当适配体体积为5 μL时获得最大吸光度。因此选用0.1 mg磁性微球与5 μL适配体(100 μmol/L)制备MB-aptamer。
2.3.2 SSB与HRP比例优化取5 mg二氧化硅微球,分别与SSB和HRP不同质量比的混合物(10∶1、1∶1、1∶10、1∶25、1∶50)进行实验。结果表明SSB和HRP比例为1∶10时可获得最大吸光度,因此选用SSB和HRP的质量比为1∶10。
2.3.3 二氧化硅微球与SSB及HRP的结合比例优化取5 mg二氧化硅微球,分别与不同质量的SSB与HRP混合物(2、5、10、20、25 μg SSB分别对应与20、50、100、200、250 μg HRP混合)进行实验。结果表明HRP取100 μg、SSB取10 μg时可获得最大吸光度。因此选用5 mg二氧化硅微球与100 μg HRP、10 μg SSB制备SiO2@SSB@HRP。
2.3.4 MB-aptamer与SiO2@SSB@HRP结合比例优化取“2.3.1”优化方案制备得到的200 μL MB-aptamer分别与“2.3.3”优化方案制备得到的不同体积(50、100、200、300、400 μL)的SiO2@SSB@HRP进行实验。结果显示,吸光度随着SiO2@SSB@HRP体积的增加先增加后趋于平缓,当SiO2@SSB@HRP的体积为200 μL时获得最大吸光度,因此选用200 μL MB-aptamer与200 μL SiO2@SSB@HRP进行实验。
2.3.5 显色反应时间优化为确定结果判定的最佳时间,对一系列反应时间的吸光度进行测定。发现当显色反应时间为15 min时,吸光度达到最大值,因此选择15 min作为显色反应时间。
2.4 沙丁胺醇加标实验
对一系列浓度梯度沙丁胺醇进行检测,显色反应产物用超微量紫外-可见分光光度计定量检测。结果显示,显色反应产物的颜色随沙丁胺醇浓度增加逐渐加深,当浓度达到10 μmol/L时,显色反应产物的颜色由蓝色变为绿色。沙丁胺醇浓度在0.1~10 μmol/L(23.9~2.39×103μg/L)范围内与体系吸光度呈良好的线性关系(r2=0.995 9)。通过一系列浓度梯度的加标实验确定检出限为0.1 μmol/L(23.9 μg/L)。与已报道的沙丁胺醇检测方法以及原国家食品药品监督管理局关于保健食品中非法添加沙丁胺醇检测标准相比(表1),本文所构建的适配体传感器具有较低的检出限,满足对止咳平喘健康产品中非法添加沙丁胺醇的检测需求。此外,本方法操作简单,可用于现场检测。

表1 不同分析方法检测沙丁胺醇的比较Table 1 Comparison of methods for SAL detection
2.5 特异性实验

图3 传感器的特异性实验Fig.3 Specificity against CLB and RAP concentration of SAL,CLB and RAP is 10,1,1 mmol/L, respectively
克伦特罗(Clenbuterol,CLB)、莱克多巴胺(Ractopamine,RAP)与沙丁胺醇的分子结构相似,都属于β受体激动剂。因此用CLB和RAP考察传感器的特异性。结果显示,肉眼观察浓度为1 mmol/L的CLB和RAP模拟样品均未出现显色反应。紫外-可见分光光度法验证结果如图3,二者检测结果吸光度与空白相近,可忽略不计,表明所研制传感器特异性良好。
2.6 稳定性实验
制备5批次传感器,同时测定10 μmol/L沙丁胺醇,相对标准偏差(RSD)为3.6%;使用同一批传感器,连续5 d测定10 μmol/L沙丁胺醇,RSD为 5.2%,说明该传感器具有良好的重现性。
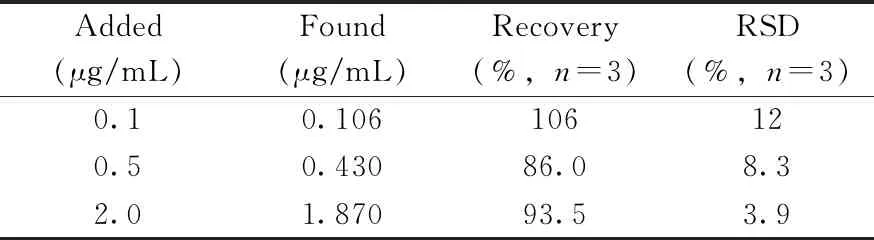
表2 加标回收实验结果Table 2 Results of recoveries
2.7 实际样品中沙丁胺醇的检测
为验证所构建传感器检测实际样品的可行性,采用标准加入法检测止咳平喘中成药中沙丁胺醇的回收率。取某品牌声称具有平喘作用的中成药,高效液相色谱法验证其为沙丁胺醇阴性。取此中成药1片(0.5 g),研成粉末,去离子水充分溶解后离心,取上清液,制备低、中、高3个不同水平的沙丁胺醇(表2)加标样品,进行实验。结果显示其回收率为86.0%~106%,RSD在15% 以内,证明开发的适配体传感器对实际样品检测具有应用前景。
3 结 论
本研究基于核酸适配体技术,通过大比表面积的二氧化硅微球固定SSB与HRP,达到信号放大作用,利用SSB与适配体结合的特点构建传感器“开关”,基于沙丁胺醇与SSB之间对适配体结合的竞争作用,最终借助磁性分离获得游离SiO2@SSB@HRP并催化TMB产生肉眼可见的颜色变化,建立了健康产品中非法添加沙丁胺醇的可视化检测方法,检出限为0.1 μmol/L。本方法具有快速、灵敏、肉眼可视、低成本且易操作的优势,可用于实际样品中沙丁胺醇的可视化快速检测。此外,只需改变适配体序列即可构建针对其它目标物的检测传感器,进一步扩展此传感器制备方法的应用范围。

